a sejtciklus-gátló bevezetése
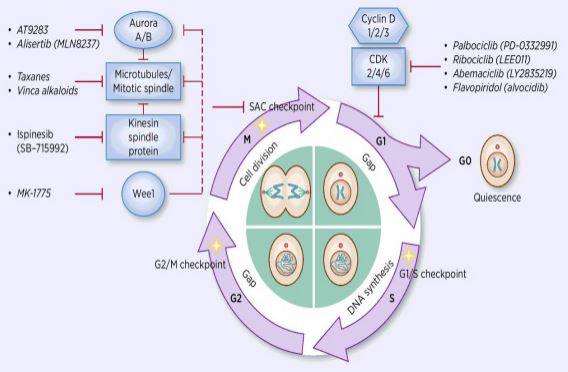
a sejtciklus-szabályozás folyamata különböző szabályozó tényezők aktiválása vagy inaktiválása az ellenőrző pontok felügyelete alatt, ezáltal megindítva a sejt DNS-replikációjának és két leánysejtre osztódásának folyamatát. Számos sejtciklus-szabályozó közül a ciklin-függő kináz (CDK) áll a középpontban, és ez egy hálózati rendszer, amely ciklin-és ciklin-függő kináz inhibitorokkal (cki-K) szabályozza a sejtciklust. A CDK-k a szerin/treonin kinázok egy csoportja, és jelenleg 13 faj található, köztük a CDK1~13, amelyek szerepet játszanak a CDK-k sejtciklusának szabályozásában és a CDK-k transzkripciós szabályozásában. A sejtciklus szabályozása valójában az ellenőrző pontok szabályozása, a G1 / S szabályozási pontok a legfontosabbak. Amikor a sejtciklust külső jelek, például növekedési faktorok stimulálják, a cdk4/CDK6 katalitikus alegység kötődik a szabályozó Ciklind alegységhez, a CDKs-maradékok pedig foszforilezéssel/defoszforilezéssel aktiválódnak. A CDK-k aktiválása után az Rb fehérjét foszforilezzük. Az RB gén, más néven retinoblastoma gén, az első klónozott tumorszuppresszor gén, amely képes transzkripciós faktorokkal (például E2F) komplexet képezni a fehérje foszforilezése után. Az E2F fontos szerepet játszik a sejtciklus szabályozásában, indukálja a ciklin és a CDK2 expresszióját, és ciklin/CDK2 komplexet képez, amely tovább foszforilálja az Rb fehérjét és teljes mértékben felszabadítja az E2F-et. ezt követően az E2F belép a sejtmagba, hogy aktiválja a sejtciklusok sorozatát S fázisba. A DNS-replikáció késői fázisában az S fázisban a CDK2-t ciklin aktiválja, amely időben inaktiválja az E2F transzkripciós faktort, megakadályozva a tartósan aktivált E2F által okozott apoptózist. a kutatási statisztikák azt mutatják, hogy a humán rákok több mint 90% – ában mutációk vannak a kapcsolódó génekben a CDK, ciklin, cki és Rb útvonalakon, a CDK és a megfelelő szabályozó alegység ciklin a leggyakrabban diszfunkcionális. Ezenkívül a sejtciklus ingadozása elősegíti a kemoterápiás rezisztenciát és csökkenti a kemoterápia hatásait. Ezért a CDK/ciklin aktivitás szabályozása, amely helyreállítja a normális sejtciklust, az egyik stratégia a daganatok kezelésére.
a sejtciklus inhibitorokat klinikailag használják
a kábítószer-kutatók a CDK és a ciklin inhibitorok különböző típusainak megtalálására összpontosítottak, mint élvonalbeli rákellenes gyógyszerek. Jelenleg a CDK inhibitorok elsősorban az endogén és az exogén. Az endogén kis molekulájú inhibitorok legnagyobb osztálya az alacsony molekulatömegű fehérjék, amelyeket a szerkezeti funkciók különbségei szerint két nagy kategóriába sorolnak, az egyik osztályt pedig az INK4 kettős specifikus családnak nevezik, beleértve a P15, p16, p18, p19, amely gátolja a fehérjecsaládot. A ciklind-asszociált kináz gátló-függő fehérje kötődik a megfelelő szabad CDK4-hez, ezáltal blokkolja a CDK4 kötődését a megfelelő ciklindhez, hogy katalitikus dimer komplexet képezzen. A másik osztályt Kip családnak hívják, beleértve a P21, P27,P57. Ez a fehérjecsalád a dimer komplexből álló dimer komplexet alkothat ciklin E/CDK2 és ciklina/CDK1, blokkolva a dimer katalitikusan aktív központját. Ezen endogén inhibitorok gátlása a kináz komplextel kombinálva specifikusan szabályozza annak aktivitását, ezáltal pontosan szabályozza a sejt átalakulását G1-ről S fázisra. Tanulmányok kimutatták, hogy a többszörös daganatok előfordulása és kialakulása a CDKs/ciklinek csökkent expressziójával vagy az endogén inhibitorok csökkent expressziójával jár, mint például a P16 deléciója, amely kapcsolatban áll a melanoma, a tüdőrák, az emlőrák és a vastagbélrák kialakulásával. A P27 fehérje deléciója gyakori emlőrákban, prosztatarákban, vastagbélrákban és gastrointestinalis rákban. Ezért az endogén CDKs inhibitor vagy a génmutáció deléciója fontos referencia a tumor diagnózisához. Az endogén kis molekulájú inhibitorok szintén az utóbbi években felfedezett fontos, nem kódoló RNS-ek osztályai. A célterület régiói kötődnek egymáshoz, hogy gyorsan és hatékonyan lebontják az mRNS-t, vagy gátolják a fehérje transzlációját, alacsonyabb vagy optimális szinten szabályozzák a fehérjét, és életaktivitást igényelnek. Több mint 10 mikroRNS-t fedeztek fel a sejtciklus szabályozásában. Közülük a miR1-2 és a miR3-4 a CDK4-et célozza meg, a sejtciklus pedig a G1 fázisban leáll, ami gátolja a tumorsejtek proliferációját; a MIR-22 a CDK6 sejteket célozza meg. A ciklus stagnál a G1 fázisban, ami öregedést vált ki az emlőrákos sejtekben. Különböző biológiai folyamatokban ezek a miRNS-ek szabályozzák a sejtciklus progresszióját az E2F, CDK, ciklin, P21, P27, DNS-polimeráz alfa stb. a sejtciklus kulcsfontosságú szabályozóinak előmozdítása vagy blokkolása. Az exogén inhibitorok közé tartoznak az antiszensz nukleinsavak, antitestek, kis interferáló RNS interferencia (siRNS) és kis molekulájú vegyületek. A kis molekulájú vegyületek az exogén CDK-gátlók legfontosabb osztályai. Az elmúlt években, mivel a kristályszerkezet megértése lehetővé teszi az emberek számára molekuláris szimulációs vizsgálatok elvégzését, áttörések történtek a CDK-k kémiai inhibitoraival kapcsolatos rendkívül hatékony és szelektív vizsgálatok tervezésében és fejlesztésében. Elmondható, hogy az ilyen vegyületeknek minden nap új tagjai vannak. Jelenleg a kis molekulájú CDK inhibitorok a következő 13 kategóriába sorolhatók: Roscovitin és Olomouc, pirimidinek (PD-033299), flavonoidok (Flavopiridolok), Tiazolok (SNS03), antracén és származékai (SU951), piperidon (Paullonok), imidazopiridin, pirazolopiridin (AZ703), pirazinok ( AT751), butirolakton-1 (butirolakton-1), scorpionine (UCN-01) és más két faj. Tizenhárom kis molekulájú inhibitor lépett be klinikai vizsgálatokba. Ezek mind sík heterociklusok kis molekulájú vegyi anyagai, amelyek versenyeznek az ATP-vel a CDK-kináz ATP-kötőhelyéhez való kötődésért. Az In vivo kísérletek azt mutatták, hogy a CYC202 jó gyógyszerrezisztenciával és jó orális fiziológiai aktivitással rendelkezik, és nyilvánvaló gátló hatással van a szilárd tumorokra az emberi vastagbélrákkal és méhrákos sejtekkel beoltott meztelen egerekben. Az IB fázisú vizsgálatokban 10 petefészekrákos beteg több mint 20 hónapig szedte a CYC-t, a daganatok növekedése vagy a kezeléssel összefüggő súlyos mellékhatások nélkül, amelyek között egy beteg daganata több mint 30% – kal csökkent, és néhány olyan beteg, akit több mint egy éve kezeltek, stabil állapotban van. Fázisú klinikai vizsgálatok azt találták, hogy a CYC202 önmagában kissé gyengébb hatással rendelkezik, és más kemoterápiás gyógyszerekkel kombinálva hatékony. Fázis IIb klinikai vizsgálatok is folyamatban vannak a cyc202 és kapecitabin kombinációjával az emlőrák kezelésére, 2,2-difluorodeoxycytidinnel vagy ciszplatinnal kombinálva a tüdőrák és nasopharyngealis carcinoma kezelésére. A kis molekulájú RNS interferencia technológia kifejlesztése és alkalmazása lehetővé tette a specifikus beavatkozási célmolekulák génexpressziójának tanulmányozását, és sok tudós kezdett beavatkozni a CDK/ciklin szintézisébe genetikai szinten. Limaet al. transzfektált ciklin-célzó siRNS Hep3B, HepG2, SNU449 (ciklin túlexpresszió) és HuH7 (ciklin túlexpresszió), és megállapította, hogy a ciklin expresszió 90% – kal csökkent a sejtekben. A DNS-szintézis jelentősen csökken, a sejtek apoptózison mennek keresztül. Galimberti et al. transzfektált siRNS célzó ciklin, CDK2, és CDK1 egér tüdőrák sejtek HOP-62, H-522 és H-23, és megállapította, hogy a ciklin/CDK2 indukálhatja apoptózis és gátolja a proliferációt a tüdőrák sejtek. A cdk1 siRNS interferencia által okozott csökkent CDK1 expresszió csak sejtfázis-leállást okoz és lassítja a sejtproliferációt; míg a CDK1 és CDK2 siRNS együttes interferencia a CDK1 és CDK2 expresszió egyidejű csökkenéséhez vezet, rezisztenciát okozva a sejtciklus S és G2/M fázisaiban. A stagnálás a sejtek apoptózisát is kiváltotta. A CAO Yinfang és a CDK2/ciklin siRNS rekombináns expressziós vektor HepG2 sejtekbe történő sikeres transzfekciója azt mutatta, hogy a CDK2 és a ciklin mRNS expressziója jelentősen csökkent, a sejtciklus leállt az S fázisban, a G1 fázissejtek jelentősen növekedtek, a kaszpáz-3 aktivitás fokozódott, a HepG2 sejtek apoptózison estek át, és a sejtciklus változásai összhangban voltak a HepG2 sejtek csökkent proliferációjával vitro transzfekciót követően.
a sejtciklus-gátló funkciója
a sejtciklus-szabályozás fontos szerepének megértésével a tumorképződésben és az apoptózisban a sejtciklus-szabályozást tovább tanulmányozták a tumor kemoterápiás rezisztenciájában. A ciklinfüggő kinázok (CDK-k), amelyek szerepet játszanak a sejtmotor vezetésében a sejtciklus alatt, ideális célpontok a tumorterápiához. A legtöbb rákos sejt aktivációval, a sejtosztódási ciklus (cdk) génjének túlzott expressziójával és a CDKIs funkció hibáival rendelkezik. A CDK inhibitor megszakító hatást fejt ki, amely gátolja a sejtciklust. Az elmúlt években a Cdki-k a rákterápia egyik legfontosabb fénypontjává váltak, amely gátolja a CDK-k aktivitását a sejtciklusban. Számos klinikai vizsgálat azt is kimutatta, hogy egyetlen alkalmazásnak mérsékelt hatása lehet. A hagyományos citotoxikus kemoterápiás gyógyszerekkel kombinálva azonban a Cdki-k jelentősen fokozhatják a hagyományos kemoterápiás gyógyszerek tumorellenes hatását. Ezért a CDKIs gyógyszerek és más kemoterápiás gyógyszerek rákellenes hatásainak kutatása forró ponttá vált a tumorr-rezisztencia jelenlegi kezelésében.
referencia
- Bendris N, Lemmers B, Blanchard J M. sejtciklus, citoszkeleton dinamika és azon túl: a ciklinek és a CDK-gátlók számos funkciója. Sejtciklus. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt S G, et al. A nukleáris kinázok megcélzása a rákban: sejtciklus kináz inhibitorok kifejlesztése. Farmakológia & terápiák. 2014, 142(2):258-269.
- Stone A, Sutherland R L, Musgrove E A. a sejtciklus-kinázok inhibitorai: a legújabb előrelépések és a jövőbeli kilátások mint rákterápiák. Onkog Kritikus. 2012, 17(2):175-198.
- Xu W, Mcarthur G. sejtciklus-szabályozás és Melanoma. Aktuális Onkológiai Jelentések. 2016, 18(6):34.
- Malumbres M, Barbacid M. Cell cycle, CDKs és rák: változó paradigma. A Természet Áttekinti A Rákot. 2009, 9(3):153-166.
