a kannabinoid antagonisták kifejlesztésének első megközelítése az 1980-as évek végén a THC szerkezetének módosítása volt, de az eredmények csalódást okoztak. Az 1990-es évek elején új kannabinoid agonista családot fedeztek fel az NSAID (nem szteroid gyulladáscsökkentő) pravadolin gyógyszerből, amely az aminoalkil-indol antagonisták felfedezéséhez vezetett, néhány, de korlátozott sikerrel. Mivel az agonisták szerkezetén alapuló kutatás csalódást okozott, nem volt meglepő, hogy az első erős és szelektív kannabinoid antagonista egy teljesen új kémiai családba tartozott. 1994-ben az első szelektív kannabinoid antagonistát, az SR141716-ot (rimonabant) az 1,5-diaril-pirazolok családjába tartozó Sanofi vezette be.
RimonabantEdit



a Rimonabant , amelyet szisztematikus néven is ismerünk, egy 1,5-diarilpirazol CB1 receptor antagonista (2.ábra). A Rimonabant nemcsak a CB1 receptor erős és nagyon szelektív liganduma, hanem orálisan is aktív és antagonizálja a kannabinoid agonisták, például a THC hatását, mind in vitro, mind in vivo. A Rimonabant egyértelmű klinikai hatékonyságot mutatott az elhízás kezelésében.
BindingEdit
egy agonista ligandum CB1 receptorhoz való kötődése konformációs változást idéz elő, és a jelátvitelért felelős receptor aktív állapotához vezet. Van azonban egy további mechanizmus, amely ligandum hiányában az aktív állapothoz vezethet. Mint számos más Gpcr, a CB1 receptor magas szintű konstitutív aktivitást mutat, így spontán módon aktív konformációs állapotot fogadhat el agonista kötés hiányában, megtartva az intracelluláris jelátvitel emelkedett bazális szintjét. Ez a receptor aktiválásának két állapotmodelljével magyarázható, amelyben a receptorok egyensúlyban vannak két állapot között, aktív és inaktív (R* és R). Egy agonista stabilizálja az aktivációhoz vezető aktív állapotot, egy semleges antagonista egyformán kötődik az aktív és inaktív állapotokhoz, míg egy inverz agonista előnyösen stabilizálja az inaktív állapotot (3.ábra).
a Rimonabantról sok esetben beszámoltak arról, hogy inverz agonistaként viselkedik, nem pedig semleges antagonistaként, és valószínű, hogy előnyösen kötődik a CB1 inaktív állapotához, ezáltal csökkentve a jelátviteli út aktiválódását. A legfontosabb kötési kölcsönhatás a Rimonabant karbonilcsoportja és a CB1 receptor Liz192 maradéka között kialakuló hidrogénkötés. Ez a kötés stabilizálja a 3 és 6 transzmembrán hélixek intracelluláris végének Lys192-Asp366 sóhídját (4.ábra). Ez a specifikus sóhíd a receptor inaktív állapotában van jelen, de aktív állapotban hiányzik.
a CB1 inaktív állapotában a Rimonabant kötődik a transzmembránon belül-3-4-5-6 aromás mikrodomain. A rimonabant kötődése az egyik oldalon a 2,4-diklórfenilgyűrű és a Trp279/Phe200/Trp356 szermaradékok, a másik oldalon a para-klór-fenilgyűrű és a Tyr275/Trp255/Phe278 szermaradékok közötti közvetlen aromás egymásra rakódó kölcsönhatásokat foglalja magában. A lipofil piperidinil rész jól illeszkedik a Val196/Phe170/Leu387 és Met384 aminosavmaradékok által alkotott üregbe (4.ábra).
PharmacophoreEdit
az eddig jelentett legtöbb CB1 antagonista a rimonabant közeli analógjai vagy izoszterei. Egy általános CB1 inverz agonista farmakofór modell kivonható ezen analógok, a diaril-pirazolok közös jellemzőiből (4.ábra). Ez a farmakofor tartalmaz egy ciklikus magot, a C-t (pl. pirazolt a rimonabantban), amelyet két aromás rész, a és B helyettesített.a hidrogénkötés-akceptor egység, D, összeköti a C-t egy ciklikus lipofil résszel, E. egyes esetekben az e egység közvetlenül kapcsolódik a C-hez. a 4. ábrán a rimonabant példaként szolgál. Az A egység egy 4-klór-fenilcsoportot, a B egység pedig egy 2,4-diklór-fenilgyűrűt jelent. A C egység a központi pirazolgyűrű, a D egység pedig a karbonilcsoportot képviseli, amely hidrogénkötés-akceptorként szolgál. Az e egység egy lipofil aminopiperidinil-részt képvisel.
szerkezet-aktivitás összefüggések
a CB1 receptorhoz való optimális kötődéshez para-szubsztituált fenilgyűrű szükséges a pirazol 5-pozíciójában. A pirazol 5-szubsztituensének szerepe van a receptorfelismerésben és az antagonizmusban. A fenilgyűrű para-szubsztituense lehet klór, bróm vagy jód, de kimutatták, hogy egy alkillánc is tolerálható. A központi pirazolgyűrű számozása a 2. ábrán látható.
az affinitás és az aktivitás szempontjából előnyös a 2,4-diklórral szubsztituált fenilgyűrű a pirazol 1-pozíciójában. Kimutatták, hogy ezen a fenilgyűrűn további halogének csökkentik az affinitást.
kedvező az is, ha a 3-karboxamid csoportban gyűrűpótlás van, például a rimonabantban az 1-piperidinilcsoportban. Az amino-piperidinil szubsztituens alkil-amidokkal, éterekkel, ketonokkal, alkoholokkal vagy alkánokkal történő helyettesítése többnyire csökkent affinitást eredményezett. A piperidinil pentillel vagy heptillánccal történő helyettesítése agonista tulajdonságokat adott a vegyületeknek. Ezen eredmények alapján arra a következtetésre jutottak, hogy a pirazol 3-pozíciója úgy tűnik,hogy részt vesz az agonizmusban,míg az 1 -, 4 -, 5-pozíciók az antagonizmusban.
kutatások kimutatták, hogy a karboxamid oxigén hiánya csökkent affinitást eredményez. Ezenkívül a karboxamid oxigén jelenléte hozzájárul az inverz agonista tulajdonságok megadásához, míg az oxigénhiányos analógokról kiderül, hogy semleges antagonisták. Ezek az eredmények alátámasztják azt a hipotézist, miszerint a karboxamid oxigén hidrogénkötést képez a CB11 receptor Liz192 maradékával.
Diarilpirazol származékok
az SR141716 (rimonabant) analógokat a közelmúltban több csoport írta le, ami a szerkezet-aktivitás kapcsolat (SAR) jó megértéséhez vezet ezen a kémiai csoporton belül. Míg a legtöbb leírt vegyület kevésbé hatásos, mint az SR141716, kettő közülük érdemes megemlíteni, az SR147778 és az AM251, bár mindkettő hatással lehet a mu opioid receptorokra is.
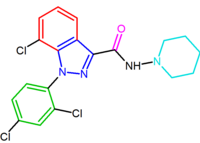
SR147778 (surinabant), egy második generációs antagonista, hosszabb hatástartamú, mint a rimonabant és fokozott orális aktivitás. Ez a fokozott hatástartam valószínűleg annak köszönhető, hogy a metabolikusan stabilabb etilcsoport jelen van a pirazolgyűrű 4-helyzetében. Egy másik változás az 5-fenil-klór szubsztituens brómmal történő helyettesítése.
a diarilpirazol-származékot, az AM251-et leírták, ahol a klór-szubsztituenst jóddal helyettesítették az 5-fenilgyűrű para helyzetében. Ez a származék hatásosabbnak és szelektívebbnek tűnt, mint a rimonabant.
21 olyan analógot szintetizáltunk, amelyek alkil-amiddal vagy alkil-hidraziddal rendelkeznek a 3.pozícióban. Megfigyelték, hogy az affinitás növekszik a megnövekedett szénlánc hosszával, akár öt szénatomig. Az amid-analógok is nagyobb affinitást mutattak, mint a hidrazid-analógok. Ezen analógok egyike sem rendelkezett szignifikánsan nagyobb affinitással, mint a rimonabant, de ennek ellenére valamivel szelektívebbek voltak, mint a Rimonabant a CB1 receptorra a CB2 receptor felett.
számos kísérlet történt a diarilpirazol-származékok affinitásának növelésére a rimonabant szerkezetének merevítésével. Az Általános farmakofór modell szempontjából az A, B és/vagy C egységeket további kötések kötik össze, amelyek merev molekulákhoz vezetnek. Például a kondenzált policiklusos pirazol NESS-0327 5000-szer nagyobb affinitást mutatott a CB1 receptor iránt, mint a rimonabant. Ez a vegyület azonban gyenge központi biohasznosulással rendelkezik.
egy másik vegyület, az O-1248 indazolszármazék a rimonabant analógjának tekinthető, ahol 5-arilcsoportja a pirazolrészhez kapcsolódik. Ez a szerkezeti módosítás azonban a CB1 receptor affinitásának 67-szeres csökkenését eredményezte.
a rimonabant ezen diarilpirazol-származékait az 1.táblázat foglalja össze.
 |
 |
| SR147778 | AM251 |
 |
 |
| NESS-0327 | O-1248 |
Other derivativesEdit
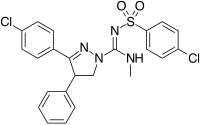
Structurally different from the 1,5-diarylpyrazoles are the chemical series of the 3,4-diarylpyrazolines. Ebben a sorozatban található az SLV – 319 (ibipinabant), egy erős CB1 antagonista, amely körülbelül 1000-szer szelektívebb a CB1-re a CB2-hez képest, és in vivo aktivitása hasonló a rimonabanthoz.
a rimonabant analógjainak kifejlesztésére alkalmazott másik megközelítés az volt, hogy a központi pirazolgyűrűt egy másik heterociklussal helyettesítették. Erre a megközelítésre példa a 4,5-diarilimidazol és az 1,5-diarilpirrol-3-karboxamidok.
nagyszámú diaril-pirazol és imidazol fuzionált biciklikus származékáról számoltak be. Ezekre példa egy purinszármazék, ahol a pirimidin gyűrű összeolvad egy imidazol gyűrűvel. Az Otenabant (CP-945,598) egy példa a Pfizer által kifejlesztett fuzionált kerékpáros származékra.
számos kutatócsoport tanulmányozta a hattagú gyűrűs pirazol bioizosztereket. Például egy 2,3-diarilpiridin-származék hatásos és szelektív CB1 inverz agonistának bizonyult. Ennek a vegyületnek a szerkezete bizonyítja annak lehetőségét, hogy a rimonabant amidrésze lipofil (benziloxi) és poláris (nitril) funkcióra bontható. További hattagú gyűrűs analógok például a pirimidinek és a pirazinok.
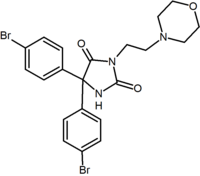
az öt-és hattagú gyűrűs analógokon kívül vannak más ciklikus származékok is, mint például az azetidinek. Ilyen például a metil-szulfonamid-azetidin-származék, amelynek 1,1-diarilcsoportja utánozza a diaril-pirazolok 1,5-diaril-részét. A szulfonilcsoport hidrogénkötés-akceptorként szolgál. Az 1,1-diarilcsoport olyan származékokban is jelen van, mint a benzodioxolok és a hidantoinok.
aciklikus analógokról is beszámoltak. Ezek az analógok 1,2-diaril motívumot tartalmaznak, amely megfelel a rimonabant 1,5-diaril szubsztituenseinek. Az aciklikus analógra példa a Taranabant (MK-0364), amelyet a Merck fejlesztett ki.
Ezen analógok képviselőit a 2.táblázat foglalja össze.
 |
 |
 |
|
| Type of derivative |
3,4-Diarylpyrazoline (Ibipinabant) | 4,5-Diarylimidazole | 1,5-Diarylpyrrole-3-carboxamides |
 |
 |
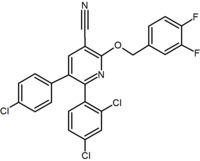 |
|
| Type of derivative |
Purine (pyrimidine ring fused to an imidazole ring) |
Purine derivative (Otenabant) | 2,3-Diarylpyridine |
 |
 |
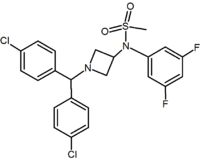 |
|
| Type of derivative |
Pyrimidine | Pyrazine | Methylsulfonamide azetidine |
 |
 |
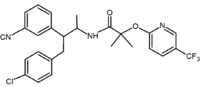 |
|
| a származék típusa | Benzodioxol | hidantoin | aciklikus származék (Taranabant) |
CB1 receptor antibodiesedit
a CB1 receptor elleni antitesteket fejlesztettek ki és vezettek be klinikai alkalmazásra Oroszországban. Ezek közé tartozik a brizantin (orosz: Ca) és a Dietressa (orosz: ca). A Brizantin a nikotin megvonásának és a dohányzásról való leszokás kezelésére, a dietressa pedig a fogyás kezelésére javallt. A Dietressa vény nélkül kapható Oroszországban.
