Bevezetés
a citotoxikus sejtek szerves részét képezik a vírusfertőzött és a rákos sejtek elleni küzdelemnek. Ezek a sejtek három különböző úton ölnek meg, litikus granulátumok felszabadulása, Fas receptor-ligandum út, vagy a nyomvonal–nyom receptor út. E cikk alkalmazásában a degranulációra fogunk összpontosítani. Amikor egy citotoxikus sejt találkozik egy célsejttel, szorosan tapad hozzá, kialakítva az immunszinapszist. A litikus szemcsék ezután polarizálódnak az immunológiai szinapszis felé, és felszabadulnak a citotoxikus sejtből a cél felé irányítva (1). Ezek a granulátumok különböző citotoxikus mediátorokat, például perforint és granzimeket tartalmaznak. A felszabadult perforin átmeneti pórusokat képezhet a célsejt membránján belül, lehetővé téve a granzimek bejutását a célsejtbe. A bejutást valószínűleg a perforin oligomerek is közvetítik, amelyek hiányos pórusokat (íveket) képeznek (2), és azt is felvetették, hogy a granzimek és a perforin az endoszomális útvonalon keresztül felvihetők a célsejtekbe (3, 4). A javasolt mechanizmusok mögött meghúzódó adatokat a közelmúltban részletesen megvitatták (5). Amikor a granzimek belépnek a célsejtekbe, a kaszpáz útvonal aktiválódik, ami apoptózist eredményez (6, 7). Ezen citotoxikus granulátumok membránja lizoszomális asszociált membrán glikoprotein-1-et (LAMP1) tartalmaz, más néven CD107a (8). A patkány CD107a luminális része átmenetileg ki van téve a sejtmembrán extracelluláris oldalának a degranuláció után, mielőtt újra internalizálódna. Ezért a CD107a festés azt jelzi, hogy degranulációs esemény történt (9). Míg a CD107a szerepe még meghatározásra kerül, a CD107a elleni siRNS-vizsgálatok kimutatták, hogy elengedhetetlen a perforin-kereskedelemhez a vezikulákon belül, mivel a perforin litikus granulátumokba történő szállítása cd107a hiányában gátolt (10). Kimutatták, hogy a CD107a szerepet játszik a citotoxikus sejtek halál elleni védelmében a perforinhoz való kötődés és a sejtmembránba való bejutás megakadályozása révén (11).
a citotoxikus limfocitáknak két fő típusa van, a természetes gyilkos sejtek (NK) és a CD8 T-sejtek. Mindkét sejttípus litikus granulátumok, a Fas receptor/Fas ligandum út és a TRAIL/TRAIL receptor út felszabadulásával öl meg, de a két sejtcsoport aktiválásához szükséges inger eltérő. A T-sejtek felismerik az MHC I. osztályú molekulák által bemutatott antigént aktiváló T-sejt receptorukon (TCR) keresztül, míg az NK-sejtek felismerik a célsejt antigéneket, bár különböző gátló és aktiváló receptorok. A gátló receptorok fontosak annak megakadályozásában, hogy az NK sejtek elpusztítsák az egészséges sejteket, miközben a receptorok aktiválása nk sejt citotoxicitást indukál.
mielőtt a CD107a-t az NK-sejtekben a degranuláció markereként azonosították (12), a citotoxikus képesség mérésére szolgáló kimenet a célsejtek pusztulása volt. A CD107a kimutatása áramlási citometriával lehetővé tette a kutatók számára, hogy azonosítsák a specifikus effektor sejteket citotoxikus képességgel. Felfedezése óta számos publikáció készült egér-és humán vizsgálatokból, amelyek megmutatják az anti-CD107a antitest alkalmazásának előnyeit. A patkány értékes immunológiai állatmodell olyan betegségek tanulmányozására, mint a leukémia és a graft vs. gazdabetegség (13), de a funkcionális leolvasásokat akadályozta a magas minőség hiánya specifikus patkányellenes CD107a antitestek áramlási citometriához. Ez a tanulmány leírja a patkány CD107a elleni antitest létrehozását és a degranulációs válasz jellemzését patkány NK és CD8+ T sejtekben.
anyagok és módszerek
állatok
Örmény beltenyésztett hörcsögök (Cytogen Research and Development Inc., MA, USA) az Oslói Egyetemi Kórház Rikshospitalet összehasonlító Orvostudományi Tanszékén helyezkedtek el, az intézményi irányelvekkel egyetértésben. A PVG-RT1U, PVG-RT7b, PVG-RT1N és PVG-R23 patkánytörzseket felcserélhető módon használták, és több mint 20 generáción keresztül tartották fenn, valamint a norvég Mezőgazdasági Minisztérium alá tartozó kísérleti állatok testülete és a kísérleti és egyéb tudományos célokra használt gerinces állatok védelméről szóló Európai Egyezmény által meghatározott iránymutatásoknak megfelelően helyezték el őket. A patkányokat 8-12 hetes korban használták. A laboratóriumi állatok létesítményeit rutinszerű egészségügyi ellenőrző programnak vetik alá, és fertőző organizmusokra tesztelik az Európai laboratóriumi Állattudományi Szövetség (Federation of European Laboratory Animal Science Association) ajánlásainak módosítása szerint. Az állatkísérleteket laboratóriumi előírások szabályozták,amelyeket az állatjóléti törvény, amelyben Norvégia követi az EU laboratóriumi irányát és az Európai laboratóriumi egyezményt.
Abs és reagensek
Nkp46 , NKR-P1A elleni antitestek 3.2.3-PB, vagy konjugálatlan (csak NKR-P1A-t köt, de nem NKR-P1B-t a PVG törzsben), CD8 (OX8-biotin), CD2 (OX34, konjugálatlan), TCR (R73-Alexa647), egér IgD B allotípus (TIB96-konjugálatlan, egér IgG izotípusként használt) és CD45.2 (His41-FITC, egér IgG izotípusként használt) konjugált szabványos protokollok szerint. A CD3 (IF4, nem konjugált) és izotípusú egér IgM (MM-30, nem konjugált) és örmény hörcsög IgG izotípus kontroll (HTK88-FITC) elleni antitesteket a Biolegend-től (San Diego, CA, USA) vásárolták. Kereskedelmi Anti-CD107a antitesteket vásároltak AbCam (Cambridge, Egyesült Királyság) (H4A3-FITC), eBioscience (San Diego, CA, USA) (ID48-PerCP-eFluor) és élettartam (Seattle, WA, USA) (LS-C8580-konjugálatlan). Az LS-C8580-at konjugáltuk Alexa488 NHS észterrel (Sigma-Aldrich, St. Louis, MO, USA) funkcionális vizsgálatokhoz. Anti-FLAG antitest (M2, nem konjugált) és anti-egér IgG (goat polyclonal-FITC) vásárolt Sigma-Aldrich (St. Louis, MO, USA). Az IL-2-t egy kínai hörcsög petefészek (CHO) sejtvonalának dializált sejttenyészetéből nyertük, amelyet patkány IL-2 expressziós konstrukcióval stabilan transzfektáltak. Peridin-klorofill-a protein (PerCP) konjugált sztreptavidin, FITC hörcsög IgG poliklonális izotípus-kontroll, FITC egér IgG1 izotípus-kontroll (MOPC-FITC) és GolgiStop a BD biosciences-től (Franklin Lakes, NJ, USA) vásárolták. Kecske anti-Örmény hörcsög (poliklonális-FITC) vásárolt Jackson Immunoresearch (West Grove, PA, USA). Az OX41, CD172a (SIRPa), R73 (Anti-rat Tcra), Ox19 (anti-CD5), OX12 (Anti-Igk lánc) és OX33 (anti-CD45RA) hibridomákból származó felülúszókat házon belül gyártották. A kontroll hörcsög szérumot nem immunizált Örmény hörcsögökből nyerték.
patkány CD107a klónozása
patkány CD107a-t PCR-rel amplifikáltuk PVG patkány splenocitákból előállított cDNS-ből, és szubklónoztuk egy puromicin rezisztencia gént tartalmazó PMX expressziós vektorba (Dr. Michael R. Daws nagylelkű ajándéka) (14). A CD107 primereket patkány CD107a (LAMP1) cDNS szekvencia alapján tervezték (GenBank: NM_012857). Előre primer: 5 ‘- GCCCCAGCACTGTTCGAGGT-3′; fordított alapozó: 5′-GTTGTTACCGTCCTGTACACACT-3’. Anionos tripszin-1 vezető peptidet (MSALLILALVGAAVA) használtunk az expressziós vektorban, és az eredeti CD107 transzmembrán régiót CD8 transzmembrán fragmenssel helyettesítettük a magas felületi expresszió megkönnyítése érdekében. A FLAG-tag (DYKDDDDK) a CD107 fehérje N-terminálisához ligáltuk, hogy a felületi expresszió kimutatható legyen. A végleges kiméra plazmid konstrukcióban minden beillesztett szekvenciát és nyitott leolvasási keretet megvizsgáltunk és Sanger DNS-szekvenálással megerősítettünk.
Transzfektáló BWZ.36 PMX-CD107a Plazmiddal rendelkező sejtet
293t sejteket vetettünk be egy 6-lyukú sejttenyésztő lemezbe 4 ml RPMI 1640 táptalajjal, transzfektáltunk 7,5 ~ ~ fugene6 reagenssel (Roche, a gyártó protokollja), és inkubáltuk 37 ~ ~ C hőmérsékleten 5% CO2-val. A FuGENE6 reagenst Opti-MEM-Mel (Gibco) előhígítottuk, és 1,5 6G PMX-CD107a plazmiddal és 1 ~ g pCL-ECO rágcsálóspecifikus retrovírus csomagoló plazmiddal (Addgene #12371) kevertük össze. Huszonnégy órával a transzfekció után a felülúszót leeresztették, és rpmi1640 táptalajra cserélték 2% FBS-sel, majd retrovírus-termelés céljából 32 KB C-re helyezték át. Negyvennyolc órával később a felülúszót betakarították, és 0,2-Ft-os filtropur s szűrővel (Sarstedt) szűrték, majd -80 ft-on mentették a retrovírus transzdukcióhoz.
A 105 BWZ.Kútonként 36 sejtet vetettünk be egy 24 kútból álló Sejttenyésztő lemezbe (Corning), és egy éjszakán át friss RPMI1640 táptalajon tenyésztettük 10% FBS-sel. A felülúszót eltávolítottuk, és az RPMI1640-et, amely 10% FBS-t, 16 ~ g polibrént (végső koncentrációig 8 ~ ~ g/ml), valamint 1,5 ml retrovírus felülúszót adtunk hozzá, és centrifugáltuk 32 ~ ~ C-on 2400 fordulat / perc sebességgel 2 órán át. A sejteket ezután 32 6CC-n 1 órán át inkubáltuk, majd a felülúszót eltávolítottuk, és friss RPMI1640 táptalajjal helyettesítettük 10% FBS-sel, majd 3 napig tenyésztettük, 37 oc-n 5% CO2-vel (a 2.napon 1 ng/ml puromicint tartalmazó teljes táptalajt használhattunk). A kibővített BWZ. CD107a-FLAG transzfektánsokat megvizsgáltuk a FLAG-tag felületi expressziója szempontjából, majd antitest immunizáláshoz vagy antitest szűréshez használtuk.
Transzfektánsokat expresszáló CD107a-t generáló
a kiméra patkány CD107a plazmidot cho sejtekbe transzfektáltuk. Röviden, A CHO sejteket teljes RPMI1640 táptalajban tenyésztettük (cRPMI; RPMI1640 táptalaj 10% FBS – szel, 1 mm Na Piruváttal, 50 kb 2-merkaptoetanol), amíg el nem érik a 30% – os összefolyást. A 2,5 ~ g plazmidot összekeverjük 7,5 ~ ~ l Fugene 6 reagenssel (Roche), majd cseppenként hozzáadjuk a sejtekhez. Két nappal később a CHO sejteket leválasztottuk RPMI1640 táptalajjal, 2 mm-es EDTA-val kiegészítve, és 96-kút lapos fenekű sejttenyésztő lemezekbe (25 sejt/kút) vetettük ki szelekciós táptalajjal (cRPMI kiegészítve 20 Kb/ml puromicinnel) stabil transzfektánsok klónozására. 10-12 napos tenyésztés után a felnőtt klónokat Anti-FLAG antitesttel (M2) szűrtük. A FLAG és a CD107a legmagasabb felületi szintjét expresszáló klónok egyikét használták az immunizáláshoz.
immunizálás és Sejtfúzió
a 3-10 hetes hím Örmény beltenyésztett hörcsögöket intraperitoneális injekciókkal (i.p.) immunizáltuk 2 db 106 cho.CD107a – FLAG sejttel hetente egyszer, 3 héten keresztül. A boost 4 606 db stabilan transzfektált BWZ. CD107a-FLAG sejtet kapott i. p.32 nappal az első immunizálás után, és a szérumokat mind a Cho.CD107a-FLAG, mind a BWZ felületi festésére elemeztük.CD107a-zászló transzfektánsok. A három állat közül kettő pozitív volt, és 3 nappal a fellendítés után a lépsejteket összegyűjtötték és összegyűjtötték a két állatból, amelyek közül az egyik splenomegáliában szenvedett. Körülbelül 2,0 db 108 lépsejtet és 1,4 db 108 dB NS0 myeloma sejtet DMEM-ben háromszor kimostunk adalékanyagokkal (1 mm-es nátrium-piruvát, 0,05 mM-es 2-merkapto-etanol és antibiotikum/antimikotikus), majd 90 g-on 10 percen át centrifugáltuk. Ettől a ponttól kezdve mindent 37cc-on tartva a pelletet a cső megérintésével feloldottuk, és előmelegített polietilén-glikolt 1500 (Roche) cseppenként adtunk hozzá, miközben óvatosan kevergettük 1 percig. Három milliliter dmem adalékanyagokkal fokozatosan hozzáadjuk a következő 3 perc befejező egy extra 7 ml előtt centrifugáljuk 500 g. a pelletet mossuk gondos öblítés (nem reszuszpendálás) DMEM adalékokkal és 20% FBS (DMEM-20), és tenyésztjük egy éjszakán át. A sejteket a következő napon gyűjtöttük be, és 100 ml DMEM-20–at adtunk hozzá 2 db hypoxanthine–aminopterin-timidinnel (SIGMA) és 10% hybridoma klónozó kiegészítéssel (HCS) (PAA). A sejtszuszpenziót 96 lyukú lemezekre helyeztük át. 12 nap elteltével a növekvő klónokból származó felülúszókat áramlási citometriával tesztelték a BWZ.CD107a-FLAG és CHO.CD107a-FLAG felszíni antigének festésére, de a BWZ-n nem.36 sejtet transzfektáltak irreleváns zászlóval jelölt antigénekkel negatív kontrollként. A specifikus antitesteket termelő 9-ből 12 pozitív klónt tovább szubklónoztuk DMEM-20-mal, hipoxantin-timidinnel és HCS-vel kiegészítve. Csak egy klón (SIM1) termelt antitesteket a szubklónozás után, és ezt még egyszer szubklónozták. CD107a specifikus hörcsög IgG antitesteket detektáltunk FITC anti-Örmény hörcsög IgG (Jackson Immunoresearch). A SIM1 hibridómából származó Anti-CD107a-t hitrap Protein G HP-vel (GE Healthcare, Life Sciences) tisztítottuk és fitc-konjugáltuk a standard eljárások szerint, vagy Alexa488-konjugáltuk a gyártó protokollja szerint.
effektor sejtek generálása
egysejtű szuszpenziókat készítettünk a lépből. A limfocitákat egy Lymphoprep gradienssel izoláltuk, majd egy nejlongyapot oszlopon futtattuk, hogy eltávolítsuk a B-sejteket és a makrofágokat. Az IL-2-aktivált NK sejtek (LAK) előállításához a fennmaradó sejteket egy éjszakán át tenyésztettük IL-2-ben. A következő napon a nem tapadó sejteket PBS-sel történő mosással távolítottuk el, és a tapadó NK sejteket RPMI-ben tartottuk, IL-2-vel, 10% hővel inaktivált FBS-sel, 1% sztreptomicinnel/penicillinnel, 1 mm-es nátrium-piruváttal és 50 km-es 2-merkaptoetanollal kiegészítve. A sejteket 8-10 napig tenyésztettük. Dúsított NK sejtek vagy rendezett T és NK sejtek előállításához a sejteket negatív szelekcióval dúsítottuk a nejlongyapot lépés után. Az NK sejtek dúsításához a pán-egér IgG Dynabeadeket (Invitrogen Dynal) makrofágok (OX41), T-sejtek (R73 és OX19) és B-sejtek (OX12 és OX33) elleni antitestekkel vonták be. A T-sejtek dúsításához a pán-egér IgG Dynabeadeket makrofágok (OX41) és B-sejtek (OX12 és OX33) elleni antitestekkel festették. A sejteket a negatív szelekció két lépésével dúsítottuk festett gyöngyökkel 30 percig 4 C. A dúsított NK sejtek tisztasága körülbelül 50-60% volt, és degranulációs vizsgálatokhoz használták őket. A dúsított T-sejteket (79-85% tisztaságú) tovább válogattuk a TCR+ sejtek számára egy FACS Aria (BD Biosciences) segítségével.
Degranulációs vizsgálatok
a degranulációs válasz patkányellenes CD107a-val (SIM1) történő festéssel történő mérésére a célsejt stimuláció során az NK effektorokat és a YAC célsejteket inkubáltuk 1: 1 arányban 3 605 sejt/kút (hacsak másként nem jelezzük) a SIM1 mAb-ot, a kereskedelemben kapható egyéb anti-CD107a antitesteket vagy izotípus-kontrollt tartalmazó táptalajban. Az NK sejtekből származó antitest stimulációra adott degranulációs válasz mérésére lapos fenekű 96 lyukú lemezeket használtunk, amelyek különböző koncentrációjú Anti-nkp46 (Wen23), anti-NKR-P1A (3.2.3) és egér IgG1 izotípus-kontroll (TIB96). A következő napon a lemezeket PBS-sel mostuk, majd crpmi-vel blokkoltuk, mielőtt kútonként 3 db, SIM1-et tartalmazó crpmi-ben szuszpendált, 105 dúsított NK-sejtet adtunk hozzá. A T-sejtekből történő degranuláció méréséhez ezeket válogatták és tenyésztették CRPMI-ben IL-2-vel 2-3 napig. A 96 lyukú lapos fenéklemezeket egy éjszakán át CD3 (IF4), CD2 (OX34) vagy IgM izotípus-kontroll (MM-30) elleni antitestekkel vontuk be. A SIM1-et tartalmazó cRPMI-ben kb. 3 db 105 T-sejtet adtunk hozzá. Az összes vizsgálatot 4 órán át inkubáltuk. az utolsó 3 órán át Golgistop-ot adtunk az inkubációhoz, hogy megakadályozzuk az internalizált CD107a lebomlását.a sejteket ezután a megfelelő felszíni receptorok felé antitestekkel mostuk és festettük, majd a FACS Canto vagy az LSR II (BD Biosciences) segítségével elemeztük.
króm Release Assay
YAC-1 célsejtek (5 db 106 sejt/ml cRPMI) Hozzáadott 3.7 MBq51Cr-t inkubáltunk 37 6CC hőmérsékleten 1 órán át, 15 percenként keverve. A sejteket ezután háromszor mossuk PBS-sel 2% FBS-sel, majd reszuszpendáljuk cRPMI-ben 1 605 sejt/ml-re. A lak effektorsejteket és a célsejteket a megadott arányokban 200 MHz-es végső térfogatban vontuk be. A sejteket centrifugáltuk és 4 órán át inkubáltuk 37cc-nél. az 51cr specifikus felszabadulását a Cobra auto-gamma (Packard) segítségével mértük.
eredmények
a CD107a elleni antitest létrehozásához készítettünk egy expressziós vektort, amely tartalmazza a patkány CD107a extracelluláris membrán régióját, a patkány CD8 transzmembrán régióját, valamint egy 3′-terminális jelzőtáblát a felszíni expresszió kimutatására (1a ábra). A vektor transzfektálódott CHO sejtekbe és a BWZ-be.36 T-sejtvonal és cd107a expresszió szűrésére Anti-FLAG antitest (M2) alkalmazásával (1b.ábra). CD107a stabilan transzfektált CHO sejteket injektáltunk Örmény beltenyésztett hörcsögök hetente egyszer 3 hétig a CD107a stabilan transzfektált BWZ sejtek végső fellendülésével 3 nappal az NS0 myeloma sejtvonallal való fúzió előtt. A különböző klónok felülúszóit a BWZ.CD107a-FLAG felé mutató specificitás szempontjából teszteltük, de nem irreleváns zászlóval címkézett BWZ.36 transzfektáns. Az egyik klón, a SIM1, specifikusan kötődik a cd107a expresszáló transzfektánshoz, de nem a FLAG transzfektált kontrollhoz (1C ábra).

1. ábra. Patkányellenes CD107a monoklonális antitest (SIM1) előállítása. (A) A PMX expressziós vektor vázlatos vektortérképe leader peptiddel, FLAG-tag-el, CD107a betéttel és a CD8 transzmembrán doménjével. B) stabil transzfektált kínai hörcsög petefészek és BWZ.36 sejtet teszteltünk a FLAG-tagged CD107a sejtfelszíni expressziójára Anti-FLAG antitest (M2) (árnyékolt hisztogramok) alkalmazásával. A negatív kontroll önmagában másodlagos antitest (átlátszó hisztogram). (C) A CD107a-FLAG vagy irreleváns antigénnel (NKR-P1F-FLAG) transzfektált BWZ sejteket hörcsög kontroll szérummal, SIM1 felülúszóval vagy Anti-FLAG antitesttel (M2) festettük.
a SIM1 klónt funkcionális vizsgálatokkal párhuzamosan két kereskedelmi forgalomban kapható CD107a antitesttel is teszteltük, amelyek áramlási citometriában potenciálisan keresztreakcióba léphetnek patkány CD107a-val. A vizsgált antitest klónok az AbCam H4A3 voltak (amely az áramlási citometriában a humán, patkány, egér és főemlősökkel reagál) és az LS-C8580 antitest klón az élettartam BioSciences-től (amely a gyártó honlapja szerint az egér, az ember és a patkányok CD107a-jával reagál az immunhisztokémiában és a Western blotokban). A SIM1 antitest klón degranuláló sejteket azonosított célsejtek jelenlétében, és kevés háttérfestést mutatott célpontok hiányában (felső panel 2a ábra). A h4a3 klón az NK sejtek legnagyobb százalékát festette a célsejt stimuláció után (középső panel). A célsejtek hiányában azonban magas szintű háttérfestés is volt, ami nem specifikus kötődést jelez. Az LS-C8580 MAB klón (Alsó panel) nagyon alacsony degranulációs szintet mért, ha volt ilyen. Ezen antitestek specifitását a BWZ.CD107a-FLAG transzfektáns pozitív festése igazolta, de a BWZ nem.NKR-P1F-ZÁSZLÓVEZÉRLÉS (2b.ábra). A h4a3 antitest klón, amelyről kimutatták, hogy kötődik az emberi CD107a-hoz (16), nem festette meg a patkány CD107a transzfektált BWZ sejteket, jelezve, hogy nincs keresztreakció patkány CD107a-val. az anti-egér CD107a ID48 klón szintén nem festette meg a patkány CD107a transzfektánst. A nem konjugált LS-C8580 viszont a CD107a transzfektált sejtek specifikus festését mutatta (az adatok nem jelennek meg). Az LS-C8580 klón azonban csak konjugálatlan antitestként áll rendelkezésre, amely nem alkalmas degranulációs vizsgálatokra. Az LS-C8580 és az Alexa488 konjugálására irányuló ismételt kísérletek laboratóriumunkban sajnos nem hoztak létre erős festési konjugátumokat, bár az LS-C8580 minta kis mérete és koncentrációja lehet a gyenge konjugáció oka. A konjugált LS-C8580 a CD107a transzfektált sejtek redukált, de specifikus festését mutatja (2b ábra), de amint azt a 2a ábra mutatja, ezzel a konjugátummal végzett funkcionális vizsgálatok során nem tudtuk kimutatni a degranuláló sejteket. Összefoglalva, a SIM1 mAb specifikusan megfesti a degranuláló patkány NK sejteket a célsejtekkel történő stimuláció után.

2. ábra. A SIM1 a natural killer (NK) és a CD8 T sejtek degranulációját méri. (A) A Degranuláló sejtek százalékos arányát anti-CD107a antitestekkel mértük SIM1, H4A3 és LS-C8580, YAC-1 célsejtekkel vagy anélkül, mint inger. Egy négy reprezentatív kísérletet mutatunk be (B). A BWZ.CD107a-FLAG sejtvonal festése SIM1, H4A3, LS-C8580 vagy ID48 antitest klónokkal. BWZ.36 sejt transzfektált irreleváns zászlóval jelölt antigénnel (BWZ.NKR-P1G-FLAG) negatív kontrollként szerepeltek, (C) a dúsított NK sejteket lemezhez kötött Anti-NKp46, anti-NKR-P1A vagy egér IgG1 stimulálták izotípus kontrollként, a SIM1-et pedig a degranuláló sejtek százalékos arányának mérésére használták. Az NKp46 +(Wen23) vagy az NKR-P1Abright (3.2.3) sejteket kapuztuk. D) a TCR + sejteket válogattuk (tisztaság 99%), és Il-2-ben tenyésztettük 2-3 napig. A sejteket ezután lemezhez kötött anti-CD3 és anti-CD2 vagy egér IgM izotípus-kontrollal stimuláltuk az anti-CD3-ra. Az alsó panel anti-CD3 és anti-CD2 stimulációt, valamint SIM1 izotípus-kontroll (FITC hamster IgG poliklonális) festést mutat. A T-sejteket R73-Alexa647 és 3.2.3-PB antitestekkel válogattuk, az R73+/3.2.3− sejteken kapuzva. A bemutatott adatok három különálló, független kísérlet reprezentatív kísérletéből származnak.
az aktiváló nk receptorok közvetlen stimulálása a lemezhez kötött antitesteken keresztül egy másik hatékony módszer a degranuláció kiváltására. A SIM1 klón teszteléséhez ebben a funkcionális vizsgálatban dúsított NK sejteket inkubáltunk az nkp46 és NKR-P1A aktiváló receptorok elleni antitestekkel bevont lemezeken (2C ábra). Negatív kontrollként a lemezeket egér IgG1 izotípus-kontrollal vontuk be. A SIM1 antitesttel végzett festés 25,5 vagy 44%-os degranuláló sejtet azonosított az NK-sejt stimuláció után az 5 KB/ml Anti-NKp46 vagy anti-NKR-P1A bevonattal ellátott lemezeken. A degranuláló sejtek százalékos aránya még tovább nőtt, amikor a lemezeket magasabb koncentrációjú stimuláló antitestekkel (10 6G/ml) vonták be. Az egér IgG1 izotípus-kontrolljával bevont kutakban nem indukáltak degranulációt.
egyértelműen láttuk a degranulációt az NK sejtekben, amelyeket akár célsejtekkel, akár aktivációs receptorok elleni antitestekkel stimuláltak a SIM1 antitestünk felhasználásával. Ezt citotoxikus T-sejtekben is meg akartuk erősíteni. A T-sejteket lépsejtekből válogattuk és IL-2-ben tenyésztettük 2-3 napig. A T-sejteket ezután lemezhez kötött anti-CD3-mal és anti-CD2-vel stimuláltuk (2D ábra). A degranulációt a tenyésztett CD8+ T-sejtekből mérték, amikor anti-CD3 és anti-CD2-vel stimulálták a 2.és 3. napon. Nem mértünk degranulációt nem citotoxikus CD4 T-sejtekből, vagy izotípus-kontroll antitesttel történő stimuláció után, tovább bizonyítva a SIM1 antitestünk specifitását.
a Lymphokine-activated killer (Lak) sejteket az NK sejtek IL-2-ben történő tenyésztésével hozzák létre 7-10 napig, és általában nagyon erős effektor sejtekként használják a króm felszabadulási vizsgálatokban a citotoxicitás tanulmányozására, ezért képesnek kell lenniük magas szintű degranulációra. A degranuláció mérése LAK sejtekből, kezdetben a 1:1 effektor aránya a célokhoz, de váratlanul alacsony degranulációs szintet talált (az adatok nem jelennek meg). Azonban titrálás az optimális effektor-cél Arány megtalálása érdekében láttuk, hogy a degranuláció növekvő szintje érhető el, ha az effektor-cél arány 1 alatt volt (3a ábra). A degranulációs vizsgálatok optimális aránya tehát ellentétben áll a citotoxicitási vizsgálatokkal, ahol a citotoxicitás szintje magasabb effektor: cél arány mellett növekszik (3b ábra).
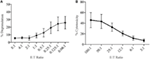
3. ábra. Alacsony effektor:a célarányok fontosak a megfelelő érzékenység biztosításához patkány NK sejtekkel végzett degranulációs vizsgálatokban. (A) 8-10 napig tenyésztett LAK sejtek degranulációja IL-2-ben YAC-1 célokkal szemben különböző effektor:cél arányokkal. B) az IL-2 tenyésztett LAK YAC-1 célsejtekkel szembeni Citotoxicitását a 8-10. Minden gráf három vagy több különálló kísérlet kumulatívja, az SD-t mutató sávokkal.
megbeszélés
a SIM1 és a különböző kereskedelmi CD107a antitestek kezdeti tesztelése során a patkányokban végzett degranulációs vizsgálatokban az effektor kis tartományát választottuk a célarányokhoz, a jelenlegi szakirodalom alapján (12, 16, 17). Az effektor-célsejt Arány papíronként változhat, de a korábbi vizsgálatok, amelyek titrálták az effektor-cél arányt, kimutatták, hogy az egér nk-sejtjeinek optimális degranulációja 4,5:1 arányban tetőzött a YAC-1 célsejtekkel (18) és az emberi nk-sejtekkel a K562 sejteket 5:1 vagy 10 arányban ölték meg a legjobban:1 (12). Ha azonban az effektor nagyobb tartományát alkalmazzuk a célarányokhoz, megmutatjuk, hogy a patkány LAK sejteket használó degranulációt hatékonyabban indukáltuk, ha effektorsejtenként négy vagy több célt alkalmaztunk. A patkány és más fajok közötti optimális effektor-cél Arány különbsége az alkalmazott célsejtek típusának tudható be, mivel a fent említett vizsgálatokban az emberi és az egér effektor-cél Arány titrálása ugyanazon fajból származó célsejteket használt. Az effektor sejtek érzékenyebbek lehetnek ugyanazon faj célsejtjeire, ezért kevesebb célsejtre van szükségük az aktiváláshoz. A vizsgálatunkban használt YAC-1 sejtvonal egy egér T-sejtes limfóma, amely évek óta standard a patkány NK sejtek citotoxicitásának stimulálására. Nem zárhatjuk ki, hogy patkány célsejt használata az NK sejtek erősebb stimulációját eredményezné, majd kevesebb célsejtre lehet szükség a degranuláció indukálásához.
ebből a vizsgálatból az is egyértelmű, hogy a citotoxicitási vizsgálatokhoz használt effektor-cél arányok nem korrelálnak jól az effektor sejtekben az optimális degranulációs válasz méréséhez szükséges arányokkal. Ez nem meglepő, mivel a két vizsgálat kiolvasása eltérő, a citotoxicitás a célsejt halálát méri, a degranuláció pedig a célpontokra adott NK választ méri.
összefoglalva, egy antitestet állítottunk fel patkány CD107a (SIM1) ellen, és jellemeztük annak képességét, hogy kimutatja a degranulációt a patkány citotoxikus limfocitáiban. Megmutattuk, hogy a SIM1 specifikus a degranuláló sejtekre, és a degranulációs protokoll optimalizálásával megállapítottuk, hogy az 1:4-nél alacsonyabb effektor:célsejt arányok biztosítják a lak sejtek optimális stimulálását. A Patkányellenes CD107a (SIM1) kifejlesztése lehetővé teszi a patkány limfociták citotoxikus válaszainak jobb elemzését és jellemzését, és értékes eszköz lesz a patkány számos betegségmodelljében.
etikai nyilatkozat
a tanulmányt a norvég nemzeti Állatkutató Hatóság (FDU) hagyta jóvá (engedély száma: ID-1698).
szerzői hozzájárulások
Az as felelős a kifejezés elemzéséért, a funkcionális vizsgálatokért és a kézirat megírásáért. A K-ZD elvégezte a cDNS klónozást és a transzfektánsok generálását. A JTV részt vett a projekt tervezésében és felügyeletében, valamint a kézirat megírásában. Az LK felelős az oltásokért, a hybridoma technológiáért, a kézirat megírásáért és a projekt felügyeletéért.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
a szerzők köszönetet mondanak Ulla Heggelundnak és Stine Martinsen-nek a laboratóriumi technikai segítségért, valamint az Oslói Egyetemi Kórház Rikshospitalet összehasonlító Orvostudományi Tanszékének állatorvosi létesítményének munkatársainak az immunizáláshoz nyújtott segítségért. Köszönet Marit Inngjerdingennek a tudományos megbeszélésekért.
finanszírozás
a kutatást az Oslói Egyetem, a Délkelet-norvégiai regionális Egészségügy (2009104) és a Legatet til Henrik Homans Minde finanszírozta.
1. Narancs JS. A litikus nk-sejt immunológiai szinapszis kialakulása és működése. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038 / nri2381
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
2. Metkar SS, Marchioretto M, Antonini V, Lunelli L, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. Az endoszomális membrán Perforin pórusai kiváltják az endocytosed granzyme B felszabadulását a célsejtek citoszoljába. Nat Immunol (2011) 12(8):770-7. doi:10.1038 / ni.2050
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforin és granzymes: funkció, diszfunkció és emberi patológia. Nat Rev Immunol (2015) 15(6):388-400. doi:10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens A, Benestad HB, Vaage JT, et al. Egy második profilaktikus MHC-nem megfelelő csontvelő-transzplantáció véd a patkányoktól akut mieloid leukémia (BNML) halálos graft-versus-host betegség nélkül. Transzplantáció (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
PubMed absztrakt | CrossRef teljes szöveg | Google Scholar
14. Onishi M, Kinoshita S, Morikawa Y, Shibuya A, Phillips J, Lanier LL, et al. Retrovírus által közvetített expressziós klónozás alkalmazásai. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Az NK sejtek csökkent degranulációja gyakran visszatérő herpeszben szenvedő betegeknél. Clin Vakcina Immunol (2011) 18(9):1410-5. doi:10.1128 / CVI.05084-11
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
17. Bryceson YT, Fauriat C, Nunes JM, Wood SM, BJ stb. Humán NK sejtek funkcionális elemzése áramlási citometriával. Módszerek Mol Biol (2010) 612:335-52. doi:10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
