fontos része annak, hogy megértsük, hogyan működnek ezek a rendszerek a sejtosztódás szabályozásában, az a felfedezés volt, hogy a p53 hatással van mind a rákra, mind az öregedésre. Tyner et al. (2002) agenetikai stratégiát dolgozott ki egerekben a p53 hiányának vagy a normál p53 fehérjénél kisebb hatásának összehasonlítására. A két mutáns transzgenikus egérvonalban vagy a p53 gén teljes deléciója volt (p53 -), vagy a p53 csonka formája (p53m, mutáns), amely nem rendelkezett a p53 gén első hat exonjával (2.ábra).
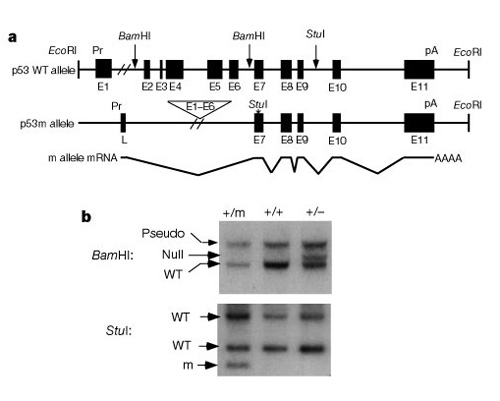
a vizsgálat első felében három egércsoportot hasonlítottak össze:1.csoport, p53+ / p53-(a p53 egy példányának törlése); 2. csoport, p53+ / p53m(részleges deléciós mutáns); és 3. csoport, p53+ / p53+(vad típus, normál). Az 1. táblázat bemutatja ezt a három csoportot és kísérleti eredményeiket, amelyek a rák és az öregedés fenotípusaihoz kapcsolódnak. Érdekes módon a 2. csoportban a csonka p53 fehérjével rendelkező egerek egyikében sem alakultak ki életveszélyes daganatok, míg a 3.csoport 45%-ánál (vad típus) és az 1. csoport több mint 80% – ánál alakult ki életveszélyes daganatok. A 2. csoportba tartozó egerek átlagos élettartama az 1.csoportba tartozó nagyon rövid és a 3. csoportba tartozó vad típusú egerek hosszabb élettartama között volt. Ezekből az adatokból az a következtetés vonható le, hogy a részleges p53 mutáció csökkentette a rák előfordulási gyakoriságát, ugyanakkor úgy tűnt, hogy az élettartam hiányát okozza, nem pedig a meghosszabbított élettartamot.
| 1.táblázat. Experimental results from genetic mousestudies with p53 mutants | |||
| Genotype | Cancer phenotype | Agingphenotype | |
| Group 1 | p53+/p53- (complete deletion) | 80%had tumors | Muchshorter life span |
| Group 2 | p53+/p53m (partial mutant) | None | Shorterlife span |
| Group 3 | p53+/p53+ (wild type) | 45%had tumors | Normallife span |
| A Tyner etal-tól adaptálva. 2002 | |||
a szerzők azt is megjegyezték, hogy a 2.csoportba tartozó egerekben a régi egerekre jellemző fenotípusok alakultak ki, mint például a lassú szőrnövekedés és a csontvázváltozások miatt púpos tüskék, korábban, mint a vad típusú egerek (3. ábra).

a vizsgálat második felében Tyner és munkatársai azt kérdezték, hogy a p53 mutáns másképp működik-e normál p53 jelenlétében. Egy további transzgenikus egérvonalat tenyésztettek p53 – / p53m mutantallélekkel, és azt találták, hogy ezek az egerek nem rendelkeznek erős tumorvédelemmel, és sokkal kisebb élettartam-hatást mutatnak. Tehát a p53 mutánsnak valahogy működnie kellett aa normál p53-mal való hatás elérése érdekében. Általános megfigyelésként aa kutatók arról számoltak be, hogy a p53+/p53m heterozigóta sejtjei körülbelül háromszor olyan keménynek bizonyultak, mint a vad típusú sejtek. Így, bár ezek a sejtek rezisztensek voltak rák, ez a p53+/ p53mbackground szintén korábbi öregedést okozott. Valóban, a p53 aktivitása ezekben a heterozigótákban lényegesen magasabbnak tűnt, mint a vadonban type.It úgy tűnt, hogy egy ilyen változás, bár apriori, jó lenne mind a rák, mind az öregedés ellen, de ez nem így volt.
később, Mooreet al. kimutatták, hogy az azonos mutációval rendelkező tenyésztett sejtekben, amelyek csonka p53 fehérjét okoznak, ez a csonka fehérje belépett a magba, és kolokalizálódott a normál p53-mal. Tanulmányozták a p53 fehérje felezési idejét a sejteken belül, és megállapították, hogy a p53 mutáns egy példányával rendelkező heterozigóták a normál p53 fehérje stabilitásának háromszorosát növelték, összehasonlítva a vad típusú stabilitással, ami azt jelenti, hogy a fehérje stabilitása javult a normálishoz képest. Ezek a tenyésztett sejtek eredményei kiterjesztették és megerősítették a Tyner et al. egerekben. Ezenkívül ez volt az első sejtosztódási válaszút, amelyet a p53-on keresztül fedeztek fel, és egyértelműen modulálja mind a rákos megbetegedést, mind az öregedést.
Az Rb útvonalon, amely jelezheti a sejtosztódási ciklusból való kilépést, olyan események, mint a DNS károsodása vagy a kromoszóma végein lévő rövid telomerekhez vezető elégtelen replikáció, csökkent CDK jelátvitelt okoz. Ez növeli az Rb protein kináz aktivitását, következésképpen növeli az E2F transzkripciós faktor aktivitását. mi az E2F jelentősége? Ez a transzkripciós faktor kötődik az RNS polimeráz alegységek promoterjeihez és az S fázis megkezdéséhez szükséges egyéb fehérjékhez, és elősegíti a sejtosztódás megkezdését (Campisi 2003; Weinberg 1995). Így úgy tűnik, hogy mind a p53, mind az Rb útvonalak ugyanazon sejtciklus-szabályozó mechanizmusokra hatnak.
