Elektronegativitás és kötés polaritás
bár a kovalens kötést elektronmegosztásként határoztuk meg, a kovalens kötésben lévő elektronokat nem mindig osztja meg egyenlően a két kötött Atom. Hacsak a kötés nem köti össze ugyanazon elem két atomját, mindig lesz egy atom, amely erősebben vonzza a kötésben lévő elektronokat, mint a másik atom, amint azt a 4.3. Amikor ilyen egyensúlyhiány lép fel, a kötvény egyik oldalán valamilyen negatív töltés (részleges negatív töltésnek nevezik, és kijelölték őket), a kötés másik oldalán pedig néhány pozitív töltés (kijelölték őket) halmozódik fel. Olyan kovalens kötést, amelynek egyenlőtlen az elektronmegosztása, mint a 4.3.ábra (B) részében “poláris versus nem poláros kovalens kötések”, poláris kovalens kötésnek nevezzük Bonda kovalens kötés kiegyensúlyozatlan elektroneloszlással a kötésen.. Kovalens kötés, amely egyenlő arányban osztja meg az elektronokat (4. ábra (a) része.3 “poláris versus nem poláros kovalens kötések”) nem poláros kovalens Bonda kovalens kötésnek nevezzük, amelynek kiegyensúlyozott elektroneloszlása van a kötésen..
4.3.ábra poláris kontra nem poláros kovalens kötések
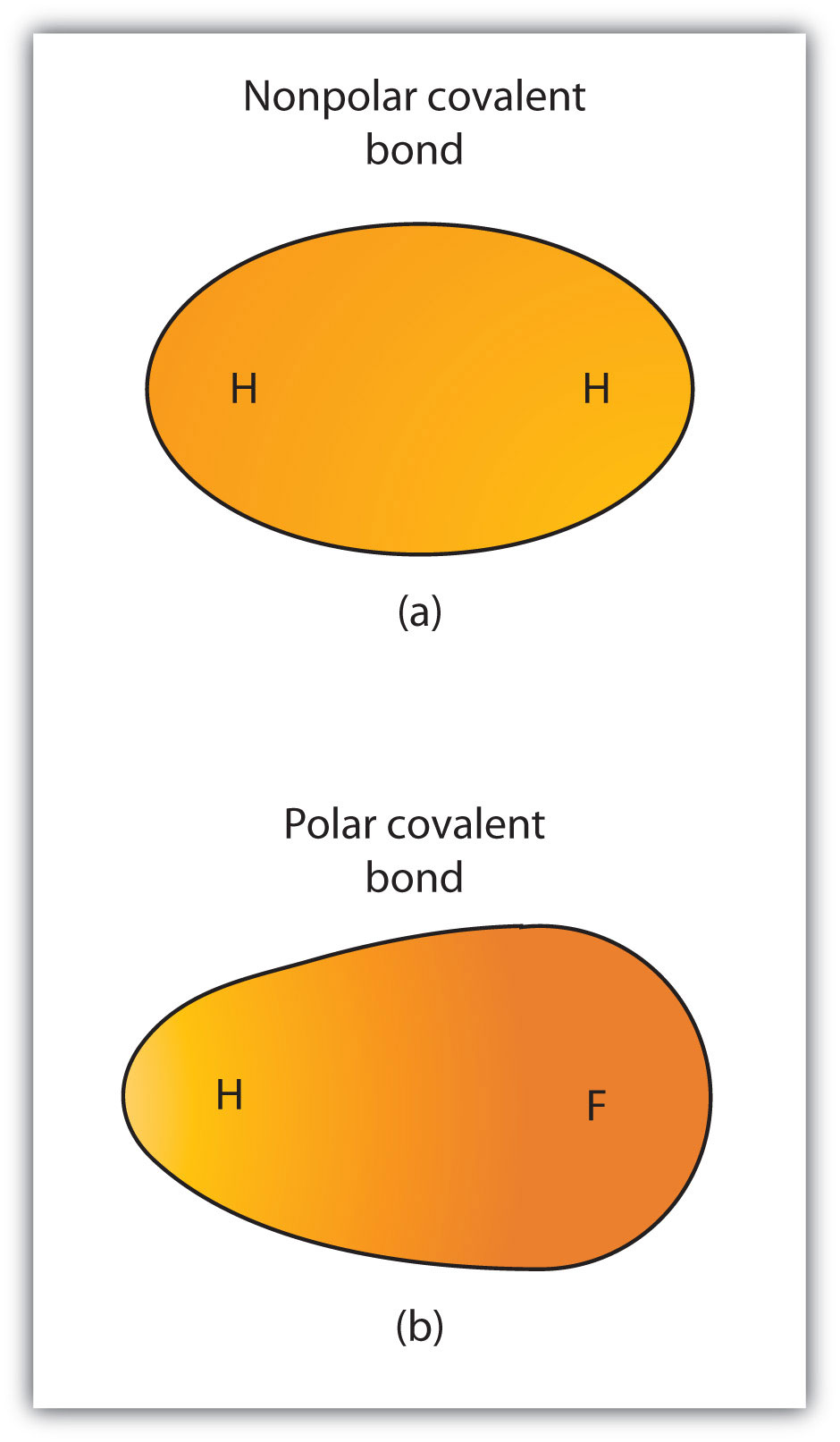
(a) a kovalens kötésben lévő elektronokat mindkét hidrogénatom egyenlően osztja meg. Ez egy nem poláros kovalens kötés. (b) a fluor atom jobban vonzza a kötésben lévő elektronokat, mint a hidrogénatom, ami az elektron eloszlásának egyensúlyhiányához vezet. Ez egy poláris kovalens kötés.
a különböző elemek atomjai közötti kovalens kötés poláris kötés, de a polaritás mértéke nagyban változik. Egyes kötések a különböző elemek között csak minimálisan polárisak, míg mások erősen polárisak. Az ionos kötések polaritásban a végsőnek tekinthetők, az elektronok inkább átvitelre kerülnek, mint megosztásra. A kovalens kötés relatív polaritásának megítéléséhez a vegyészek elektronegativitást alkalmaznakegy relatív mértéke annak, hogy egy atom milyen erősen vonzza az elektronokat, amikor kovalens kötést képez., amely relatív mértéke annak, hogy egy atom milyen erősen vonzza az elektronokat, amikor kovalens kötést képez. Az elektronegativitás értékeléséhez különféle numerikus skálák léteznek. A 4.4. ábra “a különböző elemek elektronegativitása”az egyik legnépszerűbb—a Pauling-skála. A kovalens kötés polaritását úgy lehet megítélni, hogy meghatározzuk a kötést alkotó két atom elektronegativitásának különbségét. Minél nagyobb az elektronegativitás különbsége, annál nagyobb az elektronmegosztás egyensúlyhiánya a kötésben. Bár nincsenek szigorú szabályok, az általános szabály az, hogy ha az elektronegativitások különbsége kevesebb, mint körülbelül 0,4, akkor a kötést nem polárisnak tekintjük; ha a különbség nagyobb, mint 0,4, akkor a kötést polárisnak tekintjük. Ha az elektronegativitás különbsége elég nagy (általában nagyobb, mint körülbelül 1,8), akkor a kapott vegyületet inkább ionnak, mint kovalensnek tekintjük. A nulla elektronegativitási különbség természetesen nem poláros kovalens kötést jelez.
4.ábra.4 különböző elemek elektronegativitása
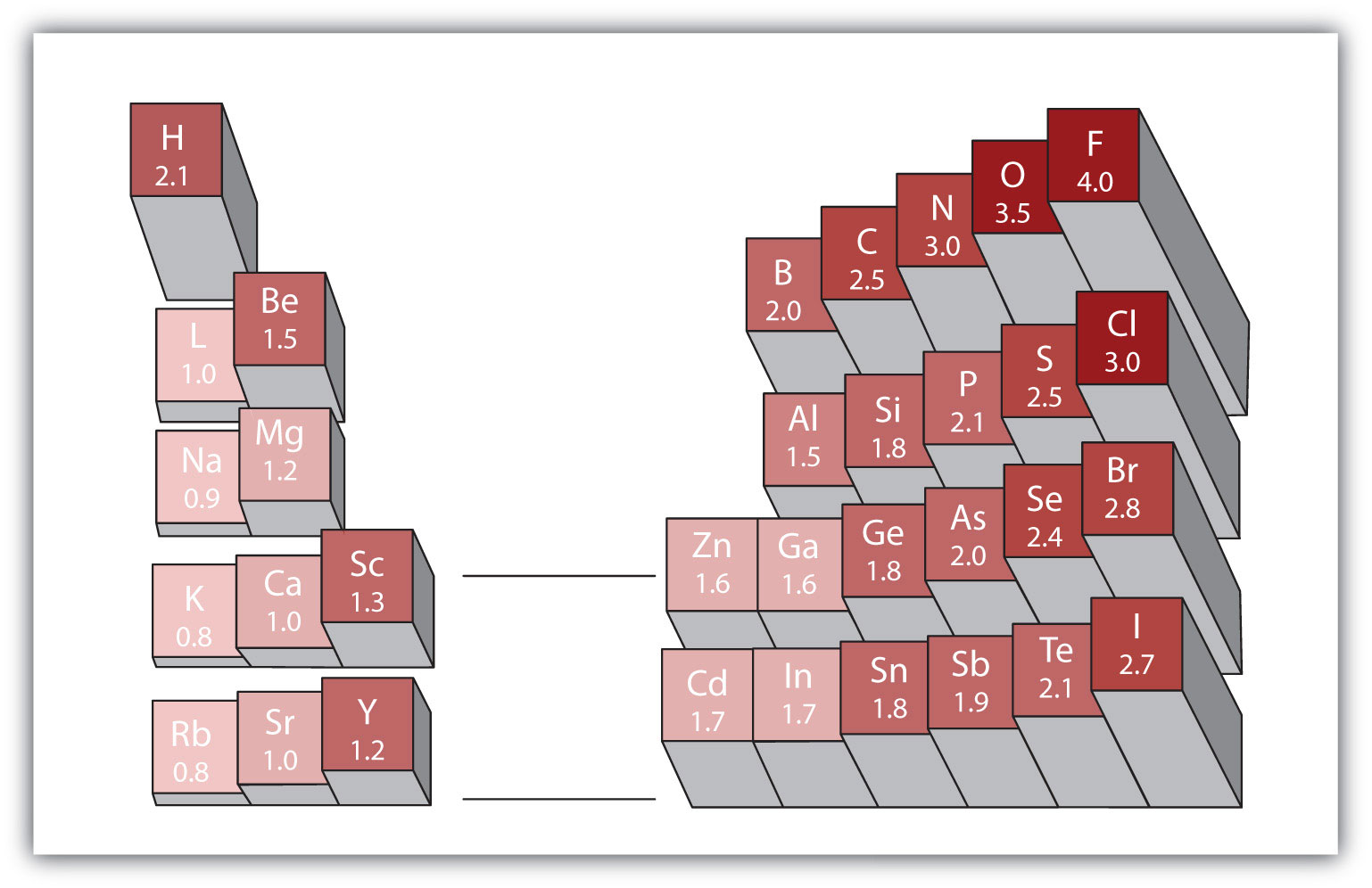
az elektronegativitások népszerű skálája a fluor atomok értéke 4,0, a legmagasabb érték.
közelebbről: Linus Pauling
vitathatatlanul a 20.század legbefolyásosabb vegyésze, Linus Pauling (1901-94) az egyetlen személy, aki két egyéni (azaz meg nem osztott) Nobel-díjat nyert. Az 1930-as években Pauling új matematikai elméleteket használt a kémiai kötés néhány alapelvének kimondására. 1939-es könyve a kémiai kötés természete az egyik legjelentősebb könyv, amelyet valaha kiadtak kémia.1935-re Pauling érdeklődése a biológiai molekulák felé fordult, és 1954-ben kémiai Nobel-díjat kapott a fehérje szerkezetével kapcsolatos munkájáért. (Nagyon közel állt a DNS kettős spirálszerkezetének felfedezéséhez, amikor James Watson és James Crick 1953-ban bejelentették saját felfedezésüket a DNS szerkezetéről. Később 1962-ben Nobel-békedíjat kapott a nukleáris fegyverek tesztelésének betiltásáért tett erőfeszítéseiért.
későbbi éveiben Pauling meggyőződött arról, hogy a nagy dózisú C-vitamin megakadályozza a betegségeket, beleértve a megfázást is. A legtöbb klinikai kutatás nem mutatott kapcsolatot, de Pauling továbbra is nagy adagokat vett be naponta. 1994-ben halt meg, miután egy életen át tudományos örökséget hozott létre, amelyet kevesen fognak elérni.

Linus Pauling a 20.század egyik legbefolyásosabb vegyésze volt.
6.példa
írja le az elektronegativitási különbséget az egyes atompárok és az ebből eredő polaritás (vagy kötéstípus) között.
- C és H
- H és H
- Na és Cl
- O és H
oldat
- a szén elektronegativitása 2,5, míg a hidrogén értéke 2,1. A különbség 0,3, ami meglehetősen kicsi. A C-H kötés ezért nem polárisnak tekinthető.
- mindkét hidrogénatom azonos elektronegativitási értékkel rendelkezik—2,1. A különbség nulla, tehát a kötés nem poláros.
- a nátrium elektronegativitása 0,9, míg a klór 3,0. A különbség 2,1, ami meglehetősen magas, így a nátrium és a klór Ionos vegyületet képez.
- a hidrogén esetében 2,1, az oxigén esetében 3,5, az elektronegativitási különbség 1,4. Nagyon poláris kötést várnánk, de nem annyira poláris, hogy az O–H kötést ionnak tekintsük.
Készségfejlesztő gyakorlat
-
C és O
-
K és Br
írja le az elektronegativitási különbséget az egyes atompárok és az ebből eredő polaritás (vagy kötéstípus) között.
n és N
Cs és F
amikor egy molekula kötései poláris, a molekula egésze egyenetlen töltéseloszlást mutathat, attól függően, hogy az egyes kötések hogyan orientálódnak. Például egy vízmolekulában a két O–H kötés orientációja (4.5.ábra “fizikai tulajdonságok és polaritás”) meghajlik: a molekula egyik vége részleges pozitív töltéssel rendelkezik, a másik vége pedig részleges negatív töltéssel rendelkezik. Röviden, maga a molekula poláris. A víz polaritása óriási hatással van fizikai és kémiai tulajdonságaira. (Például a víz forráspontja magas egy ilyen kis molekula esetében, és annak a ténynek köszönhető, hogy a poláris molekulák erősen vonzzák egymást. Ezzel szemben, míg a szén-dioxidban a két C=O kötés poláris, közvetlenül egymással szemben helyezkednek el, így megszüntetik egymás hatásait. Így a szén-dioxid molekulák összességében nem polárisak. Ez a polaritás hiánya befolyásolja a szén-dioxid néhány tulajdonságát. (Például a szén-dioxid gázzá válik -77 CAC-on, ami majdnem 200 oc-al alacsonyabb, mint a víz forrási hőmérséklete.)
ábra 4.5 fizikai tulajdonságok és polaritás

a víz és a szén-dioxid fizikai tulajdonságait polaritásuk befolyásolja.
Concept Review gyakorlatok
-
mi a neve a kovalens kötés két atomja közötti távolságnak?
-
mit jelez egy atom elektronegativitása?
-
milyen típusú kötés alakul ki két atom között, ha az elektronegativitás különbsége kicsi? Közepes? Nagy?
válaszok
-
kötéshossz
-
az elektronegativitás kvalitatív mértéke annak, hogy egy atom mennyire vonzza az elektronokat egy kovalens kötésben.
-
nem poláris; poláris; Ionos
kulcs elvihető
- a különböző atomok közötti kovalens kötések különböző kötéshosszúak.
- a kovalens kötések lehetnek polárisak vagy nem polárisak, az érintett atomok elektronegativitási különbségétől függően.
gyakorlatok
-
melyik hosszabb—C–H kötés vagy C–O kötés? (Lásd a 4.2. táblázatot: “egyes egyes kötések hozzávetőleges Kötéshossza”.)
-
melyik rövidebb—N–H kötés vagy C–H kötés? (Lásd a 4.2. táblázatot: “egyes egyes kötések hozzávetőleges Kötéshossza”.)
-
egy nanométer 10-9 m. a 4.2.táblázat “egyes egyes kötések hozzávetőleges Kötéshossza” és a 4. táblázat adatai alapján.3 “a kötés hosszának összehasonlítása egy-és Többkötésnél”, határozza meg az egyes kötések hosszát nanométerben.
- A C–O kötés
- A C=O kötés
- egy H–N kötés
- A C-N kötés
-
az Angström (ons) meghatározása 10-10 m. a 4.2.táblázat “egyes kötések hozzávetőleges Kötéshosszai” és a 4.3. táblázat “az egyes és többszörös kötések Kötéshosszainak összehasonlítása”, határozza meg az egyes kötések hosszát angstromokban.
- A C–C kötés
- A C=C kötés
- an N = N kötés
- egy H–O kötés
-
lásd a 3.gyakorlatot. Miért hasznos a nanométeres egység a kötéshossz kifejezésére?
-
lásd a 4.gyakorlatot. Miért hasznos az angstrom egység a kötéshossz kifejezésére?
-
a 4.4.ábra “különböző elemek elektronegativitása” segítségével határozza meg, hogy az egyes párok melyik atomja rendelkezik a nagyobb elektronegativitással.
- H vagy C
- O vagy Br
- Na vagy Rb
- i vagy Cl
- Mg vagy O
- S vagy F
- Al vagy Ga
- O vagy I
-
az elektronok egyenlően vagy egyenlőtlenül oszlanak meg az egyes kovalens kötésekben? Ha egyenlőtlenül, melyik atomhoz vonzódnak az elektronok erősebben?
- C – O kötés
- egy F – F kötés
- egy S-N kötés
- egy I-Cl kötés
-
az elektronok egyenlően vagy egyenlőtlenül oszlanak meg az egyes kovalens kötésekben? Ha egyenlőtlenül, melyik atomhoz vonzódnak az elektronok erősebben?
- A C–C kötés
- A S–Cl kötés
- egy O–H kötés
- egy H–H kötés
a 4.4.ábra “különböző elemek elektronegativitása” segítségével határozzuk meg, hogy az egyes párok melyik atomja rendelkezik az alacsonyabb elektronegativitással.
válaszok
-
A C–O kötés hosszabb.
-
- 0,143 nm
- 0,120 nm
- 0,100 nm
- 0.116 nm
-
a tényleges kötéshossz nagyon kicsi, így a nanométeres egység megkönnyíti a hosszúság kifejezését.
-
- C
- O
- Na
- CL
-
- egyenlőtlenül az O felé
- egyenlőtlenül az N felé
- egyenlőtlenül a Cl felé
