az embrióból történő egyedi képződési folyamat
a sejttípusok széles választéka alkotja az emberi testet, amely összesen mintegy 60 billió sejtből áll. Mindegyik sejt végül egyetlen megtermékenyített petesejtből származik, amely osztódni kezdett, végül különböző morfológiájú és funkciójú szomatikus sejtekké differenciálódott, amelyek az emberi test különböző szöveteit és szerveit alkotják. Úgy tekintik, hogy a pluripotens őssejtek extraembrionális differenciálódás nélkül hasonló potenciállal rendelkeznek.
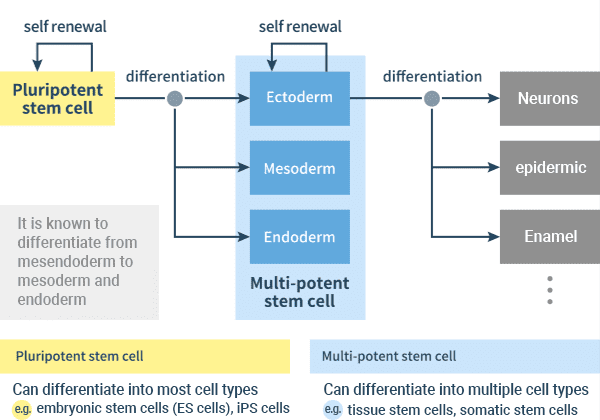
ábra: A különböző szöveti sejttípusok pluripotens őssejtekből történő indukciója három csírarétegen keresztül
az egyén kialakulásának folyamatában az őssejtek megváltoznak (differenciálódnak) olyan sejtekké, amelyek különböznek egymástól, miközben megtartják a proliferációs képességet, hogy osztódjanak és több azonos típusú sejtet hozzanak létre, vagy tovább differenciálódjanak egy speciálisabb formába. Így jönnek létre a különböző szervek.
a blasztociszta szakaszban, az embrionális fejlődés korai szakaszában vannak olyan sejtek, amelyek képesek megkülönböztetni a testet alkotó szinte bármilyen sejttípust, az úgynevezett képességet pluripotentcy.In vitro a pluripotens őssejtek, beleértve az ES-sejteket és az iPS-sejteket, megkülönböztethetők az endodermából, a mezodermából és az ektodermából származó sejttípusokra, de önmagukban nem képesek teljes organizmusgá fejlődni. Ezzel szemben azokat az őssejteket, amelyek csak korlátozott számú sejttípusra képesek differenciálódni, mint például a szöveti őssejtek és a szomatikus őssejtek, multipotens őssejteknek nevezzük.
ezeket a sejteket nemcsak alapkutatásra használják, ahol specifikus sejtekre differenciálják tulajdonságaik megvizsgálására, hanem a “gyógyszerfelfedezés szűrésére” is a gyógyszerjelöltek keresésére, valamint a “regeneratív orvoslásra”, ahol átültetik vagy terápiás szerként adják be a betegeknek. A pluripotens őssejtek tenyésztése azonban sok szempontból különbözik a hagyományos szomatikus sejttenyészetektől, és azt mondják, hogy nehéz fenntartani a differenciálatlan állapotot és biztosítani a magas szintű reprodukálhatóságot.
A multipotens őssejtek és a pluripotens őssejtek osztályozása és jellemzői
multipotens őssejtek
a multipotens őssejtek képesek olyan sejtekké differenciálódni, amelyek specifikus szöveteket és szerveket tartalmaznak, és magukban foglalják mind a szöveti őssejteket, mind a szomatikus őssejteket.
a szöveti őssejtek szövetspecifikusak, és képesek vagy önmegújulni hasonló típusú leánysejtekre osztódva, vagy a szöveten belül speciálisabb sejtekké differenciálódni.
a szomatikus őssejtek léteznek vivo és korlátozott számú sejttípusra képesek differenciálódni. A mezenchimális őssejtek (MSC-k) a szomatikus őssejtek egy típusa, és megkülönböztethetők csontokra, porcokra, véredényekre és cardiomyocytákra. Az MSC-ket viszonylag könnyedén nyerik a csontvelőből, a köldökzsinórszövetből, a köldökzsinórvérből és a zsírszövetből.
A jelentések szerint a multipotens őssejtek gyulladásgátló hatással, növekedési faktort indukáló hatással, proangiogén hatással rendelkeznek, és fontos szerepet játszanak a szövetek helyreállításában. Ezenkívül állítólag csökkent a rák kockázata a pluripotens őssejtekhez képest, ami fontos biztonsági szempont.
a regeneratív gyógyászati termékeket már világszerte jóváhagyták a gerincvelő sérüléseinek és a hematopoietikus őssejt-transzplantáció utáni akut graft-versus-host betegség kezelésére.
táblázat: Examples of Approved Regenerative Medical Products That Use Human MSCs in the World-
| Regenerative Medical Products | Approved Countries | Manufacturing Distributors | Origin MSC | Applications |
|---|---|---|---|---|
| PROCHYMAL® | Canada, New Zealand | Mesoblast | Allogeneic bone marrow-derived MSC | Acute GVHD*(pediatric) |
| TEMCELL® HS Inj. | Japan | JCR Pharma | Allogeneic bone marrow-derived MSC | Acute GVHD* |
| Stemirac® Inj. | Japan (conditional approval) | Nipro | Autologous bone marrow-derived MSC | Spinal cord injury |
| Heartcellgram-AMI® | South Korea | Pharmicell | Autologous bone marrow-derived MSC | Acute myocardial infarction |
| Cupistem® | South Korea | Anterogen | MSC derived from own fat | Crohn’s disease |
| CARTISTEM® | South Korea, EU | Medipost | Allogeneic cord blood-derived MSC | Knee osteoarthritis |
| Stempeucel® | EU, India (conditional approval) |
Stempeutics Research |
Allogeneic bone marrow-derived MSC | Knee osteoarthritis |
| Allostem® | USA | Allosource | Allogeneic fat derived MSC (A combination product composed of human demineralized bone matrix) |
Bone damage |
| Osteocel® Plus | US | NuVasive | Allogeneic bone marrow-derived MSC (A combination product composed of osteoprogenitor cells and human demineralized bone matrix) |
Bone repair (361HCT/P) |
*GvHD: Graft Versus Host betegség
pluripotens őssejtek
a pluripotens őssejtek olyan őssejtek, amelyek szinte bármilyen sejtté képesek differenciálódni, amely a testet alkotja. Az ESC-ket, az embrionális csírasejteket (EGC-ket) és az iPSC-ket eddig pluripotens őssejtek típusaként határozták meg.
az Esc-ket az üreges blasztocisztán belüli belső sejttömegből hozzák létre, amely az embrionális fejlődés korai szakasza, miután a zigóta blasztulává osztotta. Japánban az ES-sejteket a megtermékenyített petesejtek többletellátásából hozzák létre, amelyeket a meddőségi kezelést követően eldobnak. Az EGC-k a spermiumok és petesejtek sejtprekurzoraiból (primordiális csírasejtek) származnak, és majdnem ugyanolyan tulajdonságokkal rendelkeznek, mint az Esc-k.
az iPSC-ket a szomatikus sejtek differenciálatlan állapotba történő átprogramozásával hozzák létre specifikus gének bevezetésével. Az iPSC-k létrehozása lehetővé tette számunkra, hogy az Esc-khez hasonló sejteket kapjunk a donoroktól. Az is lehetséges, hogy a beteg által szállított szövetet a betegség, iPSC-k létrehozása a szövetből, és indukálja a differenciálódást, hogy anin vitro modell a betegség. Ezért az iPSC-k indukált differenciálódásával létrehozott szomatikus sejtek, például idegsejtek vagy cardiomyocyták nagy potenciállal rendelkeznek olyan alkalmazásokhoz, mint például a betegség etiológiájának meghatározása, a gyógyszer hatékonyságának és mellékhatásainak értékelése, valamint a betegekbe történő transzplantáció, mint regeneratív gyógyászat terápiák. Azonban nem szándékos génmutációkról számoltak be az iPSC-kultúrák létrehozásakor, valamint az iPSC-k és az Esc-k hosszú időn át történő szubkultúrálásakor. Jelenleg nem ismert, hogy ezek a genetikai mutációk veszélyesek-e, ezért a kutatók megvitatják, hogyan lehet a legjobban értékelni biztonságosságukat a jövőbeni gyakorlati felhasználás érdekében.
