tanulási célok
- írja be egy egyszerű ionos vegyület kémiai képletét.
- ismerje fel a többatomos ionokat a kémiai képletekben.
már találkoztunk néhány kémiai képlettel az egyszerű Ionos vegyületekre. A kémiai képlet a vegyület elemeinek és ezen elemek arányainak tömör listája. Ahhoz, hogy jobban megértsük, mit jelent a kémiai képlet, meg kell fontolnunk, hogyan épül fel egy ionos vegyület ionjaiból.
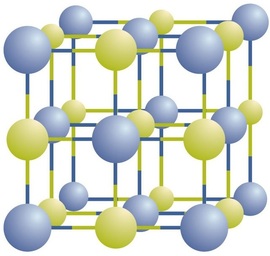
az ionos vegyületek váltakozó pozitív és negatív ionokként léteznek szabályos, háromdimenziós tömbökben, amelyeket kristályoknak neveznek (\(\PageIndex{1}\) ábra). Mint látható, nincsenek egyedi\ (\ce{NaCl}\) “részecskék” a tömbben; ehelyett folyamatos rács van váltakozó nátrium-és kloridionokból. A vegyület leírásának módjaként azonban felhasználhatjuk a nátriumionok kloridionokhoz viszonyított arányát, a lehető legalacsonyabb egész számokban kifejezve. Nátrium-klorid esetében a nátrium-ionok aránya a kloridionokhoz, a legalacsonyabb egész számokban kifejezve, 1:1, így használjuk \(\ce{NaCl}\) (egy \(\ce{Na}\) szimbólum és egy \(\ce{Cl}\) szimbólum), hogy képviselje a vegyület. Így a\ (\ce{NaCl}\) a nátrium-klorid kémiai képlete, amely tömör módon írja le a vegyületben lévő különböző ionok relatív számát. A makroszkopikus minta áll számtalan NaCl pár; minden egyes pár nevezett képlet egység. Bár kényelmes azt gondolni, hogy a\ (\ce{NaCl}\) kristályok Egyedi \(\ce{NaCl}\) egységekből állnak, a \(\PageIndex{1}\) ábra azt mutatja, hogy egyetlen ion sem kapcsolódik kizárólag más egyetlen ionhoz. Minden iont ellentétes töltésű ionok vesznek körül.
az ionos vegyület képlete több konvenciót követ. Először is, a kation az anion előtt íródik. Mivel a legtöbb fém kationokat, a legtöbb nemfém pedig anionokat képez, a képletek általában először a fémet, majd a nemfémeket sorolják fel. Másodszor, a díjakat nem képletben írják. Ne feledje, hogy egy ionos vegyületben a komponensfajok ionok, nem semleges atomok, annak ellenére, hogy a képlet nem tartalmaz töltéseket. Végül az ionos vegyület megfelelő képletének mindig nettó nulla töltése van, vagyis a teljes pozitív töltésnek meg kell egyeznie a teljes negatív töltéssel. Az ionok bármely kombinációjának megfelelő képletének meghatározásához meg kell határozni, hogy az egyes ionokból hány szükséges a vegyület összes pozitív és negatív töltésének kiegyensúlyozásához.
Ez a szabály végső soron azon a tényen alapul, hogy az anyag összességében elektromosan semleges.
konvenció szerint tegyük fel, hogy csak egy atom van, ha nincs index. Az 1-et nem használjuk indexként.
Ha megnézzük a lítiumionokból és bromidionokból álló Ionos vegyületet, azt látjuk, hogy a lítiumionnak 1+ töltése van, a bromidionnak pedig 1 töltése van. Mindegyikből csak egy ionra van szükség a töltések kiegyensúlyozásához. A lítium-bromid képlete \(\ce{LiBr}\).
amikor egy ionos vegyület képződik magnéziumból és oxigénből, a magnéziumionnak 2 + töltése van, az oxigénatomnak pedig 2 töltése van. Bár mindkét ionnak magasabb a töltése, mint a lítium-bromid ionjainak, mégis egy-egy arányban egyensúlyozzák egymást. Ezért ennek az ionos vegyületnek a megfelelő képlete \(\ce{MgO}\).
most nézzük meg a magnézium és a klór által alkotott Ionos vegyületet. Egy magnéziumionnak 2 + töltése van, míg egy klórionnak 1 töltése:
\
mindegyik ion kombinálása nem teljesen egyensúlyozza a pozitív és negatív töltéseket. A legegyszerűbb módja annak, hogy ezeket a töltéseket egyensúlyba hozzuk, ha feltételezzük, hogy minden magnéziumionhoz két kloridion van jelen:
\
most a pozitív és a negatív töltések egyensúlyban vannak. Írhatnánk ennek az ionos vegyületnek a kémiai képletét \(\ce{MgClCl}\), de az a konvenció, hogy numerikus indexet használunk, ha egy adott típusú egynél több ion van—\(\ce{MgCl2}\). Ez a kémiai képlet azt mondja, hogy ebben a képletben egy magnéziumion és két kloridion van. (Ne olvassa a képlet” Cl2 ” részét a kétatomos elemi klór molekulájaként. A klór nem létezik kétatomos elemként ebben a vegyületben. Inkább két különálló kloridionként létezik.) Konvenció szerint a legalacsonyabb egész szám arányt használják az ionos vegyületek képleteiben. A \(\ce{Mg2Cl4}\) képlet 1:2 arányban kiegyensúlyozott töltéseket tartalmaz az ionokkal, de ez nem a legalacsonyabb egész szám Arány.
olyan vegyületek esetében, amelyekben az ionok aránya nem olyan nyilvánvaló, a képletben szereplő előfizetések a töltések keresztezésével nyerhetők: az egyik ion töltésének abszolút értékét használja a másik ion indexeként. Ezt a módszert vázlatosan mutatja a 3.3.2. ábra.
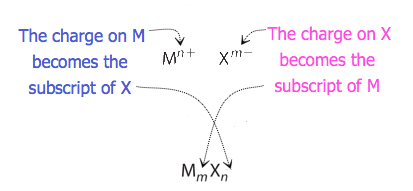
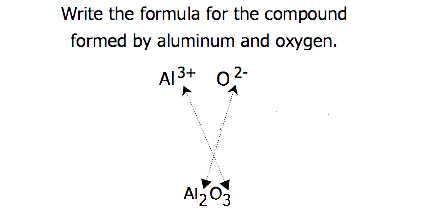
a díjak átlépésekor néha szükség van az előfizetések legegyszerűbb arányára történő csökkentésére az empirikus képlet megírásához. Vegyük például a PB által alkotott vegyületet4+ és O2 -. Ha az ionok töltéseinek abszolút értékeit előfizetőként használjuk, akkor a pb2o4 képletet kapjuk. Ez leegyszerűsíti a helyes empirikus képletét PbO2. Az empirikus képlet egy Pb4+ iont és két O2− iont tartalmaz.
példa \(\PageIndex{1}\)
írja be az egyes ionpárokból álló ionos vegyület kémiai képletét.
- a nátrium− ion és a kén-ion
- az alumínium-ion és a fluorid-ion
- a 3+ vas-ion és az oxigén-ion
oldat
- a vegyértékhéj oktettjének megszerzéséhez a nátrium egy 1+ Töltse fel, míg a kénion 2 töltéssel rendelkezik. Két nátrium-1 + ionra van szükség a kénion 2− töltésének kiegyensúlyozásához. Ahelyett, hogy a képletet \(\ce{NaNaS}\) – ként írnánk, konvencióval lerövidítjük \(\ce{Na2S}\) – re.
- az alumíniumion 3+ töltéssel rendelkezik, míg a fluor által alkotott fluoridion 1 töltéssel rendelkezik. Három fluor 1-ionra van szükség az alumíniumion 3+ töltésének kiegyensúlyozásához. Ez a kombináció \(\ce{AlF3}\).
- a vas két lehetséges iont képezhet, de a 3+ töltésű ion itt van megadva. Az oxigénatom ionként 2 töltéssel rendelkezik. A pozitív és negatív töltések kiegyensúlyozásához a legkevésbé gyakori többszörösre—6− ra tekintünk: két vas 3+ Ion 6+− ot ad, míg három 2-oxigénion 6-ot, ezáltal kiegyensúlyozva az általános pozitív és negatív töltéseket. Így ennek az ionos vegyületnek a képlete \(\ce{Fe2O3}\). Alternatív megoldásként használja a 3.3.2.ábrán bemutatott keresztezési díjak módszerét.
gyakorlat \(\PageIndex{1}\)
írja be az egyes ionpárokból álló ionos vegyület kémiai képletét.
- a kalciumion és az oxigénion
- a 2+ rézion és a kénion
- az 1 + rézion és a kénion
válasz A:
CaO
válasz b:
CuS
válasz c:
Cu2S
Többatomos ionok
egyes ionok kovalensen összekapcsolt atomcsoportokból állnak, és teljes elektromos töltéssel rendelkeznek. Mivel ezek az ionok egynél több atomot tartalmaznak, poliatomikus ionoknak nevezzük őket. Egyes poliatomikus ionok Lewis-struktúráit, neveit és képleteit a 3.3.1.táblázat tartalmazza.
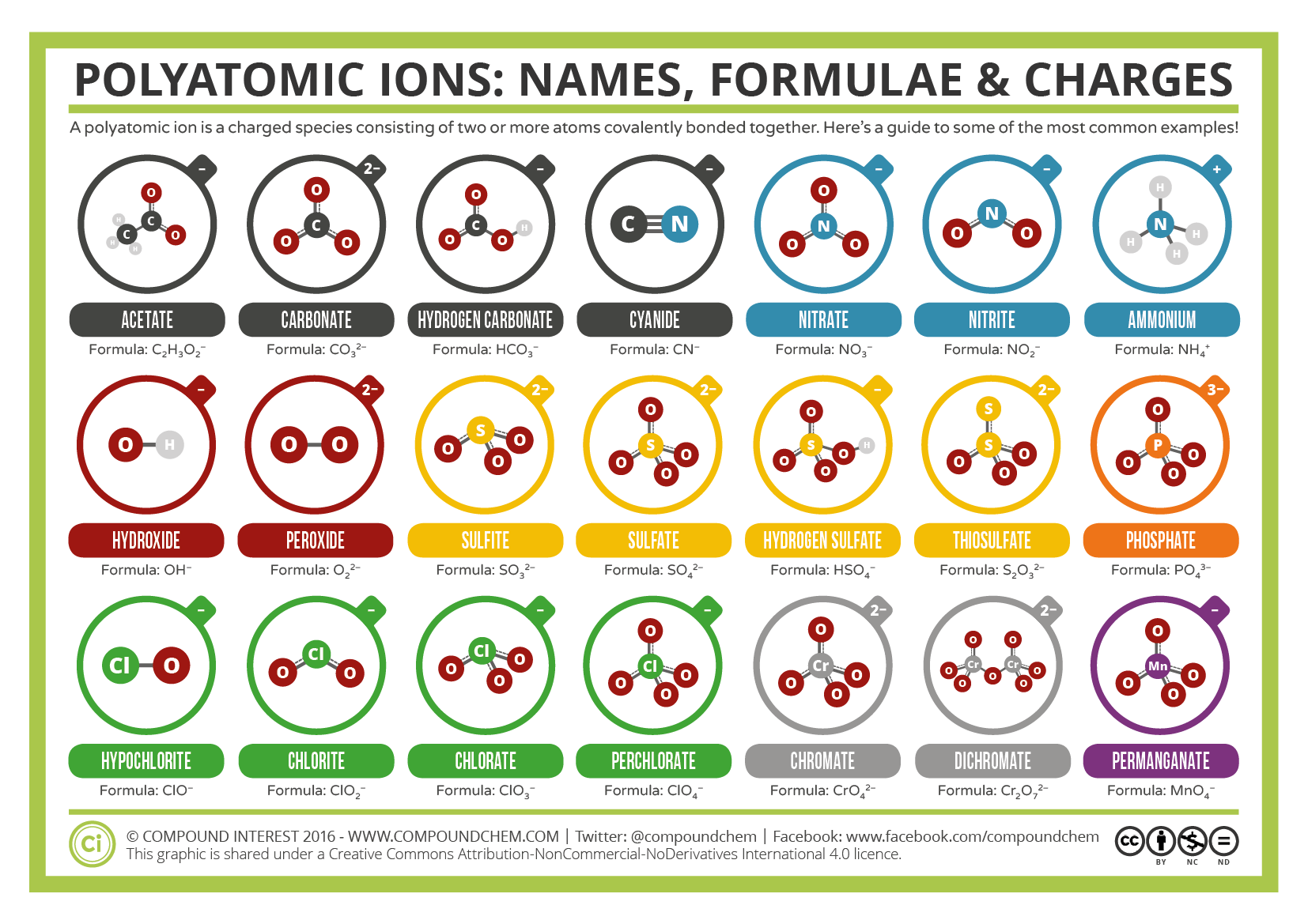
Table \(\PageIndex{1}\): Néhány poliatomikus ionnak vannak olyan képletei, nevei és töltései, amelyeket semmilyen módon nem lehet módosítani. A \(\PageIndex{2}\) táblázat a leggyakoribb poliatomikus ionok ionneveit és ionképleteit sorolja fel. Például, \(\ce{NO3^ { – }}\) a nitrátion; van egy nitrogénatom és három oxigénatom és egy teljes 1− töltés. Ábra \(\PageIndex{2}\) felsorolja a leggyakoribb poliatomikus ionokat.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. A fennmaradó többatomos ionok mind negatív töltésűek, ezért anionokként vannak besorolva. Ezek közül azonban csak kettőt, a hidroxidiont és a cianidiont nevezik el az”-ide ” utótaggal, amely jellemzően negatív töltésű részecskékre utal. A fennmaradó többatomos anionok, amelyek mindegyike oxigént tartalmaz, egy másik nemfémmel kombinálva, egy olyan sorozat részeként léteznek, amelyben a többatomos egységen belüli oxigének száma változhat. Amint azt a szöveg több szakaszában többször hangsúlyozták, nincs két kémiai képletnek közös kémiai neve. Egyetlen “-ide ” utótag nem elegendő az anionok nevének megkülönböztetéséhez egy kapcsolódó poliatomikus sorozatban. Ezért”- ate “és” – ite ” utótagokat alkalmaznak annak jelzésére, hogy a megfelelő poliatomikus ionok egy sorozat részét képezik. Ezenkívül ezek az utótagok jelzik a poliatomikus ionokban található oxigének relatív számát is. Vegye figyelembe, hogy az összes poliatomikus Ion, amelynek neve “-ate”- re végződik, eggyel több oxigént tartalmaz, mint azok a poliatomikus anionok, amelyek neve “- ite ” – ra végződik.”Sajnos, hasonlóan az átmeneti fémek elnevezésének általános rendszeréhez, ezek az utótagok csak a poliatomikus ionokban található oxigén relatív számát jelzik. Például a nitrátion, amelyet no-ként szimbolizálnak3−1, eggyel több oxigént tartalmaz, mint a nitrition, amelyet no-ként szimbolizálnak2-1. A szulfátionot azonban SO4−2-ként szimbolizálják. Míg mind a nitrátion, mind a szulfátion “-ate” utótaggal rendelkezik, az előbbi három oxigént tartalmaz, az utóbbi pedig négyet. Ezenkívül mind a nitrátion, mind a szulfition három oxigént tartalmaz, de ezeknek a többatomos ionoknak nincs közös utótagjuk. Sajnos ezeknek az utótagoknak a relatív jellege megköveteli, hogy a poliatomikus ionok ionképlet/ionnév kombinációit egyszerűen meg kell jegyezni.
a poliatomikus ionokat tartalmazó ionos vegyületek képleteinek felépítésére vonatkozó szabály ugyanaz, mint a monatomikus (egyatomos) ionokat tartalmazó képletek esetében: a pozitív és negatív töltéseknek egyensúlyban kell lenniük. Ha egy adott többatomos ion közül egynél több szükséges a töltés kiegyensúlyozásához, akkor a többatomos ion teljes képletét zárójelben kell elhelyezni, a numerikus indexet pedig a zárójelen kívül kell elhelyezni. Ennek célja annak bemutatása, hogy az index a teljes poliatomi ionra vonatkozik. Az alábbiakban két példát mutatunk be:

példa \(\PageIndex{2}\)
írja be az egyes ionpárokból álló ionos vegyület kémiai képletét.
- a káliumion és a szulfátion
- a kalciumion és a nitrátion
oldat
- a káliumionok töltése 1+, míg a szulfátionoké 2−. Két káliumionra lesz szükségünk a szulfátion töltésének kiegyensúlyozásához, tehát a megfelelő kémiai képlet \(\ce{K_2SO_4}\).
- a kalciumionok töltése 2+, míg a nitrátionok töltése 1−. Két nitrátionra lesz szükségünk az egyes kalciumionok töltésének kiegyensúlyozásához. A nitrát képletét zárójelben kell elhelyezni. Így írjuk \(\ce{Ca (NO3)2}\) Ennek az ionos vegyületnek a képletét.
gyakorlat \(\PageIndex{2}\)
írja be az egyes ionpárokból álló ionos vegyület kémiai képletét.
- a magnézium – ion és a karbonát – ion
- az alumínium-ion és az acetát-ion
válasz A:
Mg2+ és CO32 – = MgCO3
válasz b:
Al3+ és C2H3O2 – = Al(C2H3O2)3
ionos vegyületek felismerése
az ionos vegyületek felismerésének két módja van. Először is, a fém és a nemfémes elemek közötti vegyületek általában ionok. Például a CaBr2 tartalmaz egy fémes elemet (kalcium, 2A.csoport fém) és egy nemfémes elemet (bróm, 7a. csoport nemfémes). Ezért valószínűleg ionos vegyület. (Valójában Ionos.) Ezzel szemben az NO2 vegyület két elemet tartalmaz, amelyek mind nemfémek (az 5a csoportból származó nitrogén, mind a 6a csoportból származó oxigén). Ez nem ionos vegyület; a kovalens vegyületek kategóriájába tartozik, amelyeket másutt tárgyalnak. Vegye figyelembe azt is, hogy a nitrogén és az oxigén ezen kombinációja nem rendelkezik elektromos töltéssel, tehát nem a nitrition.
másodszor, ha felismeri a vegyület poliatomikus ionjának képletét, akkor a vegyület Ionos. Például, ha a \(\ce{Ba(NO3)2}\) képletet látja, akkor felismerheti a “NO3” részt nitrátionként, \(\rm{NO_3^−}\). (Ne feledje, hogy az ionos vegyületek képleteinek írására vonatkozó egyezmény nem tartalmazza az ionos töltést.) Ez arra utal, hogy a képlet másik része, \(\ce{Ba}\) valójában a \(\ce{Ba^{2+}}\) ion, a 2+ töltés kiegyensúlyozza a két nitrátion teljes 2− töltését. Így ez a vegyület is Ionos.
példa \(\PageIndex{3}\)
azonosítsa az egyes vegyületeket ionként vagy nem ionként.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{OF2}\)
megoldás
- a nátrium fém, az oxigén pedig nemfém; ezért \(\ce{Na2O}\) várhatóan Ionos.
- mind a foszfor, mind a klór nemfémek. Ezért \(\ce{PCl3}\) nem ionos.
- a képletben szereplő\ (\ce{NH4}\) az ammóniumion,\ (\ce{NH4^ {+}}\), ami azt jelzi, hogy ez a vegyület Ionos.
- mind az oxigén, mind a fluor nemfémek. Ezért \(\ce{OF2}\) nem ionos.
gyakorlat \(\PageIndex{3}\)
azonosítsa az egyes vegyületeket ionként vagy nem ionként.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce {(NH4) 3PO4}\)
- \(\ce{SOCl2}\)
válasz A:
nem ionos
válasz b:
Ionos
válasz c:
Ionos
válasz d:
nem ionos
közelebbről: vér és tengervíz
A tudomány régóta felismerte, hogy a vér és a tengervíz összetétele hasonló. Végül is mindkét folyadékban ionos vegyületek vannak feloldva. A hasonlóság több lehet, mint puszta véletlen; sok tudós úgy gondolja, hogy a Föld első életformái az óceánokban keletkeztek. Egy közelebbi vizsgálat azonban azt mutatja, hogy a vér és a tengervíz teljesen más. A 0,9% – os nátrium-klorid-oldat megközelíti a vérben található sókoncentrációt. Ezzel szemben a tengervíz elsősorban 3% – os nátrium-klorid-oldat, amely a vér koncentrációjának több mint háromszorosa. Itt található a vérben és a tengervízben lévő ionok mennyiségének összehasonlítása:
| Ion | százalék a vérben tengervíz | százalék a vérben |
|---|---|---|
| na+ | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Ez a különbség azért jelentős, mert a hidrogén-karbonát ion és néhány kapcsolódó Ion döntő szerepet játszik a vér sav-bázis tulajdonságainak szabályozásában. A hidrogén—foszfátionok−\(\ce{HPO4^{2−}}\) és \(\ce{H2PO4^{—}}\)-mennyisége a tengervízben nagyon alacsony, de nagyobb mennyiségben vannak jelen a vérben, ahol a sav-bázis tulajdonságokat is befolyásolják. Egy másik figyelemre méltó különbség az, hogy a vérben nincs jelentős mennyiségű szulfátion (\(\ce{SO4^{2−}}\)), de ez az ion jelen van a tengervízben.
kulcs elvihető
- Az ionos vegyületek megfelelő kémiai képletei egyensúlyba hozzák a teljes pozitív töltést a teljes negatív töltéssel.
- teljes töltésű atomcsoportok, úgynevezett poliatomikus ionok is léteznek.
gyakorlatok
-
milyen információkat tartalmaz az ionos vegyület képlete?
-
miért tartalmaznak egyes ionos vegyületek kémiai képletei előfizetéseket, míg mások nem?
3. Írja be az egyes ionpárok által alkotott ionos vegyület kémiai képletét.
- Mg2+ és I−
- Na+ és O2−
4. Írja be az egyes ionpárok által alkotott ionos vegyület kémiai képletét.
- Na+ és Br−
- Mg2+ és Br−
- Mg2+ és S2−
5. Írja be az egyes ionpárok által alkotott ionos vegyület kémiai képletét.
- K+ és Cl−
- Mg2+ és Cl−
- Mg2+ és Se2−
6. Írja be az egyes ionpárok által alkotott ionos vegyület kémiai képletét.
- Na+ és N3−
- Mg2+ és N3−
- Al3+ és S2−
7. Írja be az egyes ionpárok által alkotott ionos vegyület kémiai képletét.
- Li+ és N3−
- Mg2+ és P3−
- Li+ és P3−
8. Írja be az egyes ionpárok által alkotott ionos vegyület kémiai képletét.
- Fe3+ és Br−
- Fe2+ és Br−
- Au3+ és S2−
- au+ és S2−
9. Írja be az egyes ionpárok által alkotott ionos vegyület kémiai képletét.
- Cr3+ és O2−
- Cr2+ és O2−
- Pb2+ és Cl−
- PB4+ és Cl−
10. Írja be az egyes ionpárok által alkotott ionos vegyület kémiai képletét.
- Cr3+ és NO3−
- Fe2+ és PO43−
- Ca2+ és CrO42−
- Al3+ és OH−
11. Írja be az egyes ionpárok által alkotott ionos vegyület kémiai képletét.
- NH4+ és NO3−
- H+ és Cr2O72−
- Cu+ és CO32−
- Na+ és HCO3−
12. Minden elempár esetében határozzuk meg az ionjaik töltését, és írjuk be a megfelelő képletet a kapott Ionos vegyületre.
- Ba és S
- Cs és I
13. Minden elempár esetében határozzuk meg az ionjaik töltését, és írjuk be a megfelelő képletet a kapott Ionos vegyületre.
- K és S
- Sc és Br
14. Ön szerint mely vegyületek lehetnek ionosak?
- Li2O
- (NH4)2o
- CO2
- FeSO3
- C6H6
- C2H6O
15. Ön szerint mely vegyületek lehetnek ionosak?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2cro4
- C8H18
- NH3
válaszok
1. az egyes típusú ionok aránya a vegyületben
2. Néha egynél több ionra van szükség a másik ion töltésének kiegyensúlyozásához egy ionos vegyületben.
- MgI2
- Na2O
- Nabr
- Mgbr2
- MGS
- KCL
- MgCl2
- mgse
- na3n
- Mg3n2
- AL2S3
- li3n
- mg3p2
- li3p
- febr3
- febr2
- au2s3
- au2s
- Cr2O3
- cro
- PbCl2
- PbCl4
- Cr(No3)3
- Fe3(PO4)2
- cacro4
- Al(OH)3
- NH4NO3
- H2cr2o7
- cu2co3
- NaHCO3
- ba2+, S2−, bas
- cs+, i−, CSI
- k+, S2−, K2S
- SC3+, br−, scbr3
- Ionos
- nem ionos
- Ionos
- nem ionos
- nem ionos
- nem ionos
- nem ionos
- nem ionos
- nem ionos
- nem Ionos
- div >
- Ionos
nem ionos nem ionos - Ionos
nem ionos nem ionos
- Ionos
