13.5 D: A Biotin egy CO2-hordozó koenzim
Emlékezzünk vissza a 6.5 b szakaszból, hogy sok enzim függ a koenzimek segítségétől, amelyek kicsi (a fehérjéhez viszonyítva) szerves molekulák, amelyek kötődnek – kovalensen vagy nem-kovalensen – egy enzim aktív helyén, és segít, hogy katalizálja a reakció. Az S-adenozil-metionin (SAM, 9.1 A szakasz) és az ATP (10.2 szakasz) két példa, amelyekkel eddig találkoztunk, és még többet fogunk látni az előttünk álló fejezetekben. Bár a Rubisco (e szakasz B. részében leírtak szerint) kivétel, a karboxilezési reakciókat katalizáló legtöbb enzim a biotin nevű koenzimtől függ, amely a szén-dioxid ideiglenes hordozójaként szolgál.
a piruvát-karboxiláz, a glükoneogensis út első lépését katalizáló enzim jó példa a biotin-függő karboxilezési reakcióra. Figyeljük meg, hogy a CO2 ebben a reakcióban bikarbonátból származik, ellentétben a Rubisco reakcióval, amelyben a CO2 közvetlenül a légkörből van rögzítve.

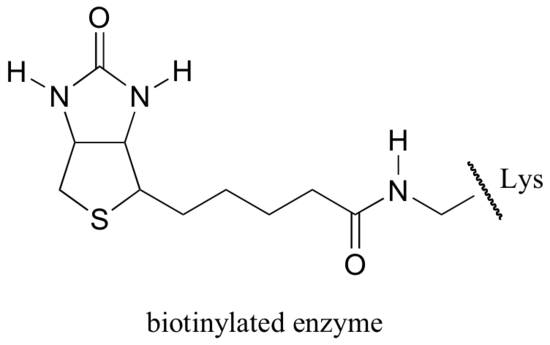
A Biotin kovalensen kapcsolódik az enzimhez egy aktív hely lizinhez való amidkötésen keresztül.
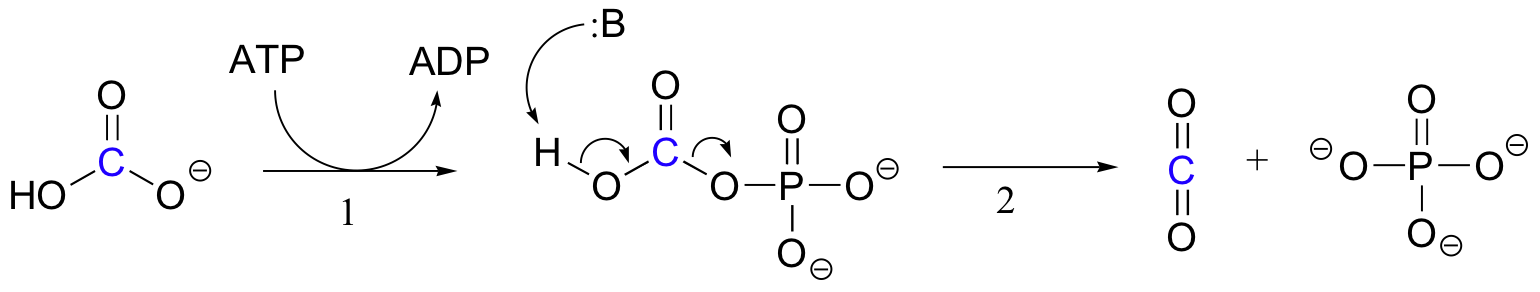
A biotin-függő karboxilezési reakciók pontos mechanizmusa még mindig nem teljesen ismert, azonban a következő valószínű kép. Először a bikarbonát-iont ATP foszforilálja (1.lépés, lásd a 10.2. szakaszt), és így aktiválódik a dekarboxilezéshez, amely szabad CO2-t generál (2. lépés).
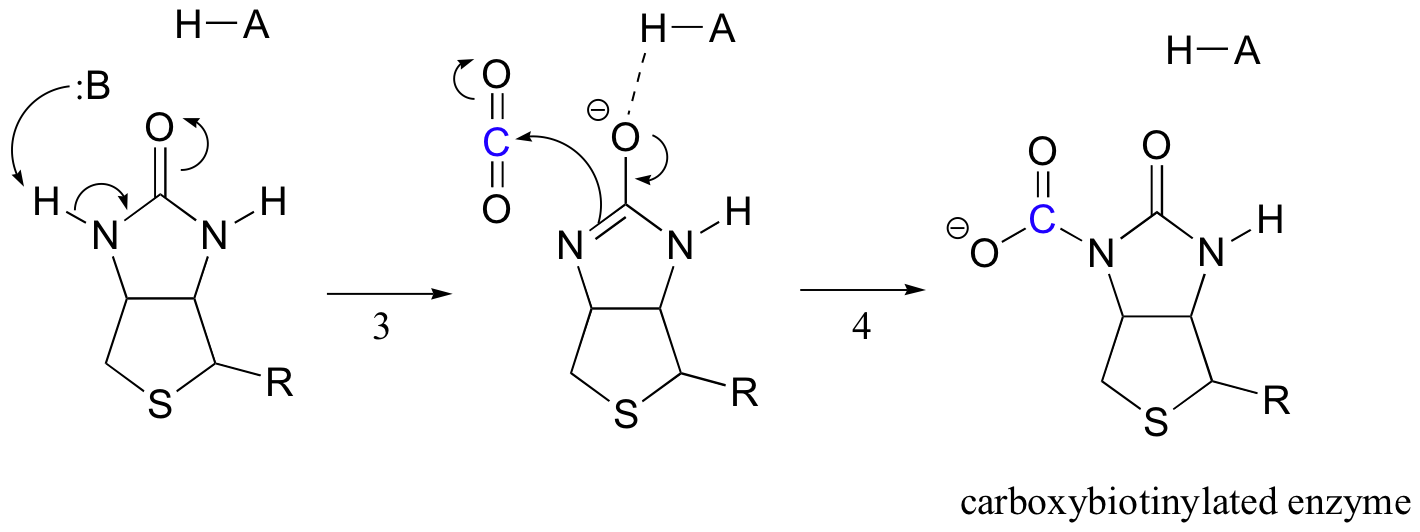
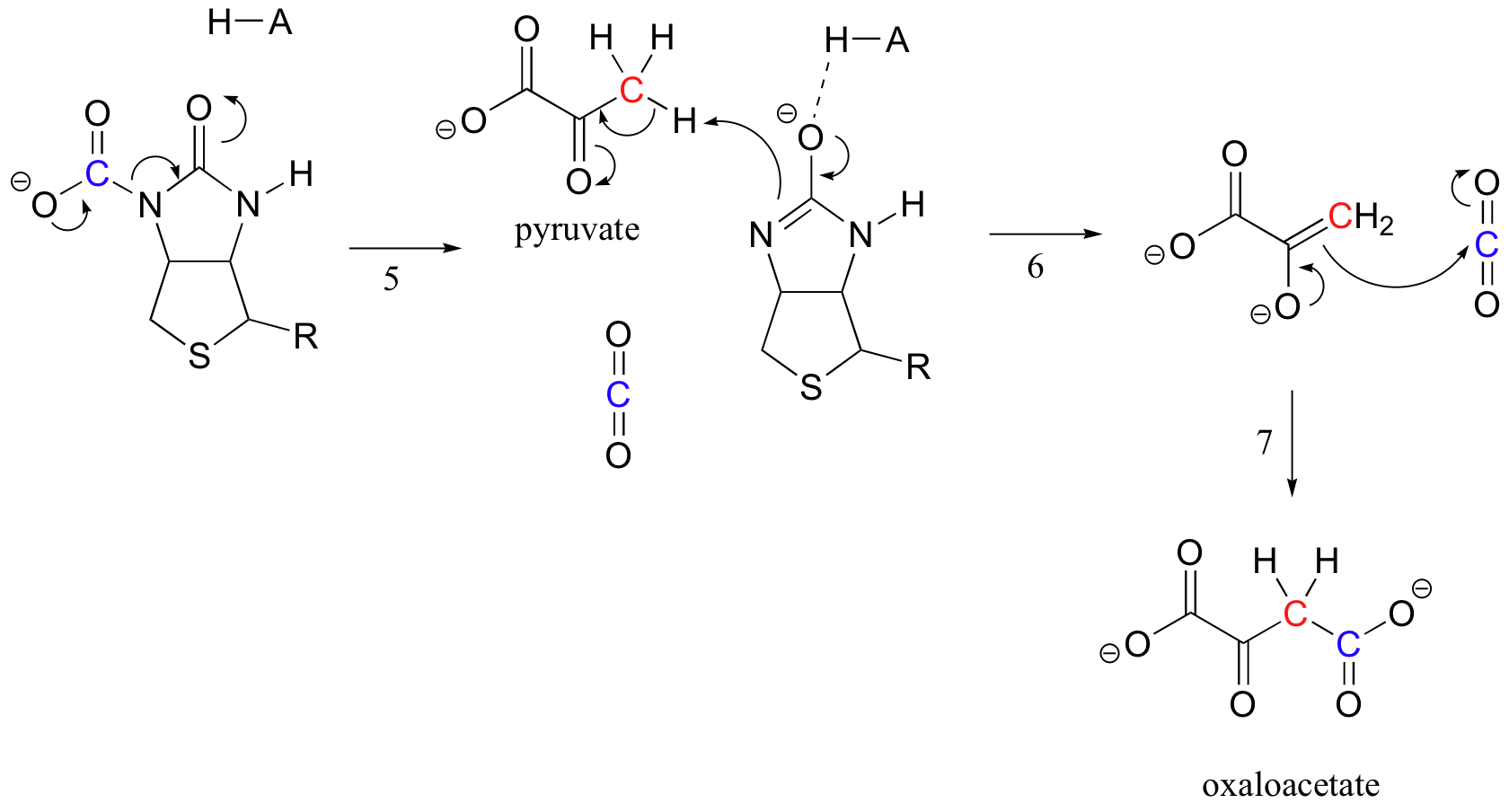
A Biotin feladata a szén-dioxid molekula megtartása, amíg a piruvát az aktív helyre nem kerül. A biotin karboxilezése magában foglalja az amid-nitrogén deprotonálását, hogy enolátszerű köztiterméket képezzen (3.lépés – az amidok pKa-ja körülbelül 17, és ezt csökkenti az aktív helysav jelenléte az oxigén közelében). Ezt a lépést követi a nukleofil nitrogén támadása a szén-dioxidra karboxi-biotinilezett enzim képződése céljából (4.lépés).
amikor egy piruvát molekula kötődik, az aktív hely architektúrájának átrendeződése az előző lépést megfordítja (5.lépés), felszabadítva a CO2-t, és létrehozva egy biotin bázist, amely deprotonálja a piruvát, hogy aldolszerű módon kondenzálódjon Co-val2 oxaloacetátot képezve (6-7. lépés).
ha tanulmányozta néhány biokémia, lehet, hogy hallott biotin egy kissé más összefüggésben, hogy mi tárgyaljuk ebben a szakaszban. Az avidin nevű fehérje, amely bőségesen megtalálható a tojásfehérjében, nem kovalensen és rendkívül szorosan kötődik a biotinhoz (valójában az avidin-biotin a legszűkebb fehérje-ligandum kötő pár, amelyet a tudomány ismer). A biokémikusok gyakran használják ezt a tulajdonságot azáltal, hogy kovalensen összekapcsolják az érdekes biomolekulát a biotinnal. A biotinilezett Fajok ezután könnyen elkülöníthetők egy komplex keverékből úgy, hogy a keveréket egy avidinnel bevont affinitási oszlopon vezetik át.
