számos módja van annak, hogy a sejt a tér egyik pontjáról a másikra mozogjon. Folyékony közegben ez a módszer lehet valamiféle úszás, ciliáris vagy flagelláris mozgás felhasználásával a sejt meghajtására. Szilárd felületeken ezek a mechanizmusok nyilvánvalóan nem működnek hatékonyan, és a sejt feltérképezési folyamaton megy keresztül. Ebben a részben a ciliáris/flagelláris mozgás megvitatásával kezdjük, majd megvizsgáljuk a sejtes feltérképezés bonyolultabb követelményeit.
a csillók és a flagellák, amelyek elsősorban hosszukban különböznek, nem pedig felépítésükben, mikrotubulus alapú organellák, amelyek oda-vissza mozdulattal mozognak. Ez azt jelenti, hogy a viszonylag rövid csillók” eveznek”, de a hosszabb flagellában a szerkezet rugalmassága miatt az oda-vissza mozgás hullámként terjed, így a flagelláris mozgás hullámosabb vagy ostorszerű (fontolja meg, mi történik, amikor a kerti tömlőt gyorsan oldalról oldalra csóválja, összehasonlítva ugyanazon tömlő rövid darabjával). Mindkét szerkezet magját axonémának nevezzük, amely 9 mikrotubulus dublettből áll, amelyeket ciliáris dynein motoros fehérjék kötnek össze, és két különálló mikrotubulus központi magját veszik körül.
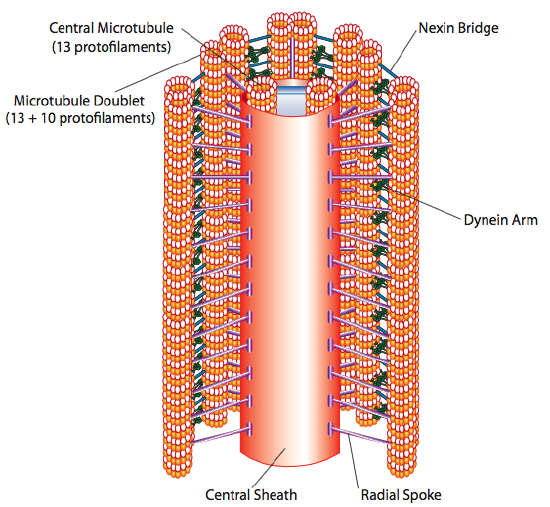
ezt “9+2” formációnak nevezik, bár a kilenc dublett nem azonos a két központi mikrotubulussal. Az A tubulus teljes 13-protofilamentum, de a hozzá fuzionált B tubulus csak 10 protofilamentumot tartalmaz. A központi mikrotubulusok mindegyike teljes 13 protofilamentum. A 9+2 axonéma kiterjeszti a csilló vagy a flagellum hosszát a csúcstól, amíg el nem éri az alapot, és egy bazális testen keresztül kapcsolódik a sejttesthez, amely 9 mikrotubulus hármasból áll, amelyek egy rövid hordóban helyezkednek el, hasonlóan a centriolákhoz, amelyekből származnak.
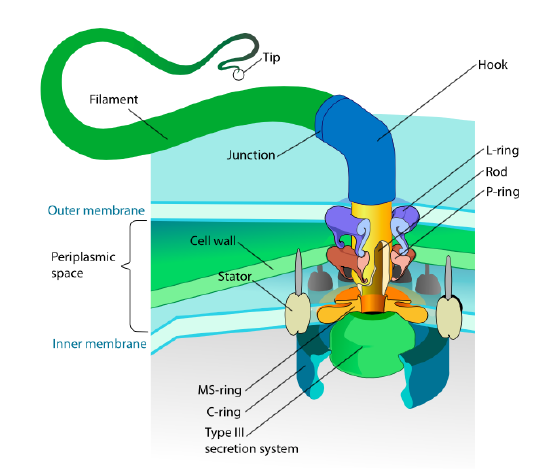
Ez a szakasz csak az eukariótákra vonatkozik. Néhány prokariótának mozgékony függelékei is vannak, amelyeket flagellának neveznek, de mind szerkezetükben, mind mechanizmusukban teljesen különböznek egymástól. Maguk a flagella a flagellin fehérje hosszú spirális polimerjei, a flagellin rostok alapja pedig egy rotációs motoros fehérjéhez kapcsolódik, nem pedig transzlációs motorhoz. Ez a motor (ábra \(\PageIndex{18}\)) ion (h+ vagy Na+ fajtól függően) elektrokémiai gradienst használ, hogy energiát biztosítson akár 100000 fordulat / perc forgatásához. Úgy gondolják, hogy a forgást az állórész gyűrűjének konformációs változásai hajtják, amelyek a sejtmembránban fészkelődnek.
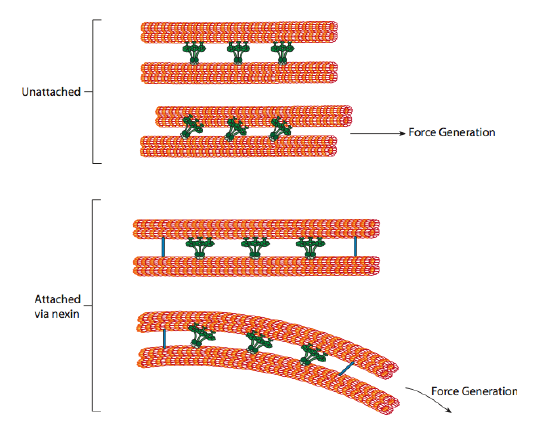
a ciliáris dyneinek biztosítják a motoros képességet, de az axonémában két másik összekötő fehérje is található. Vannak olyan nexinek, amelyek az egyik dublett A-tubulusához csatlakoznak a szomszédos dublett B-tubulusához, így összekötve a külső gyűrűt. Vannak olyan radiális küllők is, amelyek az egyes dublettek a tubulusától az axonéma magjában lévő mikrotubulusok központi párjáig terjednek. Egyikük sem rendelkezik motoros aktivitással. Ezek azonban döntő fontosságúak a csillók és a flagella mozgása szempontjából, mert segítenek a csúszó mozgás hajlító mozgássá alakításában. Amikor a ciliáris dynein (nagyon hasonló a citoplazmatikus dyneinekhez, de kettő helyett három feje van) be van kapcsolva, az egyik oldalon egy a mikrotubulust, a szomszédos dublettből egy B mikrotubulust köt össze, és az egyiket a másikhoz képest mozgatja. Ezeknek a dyneineknek a koncerten mozgó vonala így az egyik dublettet a másikhoz képest csúsztatná, ha (és ez egy nagy “ha”) a két dublett teljes mozgásszabadsággal rendelkezne. Mivel azonban a dubletteket összekapcsolják a nexin fehérjék, ami akkor történik, amikor egy dublett megpróbál csúszni, az az, hogy inkább a csatlakoztatott szerkezetet hajlítja meg (ábra \(\PageIndex{17}\)). Ez a kanyar okozza a csillók evezési mozgását, amelyek viszonylag rövidek, valamint a hosszú ostor mozgását, amelyek a hajlítási mozgást az axonémán keresztül terjesztik.
bár a ciliáris és a flagelláris mozgást a sejt meghajtásának módszereként gondoljuk, mint például a sperma flagelláris úszása a petesejt felé, számos fontos hely is van, ahol a sejt álló helyzetben van, és a csillókat a folyadék mozgatására használják a sejt mellett. Valójában a test legtöbb fő szervében vannak csillós sejtek. Számos ciliáris diszkinéziáról számoltak be, amelyek közül a legjelentősebb, primer ciliáris diszkinézia (PCD), amely magában foglalja a Kartagener szindrómát (KS), a DNAI1 gén mutációjának köszönhető, amely az axonemális (ciliáris) dynein alegységét (1.közbenső lánc) kódolja. A Pcd-t a visszatérő fertőzés miatti légzési distressz jellemzi, és a KS diagnózisát akkor állapítják meg, ha van situs inversus is, olyan állapot, amelyben a test normális bal-jobb aszimmetriája (pl. gyomor balra, máj jobbra) megfordul. Az első tünet a tüdőben lévő hámsejtek számos csillójának inaktivitása. Normál funkciójuk az, hogy folyamatosan mozgásban tartsák a nyálkahártyát a légzőpályán. Normális esetben a nyálka segít megőrizni a tüdőt nedvesen, hogy megkönnyítse a funkciót, de ha a nyálka stacionárius lesz, a baktériumok táptalajává válik, valamint irritálóvá és akadályává válik a megfelelő gázcserében.
a Situs inversus érdekes rendellenesség, mivel az embrionális fejlődésben jelentkezik, és csak a PCD-betegek 50% – át érinti, mert a károsodott ciliáris funkció a bal-jobb aszimmetria randomizálását okozza, nem pedig megfordítását. Nagyon egyszerűen fogalmazva, a korai embrionális fejlődés során a bal-jobb aszimmetria részben annak köszönhető, hogy a molekuláris jelek balra áramlanak az embrionális csomóponton keresztül. Ezt az áramlást a csillók összehangolt verése okozza, így amikor nem működnek, az áramlás megszakad és randomizáció következik be.
a PCD-betegek egyéb tünetei szintén rámutatnak a cilia és a flagella működésére a szervezetben. A férfi meddőség gyakori az immotilis Sperma miatt. Női meddőség, bár kevésbé gyakori, is előfordulhat, a petefészek és a petevezeték csillóinak diszfunkciója miatt, amelyek általában a tojást a petefészekből a méhbe mozgatják. Érdekes, hogy a hydrocephalus internus (az agy kamráinak túltöltése cerebrospinális folyadékkal, ami megnagyobbodást okoz, amely összenyomja a körülöttük lévő agyszövetet) a PCD-vel. Ez valószínűleg a kamrákat bélelő ependimális sejtekben lévő csillók diszfunkciójának tudható be, amelyek elősegítik a CSF keringését, de nyilvánvalóan nem teljesen szükségesek. Mivel úgy gondolják, hogy a CSF ömlesztett áramlását elsősorban a szisztolé/ diasztolé a vérnyomás változása az agyban, egyesek feltételezik, hogy a csillók elsősorban az ow-ban vehetnek részt az agy néhány szorosabb csatornáján keresztül.
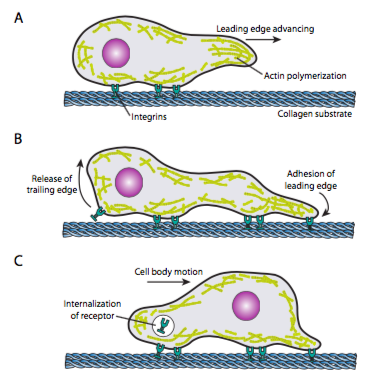
a Cellamászás (\(\PageIndex{19}\) ábra) megköveteli az elülső él mikrofilament hálózatának összehangolt átrendezését, kiterjesztve (mind polimerizációval, mind csúszó szálakkal), majd adhéziókat képezve az új előremenő ponton. Ez lehet filopodia vagy lamellipodia, gyakran mindkettő egyszerre. A Filopodia hosszú és nagyon vékony nyúlványok, párhuzamos mikrofilamentumok magkötegeivel és magas sejtfelszíni receptorok koncentrációjával. Céljuk elsősorban a környezet érzékelése. A Lamellipodia gyakran két lopodia között húzódik, és inkább széles fodros, mint egy ujj. Belsőleg az aktin inkább hálókká alakul, mint kötegekké, a szélesebb él pedig több tapadást tesz lehetővé a szubsztrátumhoz. A mikrofilament hálózat ezután ismét átrendeződik, ezúttal megnyitva egy helyet a citoplazmában, amely csatornaként szolgál a mikrotubulusok mozgásához a sejt eleje felé. Ez a közlekedési hálózatot hozza létre, hogy elősegítse az intracelluláris ömlesztett anyag előremozdítását. Amint ez megtörténik, a cella farokvégén lévő régi tapadások felszabadulnak. Ez a felszabadulás két elsődleges mechanizmuson keresztül történhet: a receptor endocitózisa vagy a receptor deaktiválása jelátviteli/konformációs változással. Természetesen ez a túlzott egyszerűsítés meghazudtolja az összes ilyen művelet koordinálásának és ellenőrzésének bonyolultságát a sejt irányított mozgásának elérése érdekében.
a mikroszálas erő generálásának egyik modellje, az elasztikus Brown-racsnis modell (Mogilner and Oster, 1996) azt javasolja, hogy a sejtmembrán folyamatos percenkénti hőingadozásból eredő Brown-mozgása miatt a membrán szélei felé kinyúló aktinszálak különböző mértékben hajlanak meg. Ha a flex elég nagy, egy új aktin monomer elfér a membrán és az izzószál csúcsa között, és amikor a már hosszabb izzószál visszahajlik, nagyobb nyomást gyakorolhat a membránra. Nyilvánvaló, hogy egyetlen szál nem generál nagy erőt, de sok szál összehangolt kiterjesztése előre tolhatja a membránt.
miután egy sejt jelet kap a mozgáshoz, a kezdeti citoszkeletális válasz az aktin polimerizálása, több mikrofilamentum felépítése az elülső élbe való beépítéshez. A jeltől függően (vonzó vagy visszataszító) a polimerizáció a sejt ugyanazon vagy ellentétes oldalán fordulhat elő a jel-receptor aktiválásának pontjától. Jelentős, hogy az új f-aktin polimerizációja önmagában elegendő erőt képes előállítani a membrán előre mozgatásához, még a miozin motorok bevonása nélkül is! Az erőgenerálás modelljeiről vitatkoznak, de általában azzal kezdődnek, hogy új g-aktint építenek be a csúcsán lévő izzószálba; vagyis az izzószál-membrán interfészen. Még akkor is, ha ez technikailag elég lenne, egy élő sejtben a myosinok részt vesznek, és segítenek a szálak irányának tolásában és elrendezésében az új élvonal felállítása érdekében. Ezenkívül néhány szálat és hálózatot gyorsan meg kell szakítani, és új kapcsolatokat kell létrehozni mind a szálak, mind a szálak és más fehérjék, például adhéziós molekulák vagy mikrotubulusok között.
hogyan szabályozható a polimerizáció és az aktin átrendeződés? A sejtek mozgását jelző receptorok némileg eltérő utakat indíthatnak el, de sokuknak van néhány közös vonása a kis Gtpázok Ras-családjának egy vagy több tagjának aktiválásában. Ezek a jelátviteli molekulák, mint például a Rac, Rho és cdc42 receptor tirozin-kinázokkal aktiválhatók (lásd RTK-Ras aktivációs utak, Chap. 14). Ezek mindegyikének kissé eltérő szerepe van a sejtek mozgékonyságában: a cdc42 aktiváció filopodia képződéshez vezet, a Rac aktiválja az arp2/3 és a cofilin lamellipodia képződését magában foglaló utat, és az Rho aktiválja a miozin II-t a fokális adhézió és a stresszrostképződés szabályozására. Egy másik típusú receptor kaszkád, a G-fehérje jelátviteli kaszkád (szintén 14.fejezet) a PLC aktiválódásához és a PIP2 későbbi hasításához, valamint a citoszol Ca2+növekedéséhez vezethet. Ezek a változások, amint azt korábban említettük, aktiválhatják a miozin II-t, valamint a gelsolin, a cofilin és a profilin átalakító enzimeket. Ez lebontja a meglévő aktinszerkezeteket, hogy a sejt folyékonyabbá váljon, miközben több g-aktint is hozzájárul az új élvonalbeli citoszkeleton kialakításához.
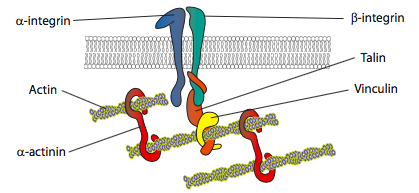
In vitro kísérletek azt mutatják, hogy a membrán előrehaladásával új ragasztóérintkezések jönnek létre adhéziós molekulák vagy receptorok révén, amelyek megkötik a szubsztrátot (gyakran sejttenyészet diák vagy edények vannak bevonva kollagén, filaminin, vagy más extracelluláris mátrixfehérjék). Az érintkezők ezután citoszkeletális elemeket toboroznak a nagyobb stabilitás érdekében, hogy fokális tapadást képezzenek (\(\pageindex{20}\) ábra). A fokális adhéziók kialakulása azonban sejttenyészetnek tűnik, és nem világos, hogy az in vivo kialakuló adhéziók típusai azonos típusú citoszkeletális komponenseket toboroznak-e.
a sejtmozgás harmadik lépése a sejttartalom tömeges mozgása. Ennek a fázisnak a mechanizmusai nem egyértelműek, de van némi bizonyíték arra, hogy a mikrotubulus citoszkeleton elülső szélén lévő aktin citoszkeleton és az elülső részek közötti kapcsolatok felhasználásával a mikrotubulusok átrendeződnek, hogy hatékony szállítási utat képezzenek az ömlesztett mozgáshoz. Ennek másik szempontja lehet az aktinhálózatok “corralling” hatása, amelyek irányosan teret nyitnak az él felé. A mikrotubulusok ezután könnyebben lépnek be ebbe a térbe, mint egy szoros aktinhálón keresztül dolgozva, kényszerítve az áramlást a megfelelő irányba.
a mikrotubulus-aktin kölcsönhatásokkal kapcsolatos munka nagy részét a neuronális növekedési kúp kutatásával végezték, amelyet néha pórázon lévő sejtnek neveznek, mert szinte függetlenül működik, mint egy mászó sejt, keresve a megfelelő utat, hogy axonját a sejttestből a megfelelő szinaptikus kapcsolathoz vezesse (A. W. Schaefer et al, Dev. 15. cella: 146-62, 2008).
végül a cellának vissza kell vonnia a régi tapadásokat a hátsó élre. Ez történhet számos különböző módon. In vitro megfigyelték, hogy a kúszó sejtek letépik magukat a szubsztrátumról, és a folyamat során apró membrándarabokat és kapcsolódó adhéziós fehérjéket hagynak maguk után. Feltételezzük, hogy a keletkező erő aktin-miozin stresszrostokból származik, amelyek az előrébb vezető fokális tapadásokból származnak. A sejtek számára azonban kevésbé destruktív mechanizmusok állnak rendelkezésre. Bizonyos esetekben az extracelluláris szubsztrát sejtreceptorának tapadása belsőleg szabályozható, talán egy receptor foszforilezésével vagy defoszforilezésével. Egy másik lehetőség a receptor endocitózisa, levéve a sejtfelszínről. Egyszerűen újrahasznosítható az élvonalig, ahol szükség van rá (azaz transzcitózis), vagy ha már nincs rá szükség vagy sérült, akkor lebontható egy lizoszómában.
