solusyklin estäjän käyttöönotto
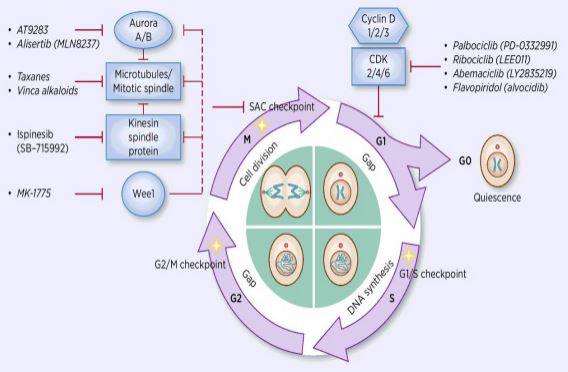
solusyklin säätelyprosessi on erilaisten säätelytekijöiden aktivoitumista tai inaktivoitumista tarkastuspisteiden valvonnassa, mikä käynnistää solun DNA: n replikaation ja jakautumisen kahteen tytärsoluun. Monista solusyklin säätelijöistä ytimessä on sykliiniriippuvainen kinaasi (CDK), ja se on Verkkojärjestelmä, joka säätelee solusykliä sykliini-ja sykliiniriippuvaisilla kinaasinestäjillä (CKIs). CDK: t ovat seriini-treoniinikinaasien luokka, ja nykyisin esiintyy 13 lajia, mukaan lukien CDK1~13, joilla on rooli cdks: n solusyklin säätelyssä ja cdks: n transkriptiosäätelyssä. Solusyklin säätely on itse asiassa tarkastuspisteiden säätelyä, G1/s-säätelypisteiden ollessa tärkein. Kun solusykliä stimuloidaan ulkoisilla signaaleilla, kuten kasvutekijöillä, katalyyttinen alayksikkö CDK4/CDK6 sitoutuu säätelevään alayksikköön Syklindiin ja CDKs-jäännökset aktivoituvat fosforylaation/defosforylaation avulla. CDKs: n aktivoitumisen jälkeen Rb-proteiini fosforyloidaan. RB-geeni, joka tunnetaan myös retinoblastoomageeninä, on ensimmäinen kloonattu kasvainsuppressorigeeni, ja sen kyky muodostaa kompleksi transkriptiotekijöiden (kuten E2F) kanssa proteiinin fosforylaation jälkeen menetetään. E2F: llä on tärkeä rooli solusyklin säätelyssä ja se indusoi Sykliinin ja CDK2: n ilmentymisen ja muodostaa sykliini/CDK2-kompleksin, joka edelleen fosforyloi RB-proteiinia ja vapauttaa täysin E2F: n. tämän jälkeen E2F siirtyy tumaan aktivoidakseen sarjan solusyklejä S-vaiheeseen. DNA: n replikaation loppuvaiheessa s-vaiheen aikana sykliini aktivoi CDK2: n, joka inaktivoi transkriptiotekijä E2F: n ajoissa estäen jatkuvasti aktivoituneen E2F: n aiheuttaman apoptoosin. tutkimustilastot osoittavat, että yli 90% ihmisen syövistä on mutaatioita CDK: n, Sykliinin, CKI: n ja Rb: n geeneissä.CDK ja sitä vastaava säätelevä alayksikkö sykliini ovat useimmin toimintahäiriöitä. Lisäksi solusyklin vaihtelut edistävät solunsalpaajaresistenssiä ja vähentävät solunsalpaajahoidon vaikutuksia. Siksi CDK/Sykliiniaktiivisuuden säätely, joka palauttaa normaalin solusyklin, on yksi kasvainten hoitostrategioista.
solusyklin estäjiä käytetään nyt kliinisesti
huumetutkijat ovat keskittyneet löytämään erityyppisiä CDK: n ja Sykliinin estäjiä huipputason syöpälääkkeinä. Tällä hetkellä CDK-inhibiittorit jaetaan pääasiassa endogeeniseen ja eksogeeniseen. Suurin endogeenisten pienimolekyylisten inhibiittoreiden luokka on pienimolekyyliset proteiinit, jotka luokitellaan kahteen laajaan luokkaan rakenteellisten toimintojen erojen mukaan, ja yhtä luokkaa kutsutaan kaksispesifiseksi ink4-perheeksi, mukaan lukien p15, p16, p18, p19, joka inhiboi proteiiniperhettä. Syklindiin liittyvän kinaasin inhibitorinen proteiini sitoutuu vastaavaan vapaaseen CDK4: ään, jolloin CDK4: n sitoutuminen vastaavaan syklindiin estyy muodostaen katalyyttisen dimeerikompleksin. Toista luokkaa kutsutaan Kip-perheeksi, johon kuuluvat P21,P27, P57. Tämä proteiiniperhe voi muodostaa trimeerin, jonka dimeerinen kompleksi koostuu sykliini E/CDK2: sta ja syklina/CDK1: stä, estämällä dimeerin katalyyttisesti aktiivisen keskuksen. Näiden endogeenisten inhibiittoreiden inhibitio yhdistettynä kinaasikompleksiin säätelee erityisesti sen toimintaa ja säätelee siten tarkasti solun muuntumista G1-vaiheesta s-vaiheeksi. Tutkimukset ovat osoittaneet, että esiintyminen ja kehittäminen useita kasvaimia liittyy vähentynyt ilmentyminen CDKs/sykliinit tai vähentynyt ilmentyminen endogeenisten estäjien, kuten poistaminen P16, joka on suhde kehittämiseen melanooman, keuhkosyöpä, rintasyöpä, ja paksusuolen syöpä. P27-proteiinin poisto on yleistä rintasyövässä, eturauhassyövässä, paksusuolen syövässä ja ruoansulatuskanavan syövässä. Siksi endogeenisen CDKs-estäjän tai geenimutaation poistaminen on tärkeä viite kasvaimen diagnosoinnissa. Endogeeniset pienimolekyylin estäjät ovat myös viime vuosina löydettyjen tärkeiden ei-koodaavien RNA: iden luokkaa. Kohdealueet sitoutuvat toisiinsa hajottamaan nopeasti ja tehokkaasti mRNA: ta tai estämään proteiinin translaatiota, kontrolloivat proteiinia alemmalla tai optimaalisella tasolla ja vaativat elintoimintoja. Yli 10 micrornaa on löydetty osallisina solusyklin säätelyssä. Niistä miR1-2-ja miR3-4-kohde CDK4, vastaavasti, ja solusykli pidätetään G1-vaiheessa, joka estää kasvainsolujen proliferaatiota; miR-22 kohdistuu CDK6-soluihin. Sykli on pysähtynyt G1-vaiheeseen, joka aiheuttaa vanhenemista rintasyöpäsoluissa. Eri biologisissa prosesseissa nämä mirnat säätelevät solusyklin etenemistä kohdistamalla siihen E2F, CDK, sykliini, P21, P27, DNA-polymeraasialfa jne. edistää tai estää solusyklin keskeisiä säätelijöitä. Eksogeenisia inhibiittoreita ovat antisensiteettiset nukleiinihapot, vasta-aineet, pienet häiritsevät RNA-interferenssit (siRNA) ja pienimolekyyliset yhdisteet. Pienimolekyyliset yhdisteet ovat tärkein eksogeenisten CDK-estäjien Luokka. Viime vuosina, kun kiderakenteen ymmärtäminen antaa ihmisille mahdollisuuden suorittaa molekyylisimulaatiotutkimuksia, on tehty läpimurtoja CDKs: n kemiallisten inhibiittorien erittäin tehokkaiden ja selektiivisten tutkimusten suunnittelussa ja kehittämisessä. Voidaan sanoa, että tällaisilla yhdisteillä on uusia jäseniä joka päivä. Tällä hetkellä pienimolekyyliset CDK-estäjät voidaan jakaa seuraaviin 13 luokkaan: Roscovitiini ja Olomouci, Pyrimidiinit (PD-033299), flavonoidit (Flavoriridolit), Tiatsolit (SNS03), antraseeni ja sen johdannaiset (SU951), piperidoni (Paullonit), imidatsopyridiini, pyratsolopyridiini (AZ703), pyratsiinit ( AT751), butyrolaktoni-1 (butyrolaktoni-1), skorpioniini (UCN-01) ja kaksi muuta lajia. Kolmetoista pienimolekyylistä estäjää on tullut kliinisiin kokeisiin. Ne ovat kaikki tasomaisiin heterosykleihin kuuluvia pienimolekyylisiä kemikaaleja, jotka kilpailevat ATP: n kanssa sitoutumisesta CDK-kinaasin ATP: n sitoutumiskohtaan. In vivo-kokeet osoittivat, että CYC202: lla on hyvä lääkeresistenssi ja hyvä suun fysiologinen aktiivisuus ja että sillä on ilmeisiä inhibitorisia vaikutuksia ihmisen paksusuolen syövän ja kohdun syöpäsolujen rokottamien alastomien hiirten kiinteisiin kasvaimiin. Faasin Ib tutkimuksissa 10 munasarjasyöpää sairastavaa potilasta käytti CYC: tä yli 20 kuukauden ajan, eikä kasvaimia tai vakavia hoitoon liittyviä sivuvaikutuksia esiintynyt, joista yhden potilaan kasvain on kutistunut yli 30%, ja joillakin yli vuoden hoitoa saaneilla potilailla tila on vakaa. Faasin II kliinisissä tutkimuksissa on havaittu, että CYC202: lla yksinään on hieman heikompi vaikutus ja se on tehokas yhdessä muiden kemoterapeuttisten lääkkeiden kanssa. Vaiheen II B kliiniset tutkimukset CYC202: sta yhdessä kapesitabiinin kanssa rintasyövän hoitoon yhdistettynä 2,2-difluoridioksisytidiiniin tai sisplatiiniin keuhkosyövän ja nenänielusyövän hoitoon ovat myös käynnissä. Pienimolekyylisen RNA-interferenssiteknologian kehitys ja soveltaminen ovat mahdollistaneet tiettyjen interventiokohdemolekyylien geeniekspression tutkimisen, ja monet tutkijat ovat alkaneet puuttua CDK/Sykliinin synteesiin geneettisellä tasolla. Limaet al. transfected CyclinE-targeting siRNA into Hep3B, HepG2, SNU449 (CyclinE overe expression) ja HuH7 (CyclinE overe expression) ja totesi, että CyclinE expression was reduced by 90% in cells. DNA-synteesi vähenee merkittävästi, ja solut käyvät läpi apoptoosin. Galimberti ym. transfected siRNA targeting CyclinE, CDK2, ja CDK1 osaksi hiiren keuhkosyöpäsolujen HOP-62, H-522 ja h-23, vastaavasti, ja totesi, että sykliini/CDK2 voi indusoida apoptoosin ja estää leviämisen keuhkosyöpäsolujen. Cdk1: n siRNA-interferenssin aiheuttama cdk1-ilmentymän väheneminen aiheuttaa vain solufaasin pysähtymistä ja hidastaa solujen proliferaatiota, kun taas CDK1: n ja CDK2: n siRNA-yhteisinterventio johtaa cdk1: n ja CDK2: n ekspression samanaikaiseen vähenemiseen aiheuttaen resistenssiä solusyklin S-ja G2/M-vaiheissa. Pysähtyminen aiheutti myös solujen apoptoosin. Cao Yinfang ja muu onnistunut cdk2/sykliini siRNA-rekombinanttiekspressiovektorin siirto HepG2-soluihin osoittivat, että CDK2-ja sykliini-mRNA-ekspressio väheni merkittävästi, solusykli pysähtyi s-vaiheessa, G1-vaiheen solut lisääntyivät merkittävästi, kaspaasi-3-aktiivisuus lisääntyi, HepG2-solut saivat apoptoosin ja solusyklin muutokset olivat yhdenmukaisia HepG2-solujen vähentyneen proliferaation kanssa transfektion jälkeen.
solusyklin estäjän toiminta
solusyklin säätelyn tärkeästä roolista kasvainmuodostuksessa ja apoptoosissa solusyklin säätelyä on tutkittu lisää kasvaimen solunsalpaajaresistenssissä. Sykliiniriippuvaiset kinaasit (Cdks), joilla on rooli solumoottorin ajamisessa solusyklin aikana, ovat ihanteellisia kohteita tuumorihoidolle. Useimmilla syöpäsoluilla on aktivaatio, solunjakautumissyklin (cdk) yliekspressio ja cdkis: n toiminnan vikoja. CDK-estäjällä on katkovaikutus, joka estää solusykliä. Viime vuosina CDK: sta on tullut merkittävä syöpähoidon kohokohta, joka estää CDK: n toimintaa solusyklissä. Useat kliiniset tutkimukset ovat myös osoittaneet, että yhdellä hakemuksella voi olla kohtalaisia vaikutuksia. Kuitenkin yhdessä perinteisten sytotoksisten kemoterapeuttisten lääkkeiden kanssa CDKIs voi merkittävästi parantaa perinteisten kemoterapeuttisten lääkkeiden kasvainvastaista vaikutusta. Siksi CDKIs-lääkkeiden ja muiden solunsalpaajalääkkeiden syöpävaikutusten tutkimuksesta on tullut kuuma piste kasvainresistenssin nykyisessä hoidossa.
viite
- Bendris N, Lemmers B, Blanchard J M. Cell cycle, cytoskeleton dynamics and beyond: the many functions of cyclins and CDK inhibitors. Solusykli. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt S G, et al. Targeting nuclear kinases in cancer: development of cell cycle kinase inhibitors. Farmakologia & Therapeutics. 2014, 142(2):258-269.
- Stone A, Sutherland R L, Musgrove E A. Inhibitors of cell cycle kinases: recent advances and future prospects as cancer therapeutics. Crit Rev Oncog. 2012, 17(2):175-198.
- Xu W, Mcarthur G. solusyklin säätely ja melanooma. Onkologian Raportit. 2016, 18(6):34.
- Malumbres M, Barbacid M. Cell cycle, CDKs and cancer: a changing paradigm. Nature Arvioi Syöpää. 2009, 9(3):153-166.
