Lyhyt kuvaus kahdentyyppisestä ohjelmoidusta solukuolemasta: apoptoosi ja autofagia
apoptoosi eli tyypin I ohjelmoitu solukuolema on tutkituin solukuoleman muodoista. Sen morfologiset ominaisuudet voidaan tunnistaa valomikroskopiassa, ja niihin kuuluvat solujen kutistuminen, kromatiinin tiivistyminen, sytoplasmakalvoston blebbaus ja lopuksi apoptoottisten kappaleiden muodostuminen (Kuva 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
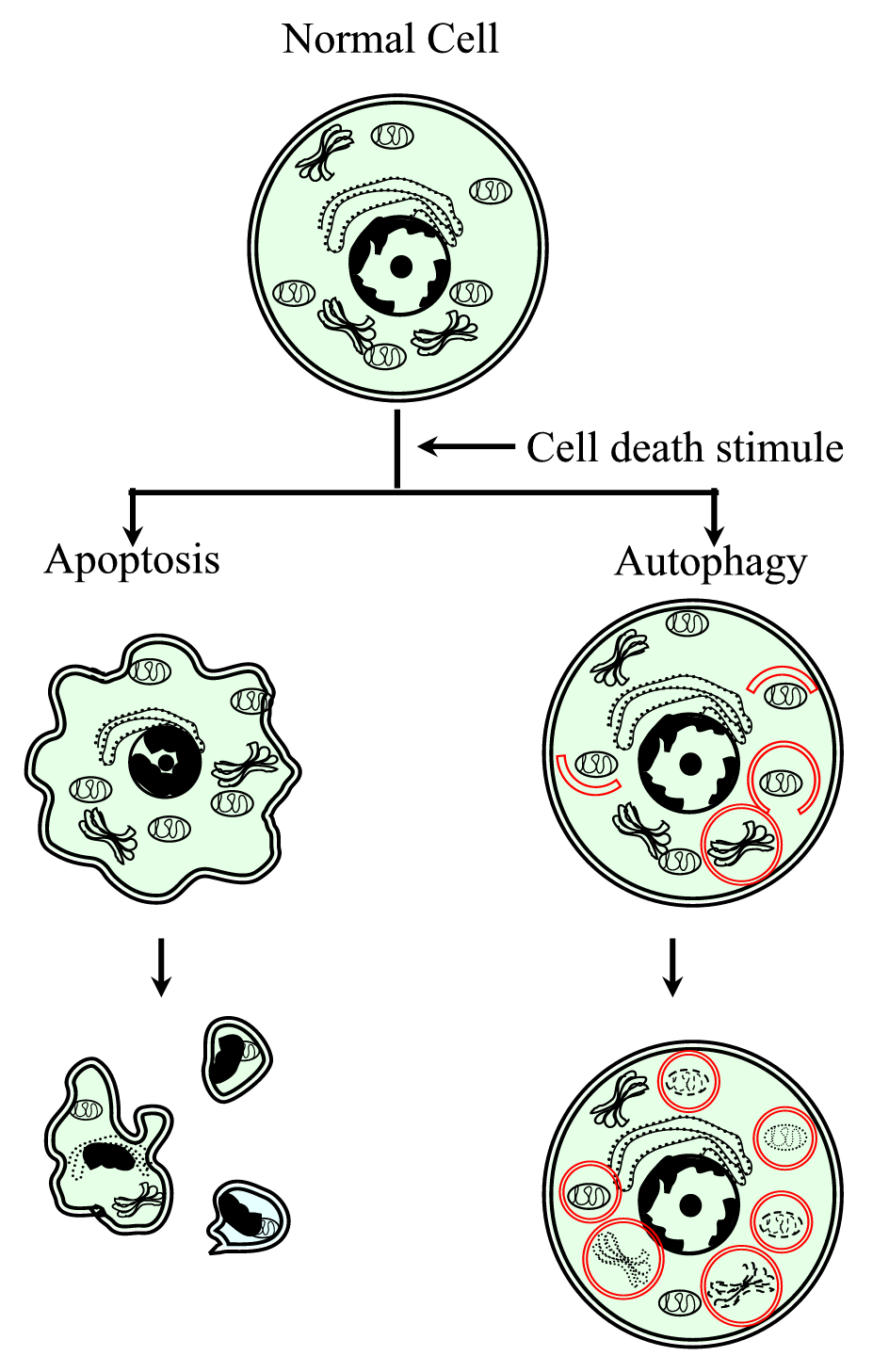
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceKaavamainen esitys ohjelmoidusta solukuolemaprosessista tyyppi I (apoptoosi) ja tyyppi II (autophagy). Apoptoosille on ominaista solujen supistuminen, kromatiinin tiivistyminen, kalvomainen blebs ja apoptoottisten kappaleiden muodostuminen. Autofagialle on tyypillistä, että siellä on suuri määrä autofagosomeja, joilla on sytoplasmapitoisuus. Kumpikaan solukuolema ei synnytä tulehdusreaktiota, sillä sytoplasmakalvosto säilyy, kunnes solujätteet ovat hävinneet naapuruston tai erikoistuneiden toimesta.
Kaspaasit ovat kysteinyyli-aspartaattispesifisiä proteaaseja, jotka syntetoituvat inaktiivisessa muodossa tsymogeeneiksi eli pro-kaspaaseiksi (kuva 2). Tämä inaktiivinen muoto mahdollistaa solukuoleman kontrolloidun suorittamisen. Kaspaasit tunnistettiin ensin sukkulamadosta Ceanorhabditis elegans, mutta homologisia muotoja esiintyy nisäkkäillä .
apoptoosin tunnusmerkit, kuten DNA: n pirstoutuminen ja tiivistynyt kromatiini, johtuvat kaspaasiaktiivisuudesta. Apoptoosin aikana DNA pirstoutuu nukleosomin kokoiseksi (200 bp) . Apoptoosin aikana DNA: n pirstoutumisesta vastaa spesifinen DNaasi (CAD, kaspaasiaktivoitu DNaasi), jota aktiivinen kaspaasi-3 Aktivoi . Aktiivinen kaspaasi-3 puolestaan on mukana morfologisissa solumuutoksissa apoptoosin aikana, jossa se pilkkoo rho: hon liittyvän kinaasi-1: n (ROCK-1) aktivoidakseen sen ja tämä vaikuttaa lopulta sytoskeletaaliseen järjestelyyn, joka aiheuttaa apoptoottisen kutistumismorfologian .

kuva 2.
xmlns: xlink= ”http://www.w3.org/1999/xlink ” xmlns:mml=”http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceapoptoottiseen prosessiin osallistuvat Kaspaasit syntetoituvat inaktiivisessa muodossa tsymogeeneiksi, jotka muodostuvat pro-domeenista, suuresta alayksiköstä ja pienestä alayksiköstä. Tsymogeenit aktivoituvat muodostaen tetrameerejä.
Apoptoottista solukuolemaa säätelevät suuresti B-solulymfooma 2 (Bcl-2) – perheen jäsenet . BCL-2-suvun jäsenet on luokiteltu anti-apoptoottisiksi ja pro-apoptoottisiksi proteiineiksi BCL-2-homologiansa (BH) ja domeeniorganisaationsa (kuva 3) mukaan. Verkkotunnusten BH1, BH2, BH3 ja BH4 läsnäolo vastaa ryhmää, joka estää apoptoosin. Pro-apoptoottinen ryhmä, sitä vastoin, on jaettu kahteen ryhmään: ne, joilla verkkotunnuksia BH1, BH2, ja BH3, ja ne, joilla on vain BH3 verkkotunnuksia (määritelty BH3 vain; KATSO tarkastelu ). Tämä proteiiniperhe suorittaa tehtävänsä solunsisäisellä tasolla mitokondrioiden sisällä, joka on keskeinen osa apoptoosia.

kuva 3.
xmlns: xlink=”http://www.w3.org/1999/xlink ” xmlns: mml=”http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceB-solulymfooma 2 (Bcl-2) – perheen proteiineja. A) BCL-2-proteiinien rakenteen yleinen kaavamaisuus. B) anti-apoptoottinen jäsenet – heillä on kaikki neljä BH verkkotunnuksia. C) pro-apoptotic jäsenet, jotka puolestaan jaetaan kahteen ryhmään: multidomain ja BH3 vain.
apoptoosi voidaan aloittaa kahdella hyvin kuvatulla reitillä: ulkoisilla ja sisäisillä reiteillä (Kuva 4). Ulkopuolinen aktivointi suoritetaan osallistumalla kuoleman ligandit (kuten tuumorinekroositekijä – TNF – superfamily, ja TNF liittyvät apoptoosin aiheuttama ligandit, tai TRAIL) niiden kognaatti solun pinnan kuoleman reseptorit (kuten TNF reseptori 1, Fas, TRAIL reseptori 1, tai TRAIL reseptori 2) (tarkasteltu ). Kun ligandi tunnistaa reseptorinsa ja sitoutuu siihen, muodostuu solunsisäisiä komplekseja, jotka aktivoivat käynnistäjän kaspaasit (kuten -8 ja -10), jotka sitten aktivoivat teloittajan kaspaasit (kuten -3, -6 ja -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. Ligandireseptorin vuorovaikutus indusoi kuolemaa indusoivan signalointikompleksin (DISC) kokoonpanon edistämään kaspaasi-8: n aktivaatiota, joka puolestaan pystyy aktivoitumaan toimeenpanijaan kaspaasi -3, -6 tai -7, johtaen apoptoosin morfologisiin muutoksiin. Sisäistä reittiä ohjaa mitokondrion ulomman kalvon permeabilisaatio, joka mahdollistaa proapoptoottisten alkuaineiden vapautumisen sytokromi-C: nä.sytokromi-C indusoi apoptoosin proteaaseja aktivoivan tekijän 1 (Apaf-1), joka edistää kaspaasi-9: n aktivoitumista apoptosomin kokoamiseksi. Apoptosomi pystyy aktivoitumaan suorittaja kaspaseille.
luontainen apoptoottinen reitti sen sijaan voi aktivoitua erilaisilla ärsykkeillä, kuten DNA-vaurioilla, kasvutekijän nälkiintymisellä ja oksidatiivisella stressillä . Altistuksen aikana solujen näille ärsykkeille, mitokondriot vaikuttavat, koska useat jäsenet Bcl-2 Perhe aktivoidaan ja edistää mitokondrioiden ulompi kalvo permeabilization (momp). Läpäisemätön ulkoinen mitokondrioiden kalvo mahdollistaa sytokromi c: n (cyt c) vapautumisen, joka liittyy Apaf-1-proteiiniin. Tämän jälkeen cyt c: n ja Apaf-1: n unioni sitoutuu initiaattoriin kaspaasi-9: ään muodostaen kompleksin, joka muodostaa apoptosomin, jolla on kyky aktivoida initiaattorikaspaasit, jotka suorittavat tehtävänsä pilkkomalla tiettyjä solusalustoja.
solukuoleman toinen prosessi, autofagia, on geneettisesti ohjelmoitu ja evolutionaarisesti säilyvä prosessi, joka saa aikaan vanhentuneiden organellien ja proteiinien hajoamisen. Se aktivoituu sellaisilla solunulkoisilla ärsykkeillä kuin ravinteiden nälkään, hypoksiaan, korkeaan lämpötilaan ja muuttuneisiin solunsisäisiin olosuhteisiin, mukaan lukien vaurioituneiden tai tarpeettomien organellien kertyminen (tarkistettu ).
eukaryoottisilla eliöillä on kuvattu kolme autofagiatyyppiä: mikroautofagia, makroautofagia (yleisesti kutsutaan yksinkertaisesti autofagiaksi) ja kaferonivälitteinen autofagia (kuva 5). Mikroautofagiassa sytoplasmakomponentit nielaistaan suoraan lysosomin tasolla invaginaatioprosessin avulla, kun taas makroautofagiassa muodostuu solukomponentteja sisältäviä kaksoiskalvorakkuloita, jotka fuusioituvat lysosomien kanssa muodostaen autofagolysosomin. Autofagolysosomin sisällä vesikulaariset komponentit hajoavat ja, jos mahdollista, solu kierrättää ne (tarkistetaan). Valvojavälitteinen autofagia merkitsee lopuksi valvojien osallistumista lysosomien eliminoitaviksi määrittämien proteiinien tunnistamiseen .

kuva 5.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:MML=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instancekaavamaisia esityksiä autofagian eri mekanismeista. Makroautofagia eli autofagia tarkoittaa kaksikalvoisen vesikkelin muodostumista, joka nielaisee sytoplasmapitoisuuden, joka johdetaan hajoavaan lysosomiin. Mikroautofagialle on tyypillistä, että lysosomi nielaisee suoraan sytoplasmakomponentteja. Tämä prosessi liittyy remodeling kalvon organelle muodostamalla lysosomaalinen kalvo invagination. Esiliinavälitteisen autofagian aikana hajoavat proteiinit kohdistetaan Hsp70: een, joka puolestaan kuljettaa kohdelastin lysosomiin.
Autofagiaa ohjaavat Atg(Autofagiaan liittyvät) geenit, joita tarvitaan aktivoimaan autofagosomien muodostumisen laukaiseva signalointikompleksi . Atggenes löydettiin hiivasta, mutta monilla on ortologioita korkeammissa eukaryooteissa (kuva 6). Autofagosomin muodostumiseen liittyy sytoplasmaproteiini LC3 (Atg8), joka lipidoituu fosfatidyylietanoliamiinin vaikutuksesta ja siirtyy orastavaan autofagosomin kalvoon (Kuva 7). Lipidoidun LC3-proteiinin (tunnetaan nimellä LC3-II) kertymistä käytetään autofagian merkkiaineena .

kuva 6.
xmlns: xlink=”http://www.w3.org/1999/xlink ” xmlns: mml=”http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. Fosfatidyylietanoliamiini lipidoi LC3-proteiinia.
Autofagiselle solukuolemalle eli tyypin II ohjelmoidulle solukuolemalle on tyypillistä, että autofagiset vesikkelit nielaisevat sytoplasman massiivisesti. Tämä voimakas autofaginen aktiivisuus eroaa huomattavasti autofagiasta, jota esiintyy jatkuvasti perusasteilla. Ultrasystructural tutkimukset Drosophila ovat paljastaneet kertyminen autophagic vakuolit useimmissa toukkakudosten. Tämäntyyppinen ohjelmoitu solukuolema alkaa hajoamista sytoplasmisten organelles autophagy, vaikka sytoskeletaaliset elementit säilyvät kunnes loppuvaiheessa prosessin (tarkistetaan ).
