yhdenmukaisen terminologian käyttö tutkimusten sisällä ja välillä on ratkaisevan tärkeää tehokkaan kokeiluprosessin mahdollistamiseksi. CDISC-standardit, kuten CDASH, SDTM, SEND ja ADaM, standardoivat rakenteita kerättäessä ja lähetettäessä tietoja, mutta entä itse data-arvot?
tämä viesti antaa yleiskuvan CDISC: n standardoidusta kontrolloidusta terminologiasta ja siitä, miten sitä tulisi käyttää tietojen keräämiseen ja lähettämiseen tavalla, joka nopeuttaa kokeita ja mahdollistaa ristiintutkimusanalyysin.
Jos olet kiinnostunut lukemaan lisää CDISC-standardeista, voit lukea blogeistamme kaiken, mitä sinun tarvitsee tietää SDTM: stä ja CDISC-standardien esittelystä.
CDISC partner with NCI to define standardised terminology
CDISC has partnered with the National Cancer Institute (NCI) to help brought consistency to terminology in clinical trials. Yhteistyön avulla on määritelty standardisoitu terminologia, jota päivitetään neljännesvuosittain, mikä tuo semanttista johdonmukaisuutta eri tutkimuksiin. Tätä terminologiaa käyttäen sama tieto esitetään samalla tavalla kaikissa tutkimuksissa.
otetaan yksinkertainen esimerkki – sukupuoli:
- pitäisikö Miestä edustaa ”mies”, ”mies”, ”M” vai ”1”?
- miten intersukupuolinen pitäisi kirjata?
menneinä päivinä nämä tiedot on saatettu kerätä eri tavoin kustakin tutkimuksesta. CDISC NCI: n Terminologiastandardi määrittelee nyt, että ainoat sallitut vaihtoehdot ovat ”F”, ”M”, ”U” ja ”differentiated”, ja että intersukupuolinen henkilö kirjataan ”differentiated”. Voit nähdä, miten tämä hyvin yksinkertainen esimerkki helpottaa jo paljon taustatietojen ymmärtämistä ja helposti eri populaatioiden segmentointia eri tutkimuksissa.
![]() Note
Note
FDA: n datastandardiluettelo velvoittaa nyt käyttämään standardoitua NCI-terminologiaa kaikille uusille tutkimuksille. Tämä tekee arvostelijan elämästä paljon helpompaa, koska he osaavat tulkita tietoja.

miten CDISC NCI-terminologia määritellään?
alla olevasta taulukosta käy ilmi, miten standardisoitu Sukupuoliterminologia määritellään.
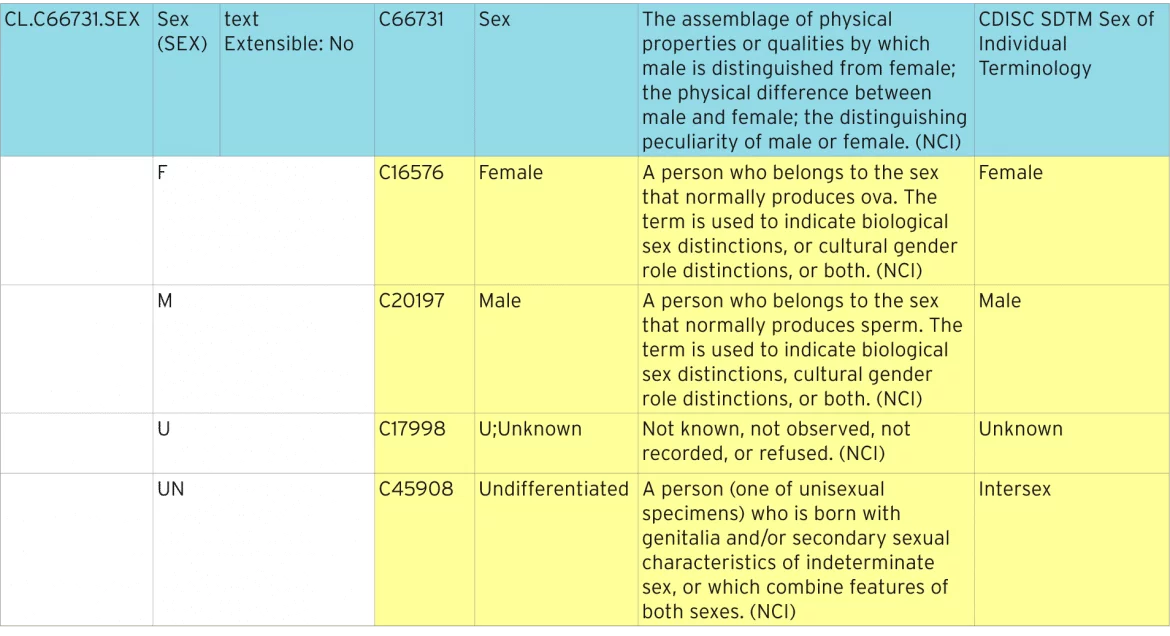
standardisoidun terminologian yksilöiminen
sininen viiva edustaa koodiluetteloa, joka sisältää kaikki yksittäiset koodit. Koodiluettelon vakio ”C-koodi ”on”C66731”. Jokaisella yksittäisellä koodilla on oma C-koodinsa, esimerkiksi ”C16576”. Näitä C-koodeja käytetään ODM-ja Define-XML-metatiedoissa tunnistamaan koodiluettelot NCI-standardin mukaisiksi terminologioiksi.
laajennettavuus
tämä koodiluettelo on määritelty ei-laajennettavissa olevaksi, mikä tarkoittaa, että missä tahansa koodiluetteloa käytetään, se ei saa sisältää termejä, joita ei ole lueteltu tässä. Laajennettavissa oleviin koodiluetteloihin voidaan lisätä lisäehtoja. Nämä lisäehdot on kuvattava Define-XML: ssä laajennettuina termeinä, eikä niitä voida toistaa tai synonyymeinä olemassa oleville termeille.
Lähetysarvo, synonyymit ja ensisijainen termi
lähetysarvo on se, mikä on toimitettava sääntelyviranomaiselle. Lomakkeessa todellisuudessa näkyvä arvo voi olla erilainen, ja ehkä jokin synonyymeistä tai ensisijainen termi.
saatavilla monissa väreissä
NCI: n Terminologiastandardit ovat saatavilla useissa eri muodoissa eri tarpeisiin, kuten Excelissä, ODM: ssä, HTML: ssä ja RDF: ssä. Yllä oleva esimerkki on otettu Excel-versiosta.
ryhmiteltynä cdashin, SDTM: n, Adamin ja muiden osajoukkojen alle
mukavuussyistä NCI-terminologia on ryhmitelty useiksi osajoukoiksi.
- SDTM-terminologia sisältää termejä käytettäväksi SDTM-pohjaisessa lähetyksessä
- CDASH-terminologia sisältää termejä käytettäväksi CDASH-pohjaisessa tiedonkeruussa
- ADaM-terminologia sisältää termejä käytettäväksi ADaM-aineistoissa
- SEND-terminologia sisältää termejä käytettäväksi LÄHETYSPOHJAISESSA lähetyksessä
- Protokollasanasto sisältää termejä käytettäväksi protokollan Edustusmallissa (PRM) ja kliinisten tutkimusten rekisterissä XML (CTR-XML)
käyttämällä CDISC NCI-terminologiaa tutkimuksessa
määriteltäessä submission metadataa define-XML: ssä käytetään koodiluetteloita määriteltäessä kiinteitä luetteloita tiettyjen muuttujien arvoista. Nykyisen FDA-asetuksen mukaisesti näiden koodiluetteloiden on oltava standardoidun CDISC NCI-terminologian mukaisia, jos tällaista terminologiaa on olemassa. Ne liittyvät standardisoituun terminologiaan lisäämällä peitenimiä C-koodeihin, esim.:
<Alias Name="C66731" Context="nci:ExtCodeID"/>
määriteltäessä tiedonkeruun metatietoja ODM: ssä ei tarvitse käyttää standardisoitua terminologiaa, mutta tämä poistaa tarpeen kartoittaa termejä kerätyt tiedot lähettämiisi tietoihin. Tämä yksinkertaistaa huomattavasti end-to-end-tutkimusprosessia ja lisää tutkimusten välistä johdonmukaisuutta.
päivitysten hallinta
terminologiapäivitysten hallinta voi olla huomattavan työlästä, varsinkin kun standardeja päivitetään niin säännöllisesti. Mistä tietää, mihin tutkimuksiin tai organisaation standardeihin Uusi terminologia voi vaikuttaa? Miten sitten teet tarvittavat päivitykset tehokkaasti ja luotettavasti?
helpoin tapa hallita tätä on CDISC-aware metadata repository, jonka avulla voit määritellä standardisoidun terminologian pohjalta rakennetut organisaatiostandardit ja rakentaa opintosi näiden standardien pohjalta. Koska arkisto ymmärtää kaikkien standardien ja opintojesi väliset suhteet, se voi yksinkertaistaa päivitysprosessia CDISC NCI-Terminologiastandardien uusiin versioihin.
