oppimistavoitteet
- kuvaavat aminohapon perusrakennetta
- kuvaavat proteiinien kemiallisia rakenteita
- tiivistää proteiinien ainutlaatuiset ominaisuudet
tämän luvun alussa kuvattiin kuuluisa koe, jossa tutkijat syntetisoivat aminohappoja olosuhteissa, jotka jäljittelivät maapallolla jo kauan ennen tuntemamme elämän kehitystä. Nämä yhdisteet pystyvät sitoutumaan toisiinsa olennaisesti mikä tahansa määrä, jolloin saadaan lähes minkä kokoisia molekyylejä, joilla on laaja valikoima Fysikaalisia ja kemiallisia ominaisuuksia ja jotka suorittavat lukuisia elintärkeitä toimintoja kaikille eliöille. Aminohapoista johdetut molekyylit voivat toimia solujen ja subsellulaaristen kokonaisuuksien rakenneosina, ravintoaineiden lähteinä, atomi-ja energiavarastoina sekä funktionaalisina lajeina, kuten hormoneina, entsyymeinä, reseptoreina ja kuljetusmolekyyleinä.
aminohapot ja peptidisidokset

kuva 1.
aminohappo on orgaaninen molekyyli, jossa vetyatomi, karboksyyliryhmä (–COOH) ja aminoryhmä (–NH2) ovat kaikki sitoutuneet samaan hiiliatomiin, niin sanottuun α-hiileen. Neljäs α-hiileen sitoutunut ryhmä vaihtelee eri aminohappojen välillä ja sitä kutsutaan jäännökseksi tai sivuketjuksi, jota edustaa rakennekaavoissa kirjain R. A-jäännös on monomeeri, joka syntyy kahden tai useamman aminohapon yhdistyessä ja irrottaessa vesimolekyylejä. Proteiinin ensisijainen rakenne, peptidiketju, koostuu aminohappojäännöksistä. Funktionaalisten ryhmien ja R-ryhmien ainutlaatuiset ominaisuudet mahdollistavat sen, että nämä aminohappojen komponentit muodostavat vety -, ioni-ja disulfidisidoksia sekä polaarisia/ei-polaarisia vuorovaikutuksia, joita tarvitaan sekundääristen, tertiääristen ja kvaternaaristen proteiinirakenteiden muodostamiseen. Nämä ryhmät koostuvat pääasiassa hiilestä, vedystä, hapesta, typestä ja rikistä hiilivetyjen, happojen, amidien, alkoholien ja amiinien muodossa. Kuviossa 1 on muutamia esimerkkejä, jotka havainnollistavat näitä mahdollisuuksia.
aminohapot voivat sitoutua kemiallisesti yhteen yhden molekyylin karboksyylihapporyhmän ja toisen molekyylin amiiniryhmän reaktiolla. Tämä reaktio muodostaa peptidisidoksen ja vesimolekyylin ja on toinen esimerkki dehydraatiosynteesistä (kuva 2). Molekyylejä, jotka ovat muodostuneet yhdistämällä kemiallisesti suhteellisen pieniä määriä aminohappoja (noin 50 tai vähemmän), kutsutaan peptideiksi, ja etuliitteitä käytetään usein näiden lukujen määrittelemiseksi: dipeptidit (kaksi aminohappoa), tripeptidit (kolme aminohappoa) ja niin edelleen. Yleisemmin nimetään aminohappojen likimääräinen lukumäärä: oligopeptidejä muodostuu liittämällä yhteen jopa noin 20 aminohappoa, kun taas polypeptidejä syntetisoidaan jopa noin 50 aminohaposta. Kun yhteen liittyneiden aminohappojen määrä kasvaa hyvin suureksi tai kun rakennuksen alayksikköinä käytetään useita polypeptidejä, tuloksena syntyviä makromolekyylejä kutsutaan proteiineiksi. Näiden biopolymeerien jatkuvasti muuttuva pituus (monomeerien määrä) sekä kunkin aminohapon mahdollisten R-ryhmien moninaisuus mahdollistavat muodostuvien proteiinien lähes rajattoman monimuotoisuuden.

kuva 2. Peptidisidoksen muodostuminen on dehydraatiosynteesireaktio. Ensimmäisen aminohapon (alaniini) karboksyyliryhmä liittyy tulevan toisen aminohapon (alaniini) aminoryhmään. Prosessissa vapautuu vesimolekyyli.
ajattele sitä
- kuinka monta aminohappoa polypeptideissä on?
proteiinirakenne
proteiinin koko (pituus) ja spesifinen aminohappojärjestys ovat tärkeitä määrittäviä tekijöitä sen muotoon, ja proteiinin muoto on kriittinen sen toiminnan kannalta. Esimerkiksi biologisen typensidonnan prosessissa (KS.Biogeokemialliset syklit) maaperän mikro-organismit, joita kutsutaan rhizobiaksi, ovat symbioottisesti vuorovaikutuksessa palkokasvien, kuten soijapapujen, maapähkinöiden tai papujen, juurien kanssa muodostaen uuden rakenteen, jota kutsutaan kyhmyksi kasvien juurissa. Tämän jälkeen kasvi tuottaa leghemoglobiini-nimistä kantajaproteiinia, joka kuljettaa typpeä tai happea. Leghemoglobiini sitoutuu erittäin suurella affiniteetilla substraattiinsa Happeen tietyllä proteiinin alueella, jossa muoto ja aminohappojärjestys ovat sopivat (aktiivinen kohta). Jos aktiivisen kohdan muoto tai kemiallinen ympäristö muuttuu, edes vähän, substraatti ei välttämättä pysty sitoutumaan yhtä voimakkaasti tai se ei välttämättä sitoudu lainkaan. Jotta proteiini olisi täysin aktiivinen, sen on siis oltava tehtäväänsä sopiva muoto.
proteiinin rakenne luokitellaan neljään tasoon: primääriseen, sekundääriseen, tertiääriseen ja kvaternääriseen. Primaarirakenne on yksinkertaisesti polypeptidiketjun muodostavien aminohappojen järjestys. Kuvassa 3 esitetään proteiinin perusrakenne.
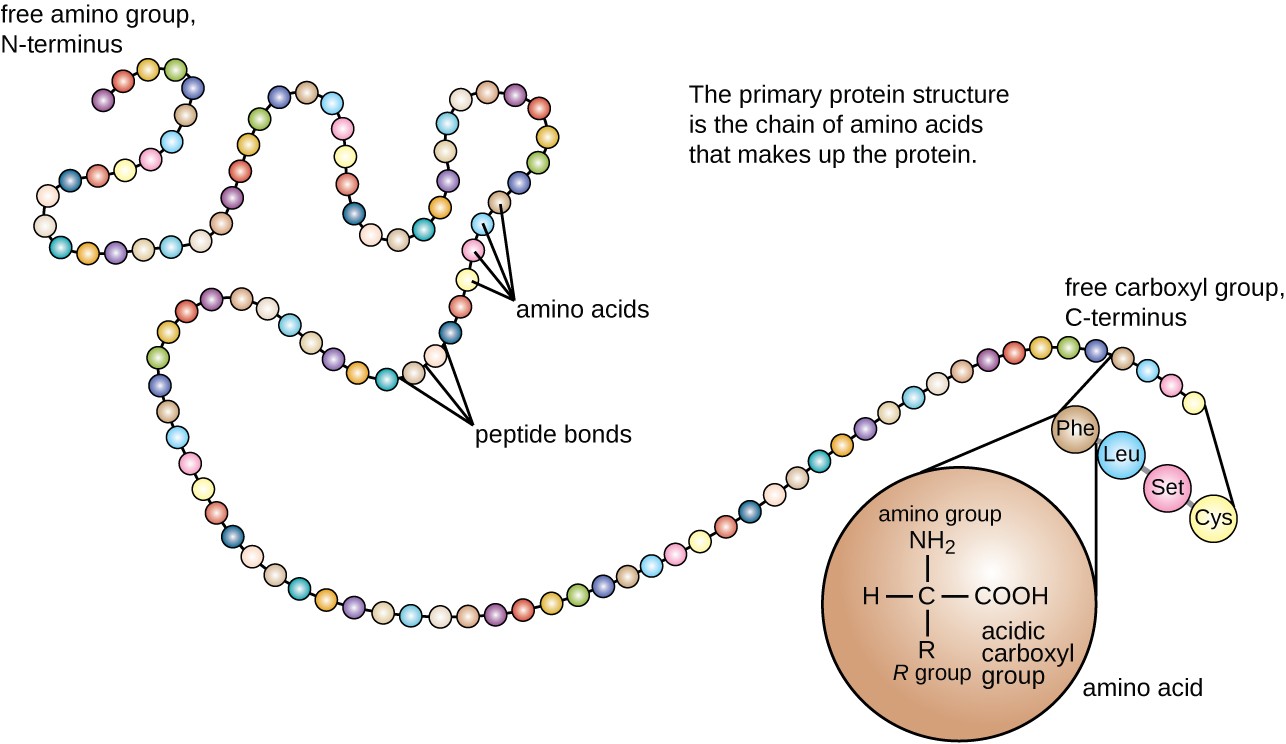
kuva 3. Klikkaa nähdäksesi suuremman kuvan. Proteiinin ensisijainen rakenne on aminohappojen järjestys. (credit: modification of work by National Human Genome Research Institute)
proteiinin perusrakenteen määrittelevä aminohappoketju ei ole jäykkä, vaan sen sijaan joustava aminohappoja koossa pitävien sidosten luonteen vuoksi. Kun ketju on riittävän pitkä, peptidirungon sisällä olevien amiini-ja karbonyylifunktionaalisten ryhmien välillä (R-sivuryhmää lukuun ottamatta) voi tapahtua vetysidoksia, jolloin polypeptidiketju lokalisoituu kierteiksi ja levyiksi. Nämä muodot muodostavat proteiinin sekundaarirakenteen. Yleisimmät sekundaarirakenteet ovat α-helix ja β-laskostettu levy. Α-helix-rakenteessa heliksiä pidetään vetysidoksilla yhden aminohapon karbonyyliryhmässä olevan happiatomin ja vain neljä aminohappoyksikköä kauempana ketjussa olevan aminoryhmän vetyatomin välillä. Β-laskostetussa levyssä laskokset muodostuvat samanlaisista vetysidoksista karbonyyli-ja aminoryhmien jatkuvien jaksojen välillä, jotka erotetaan edelleen polypeptidiketjun selkärangassa (Kuva 4).

kuva 4. Proteiinin sekundaarirakenne voi olla α-kierteinen tai β-laskostettu levy tai molemmat.
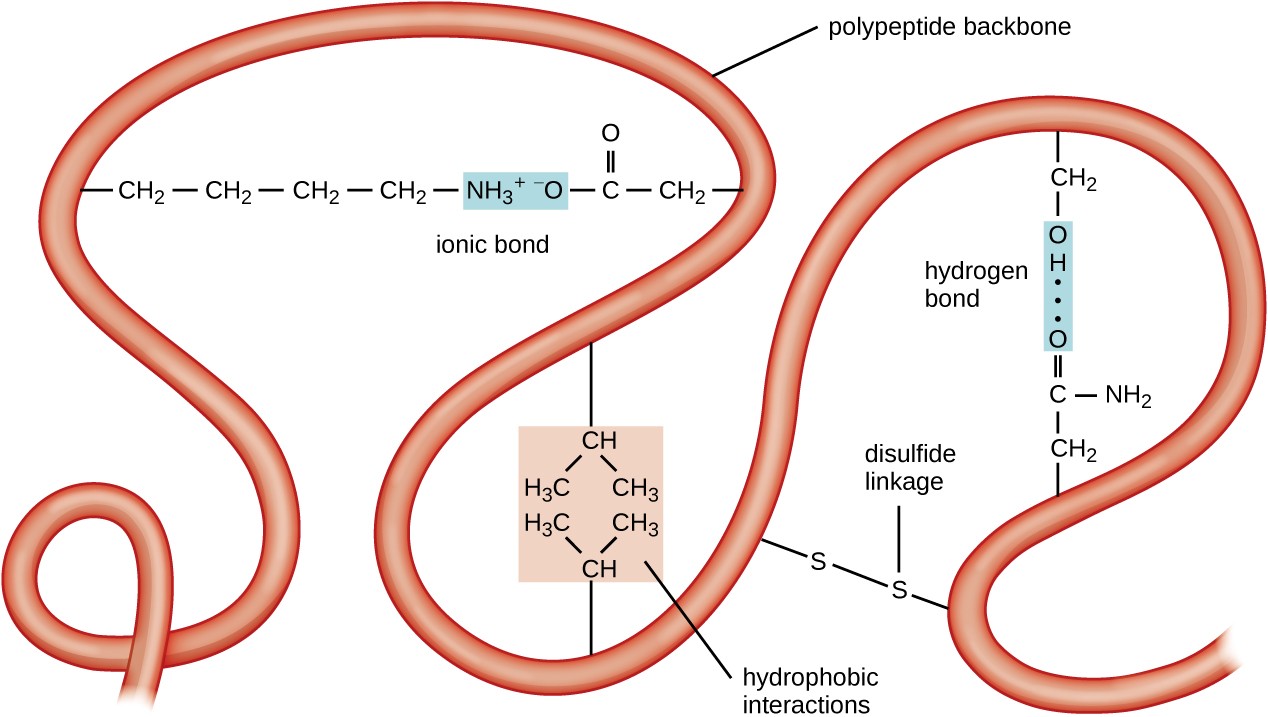
kuva 5. Klikkaa nähdäksesi suuremman kuvan. Proteiinien tertiäärirakenteen määräävät erilaiset vetovoimat, kuten hydrofobiset vuorovaikutukset, ionisidokset, vetysidokset ja disulfidisidokset.
seuraava proteiiniorganisaation taso on tertiäärirakenne, joka on yhden polypeptidiketjun suurikokoinen kolmiulotteinen muoto. Tertiäärirakenne määräytyy ketjussa kaukana toisistaan olevien aminohappojäännösten välisistä vuorovaikutuksista. Erilaiset vuorovaikutukset synnyttävät proteiinin tertiäärirakenteen, kuten disulfidisillat, jotka ovat aminohappojen sivuryhmien sulfhydryyli (–SH) – funktionaalisten ryhmien välisiä sidoksia; vetysidoksia; ionisidoksia; ja ei-polaaristen sivuketjujen hydrofobisia vuorovaikutuksia. Kaikki nämä vuorovaikutukset, heikot ja vahvat, yhdessä määrittelevät proteiinin lopullisen kolmiulotteisen muodon ja sen toiminnan (kuva 5).
prosessia, jolla polypeptidiketju saa suuren, kolmiulotteisen muodon, kutsutaan proteiinin taittumiseksi. Taitetut proteiinit, jotka ovat täysin toimivia normaalissa biologisessa roolissaan, sanotaan omaavan natiivin rakenteen. Kun proteiini menettää kolmiulotteisen muotonsa, se ei välttämättä ole enää toimiva. Nämä avautumattomat proteiinit denaturoituvat. Denaturaatio tarkoittaa sekundaarirakenteen ja tertiäärirakenteen (ja, jos on, kvaternaarirakenteen) häviämistä ilman primaarirakenteen häviämistä.
jotkut proteiinit ovat useiden erillisten polypeptidien kokoonpanoja, joita kutsutaan myös proteiinin alayksiköiksi. Nämä proteiinit toimivat asianmukaisesti vain silloin, kun kaikki alayksiköt ovat olemassa ja ne on konfiguroitu asianmukaisesti. Näitä alayksiköitä yhdessä pitävät vuorovaikutukset muodostavat proteiinin kvaternaarisen rakenteen. Yleinen kvaternaarirakenne stabiloituu suhteellisen heikoilla vuorovaikutuksilla. Esimerkiksi hemoglobiinin kvaternaarirakenne koostuu neljästä pallomaisesta proteiinin alayksiköstä: kahdesta α-ja kahdesta β-polypeptidistä, joista jokainen sisältää rautapohjaisen hemin (kuva 6).

kuva 6. Hemoglobiinimolekyylissä on kaksi α-ja kaksi β-polypeptidiä sekä neljä hemiryhmää.
toinen tärkeä proteiiniluokka ovat konjugoituneet proteiinit, joilla on ei-proteiiniosuus. Jos konjugoituneeseen proteiiniin on kiinnittynyt hiilihydraatti, sitä kutsutaan glykoproteiiniksi. Jos siihen on kiinnittynyt lipidi, sitä kutsutaan lipoproteiiniksi. Nämä proteiinit ovat tärkeitä kalvojen komponentteja. Kuvassa 7 esitetään yhteenveto proteiinin rakenteen neljästä tasosta.

kuva 7. Proteiinin rakenteessa on neljä järjestystasoa. (luotto: modification of work by National Human Genome Research Institute)
Think about It
- mitä voi tapahtua, jos proteiinin primäärinen, sekundaarinen, tertiäärinen tai kvaternaarinen rakenne muuttuu?
Primäärirakenne, Toimintahäiriöiset proteiinit ja kystinen fibroosi

kuva 8. Klikkaa nähdäksesi suuremman kuvan. Normaali CFTR-proteiini on kanavaproteiini, joka auttaa suolaa (natriumkloridia) liikkumaan soluissa ja ulos.
biologisiin kalvoihin liittyvät proteiinit luokitellaan ulkoisiksi tai luontaisiksi. Ekstriiniset proteiinit, joita kutsutaan myös perifeerisiksi proteiineiksi, liittyvät löyhästi kalvon toiseen reunaan. Sisäsyntyiset proteiinit eli integraaliproteiinit ovat kiinnittyneet kalvoon ja toimivat usein osana kuljetusjärjestelmiä transmembraaniproteiineina. Kystinen fibroosi (CF) on ihmisen geneettinen häiriö, joka johtuu transmembraaniproteiinin muutoksesta. Se vaikuttaa enimmäkseen keuhkoihin, mutta voi vaikuttaa myös haima, maksa, munuaiset, ja suolisto. CF: n aiheuttaa aminohappo fenyylialaniinin katoaminen kystiseen fibroosiin liittyvässä transmembraaniproteiinissa (CFTR). Yhden aminohapon häviäminen muuttaa proteiinin perusrakennetta, joka normaalisti auttaa kuljettamaan suolaa ja vettä soluihin ja ulos niistä (Kuva 8).
primäärirakenteen muutos estää proteiinin toiminnan kunnolla, jolloin keho tuottaa epätavallisen paksua limaa, joka tukkii keuhkot ja johtaa tahmean liman kertymiseen. Lima estää haimaa ja estää luonnollisia entsyymejä auttamasta kehoa hajottamaan ruokaa ja imemään elintärkeitä ravintoaineita.
kystistä fibroosia sairastavien henkilöiden keuhkoissa muuttunut Lima tarjoaa ympäristön, jossa bakteerit voivat menestyä. Tämä kolonisaatio johtaa biofilmien muodostumiseen keuhkojen pienissä hengitysteissä. Kystistä fibroosia sairastavien potilaiden keuhkoista löytyvät yleisimmät taudinaiheuttajat ovat Pseudomonas aeruginosa (Kuva 9a) ja Burkholderia cepacia. Pseudomonas differentoituu keuhkojen biofilmin sisällä ja muodostaa suuria pesäkkeitä, joita kutsutaan ”limaiseksi” Pseudomonakseksi. Pesäkkeissä on ainutlaatuinen pigmentti, joka näkyy laboratoriokokeissa (Kuva 9b) ja antaa lääkäreille ensimmäisen vihjeen siitä, että potilaalla on CF (tällaiset pesäkkeet ovat harvinaisia terveillä yksilöillä).

kuva 9. a) pyyhkäisyelektronimikrografissa näkyy opportunistinen Pseudomonas aeruginosa-bakteeri. B) pigmenttiä tuottava P. aeruginosa setrimide agarissa näyttää vihreää pigmenttiä nimeltä pyosyaniini. (credit a: modification of work by the Centers for Disease Control and Prevention)
avainkäsitteet ja yhteenveto
- aminohapot ovat pieniä molekyylejä, jotka ovat välttämättömiä kaikelle elämälle. Jokaisessa on α-hiili, johon on sitoutunut vetyatomi, karboksyyliryhmä ja amiiniryhmä. Neljäs sidosryhmä, jota edustaa R, vaihtelee kemialliselta koostumukseltaan, kooltaan, napaisuudeltaan ja varaukseltaan eri aminohappojen välillä, mikä antaa vaihtelua ominaisuuksille.
- peptidit ovat polymeerejä, joita muodostuu aminohappojen sidoksista dehydraatiosynteesin avulla. Toisiinsa sidoksissa olevien aminohappojen välisiä sidoksia kutsutaan peptidisidoksiksi. Yhteen liittyneiden aminohappojen määrä voi vaihdella muutamasta moneen.
- proteiinit ovat polymeerejä, jotka ovat muodostuneet hyvin suuren määrän aminohappoja yhdistäessä. Ne suorittavat monia tärkeitä tehtäviä solussa ja toimivat ravintoaineina ja entsyymeinä; varastointi molekyylejä hiilen, typen ja energian; ja rakenneosia.
- proteiinin rakenne on sen toiminnan kriittinen determinantti ja sitä kuvataan asteittaisella luokittelulla: primäärinen, sekundäärinen, tertiäärinen ja kvaternaarinen. Proteiinin alkuperäinen rakenne voi häiriintyä denaturaation seurauksena, jolloin sen korkeamman kertaluvun rakenne ja biologinen toiminta menetetään.
- jotkut proteiinit muodostuvat useista erillisistä proteiinialayksiköistä, joiden yhteisvaikutus muodostaa proteiinikompleksin kvaternaarisen rakenteen.
- Konjugoiduissa proteiineissa on nonpolypeptidiosa, joka voi olla hiilihydraatti (muodostaen glykoproteiinin) tai lipidifraktio (muodostaen lipoproteiinin). Nämä proteiinit ovat tärkeitä kalvojen komponentteja.
monivalintainen
Mikä seuraavista ryhmistä vaihtelee eri aminohappojen välillä?
- vetyatomi
- karboksyyliryhmä
- R-ryhmä
aminoryhmä
missä seuraavista proteiineissa esiintyvät aminohapot eroavat toisistaan?
- koko
- muoto
- kaikki edellä mainitut
Mikä seuraavista sidoksista ei osallistu tertiäärirakenteeseen?
- peptidisidokset
- ionisidokset
- hydrofobiset vuorovaikutukset
- vetysidokset
täytä tyhjä
proteiinin aminohappojärjestystä kutsutaan sen __________.
denaturaatio merkitsee __________ ja __________ rakenteet ilman menetystä __________ rakenne.
True/False
yhden aminohapon muutos proteiinisarjassa johtaa aina toiminnan menetykseen.
ajattele sitä
- proteiinin kuumentaminen riittävästi voi denaturoida sen. Kun otetaan huomioon denaturaation määritelmä, mitä tämä lausunto sanoo peptidisidosten vahvuuksista vetysidoksiin verrattuna?
- kuvassa on tetrapeptidi.

- kuinka monta peptidisidosta tässä molekyylissä on?
- tunnista tämän peptidin muodostavien neljän aminohapon Sivuryhmät.
