mikä on solujen tiheys?
lukutila
biologisen materiaalin tiheys on vastuussa solujen asettumisesta laboratorioputkiemme ja monikaivolevyjemme pohjalle ja toimii perustana rutiininomaiselle sentrifugoinnille, joka on osa monien biologien jokapäiväistä elämää. Nämä samat tiheyserot solujen ja niiden vetisen ulkopinnan välillä ovat myös perusta sille kontrastille, jonka havaitsemme faasimikroskopiakuvissa. Nämä erot ovat tärkeitä myös laboratorioympäristön ulkopuolella. Esimerkiksi plankton joutuu kamppailemaan tämän tiheyseron kanssa pysyäkseen meren syvyydessä, jossa auringonvaloa on runsaasti, sen sijaan että se vajoaisi mustuneisiin syvyyksiin. Kun otetaan huomioon, että useimmat biologit ja biokemistit käyttävät tiheyteen perustuvaa erottelua päivittäin, tuntuu yllättävältä, miten harvoin esimerkiksi taulukossa 1 kerätyistä tiheyksistä todellisuudessa keskustellaan.
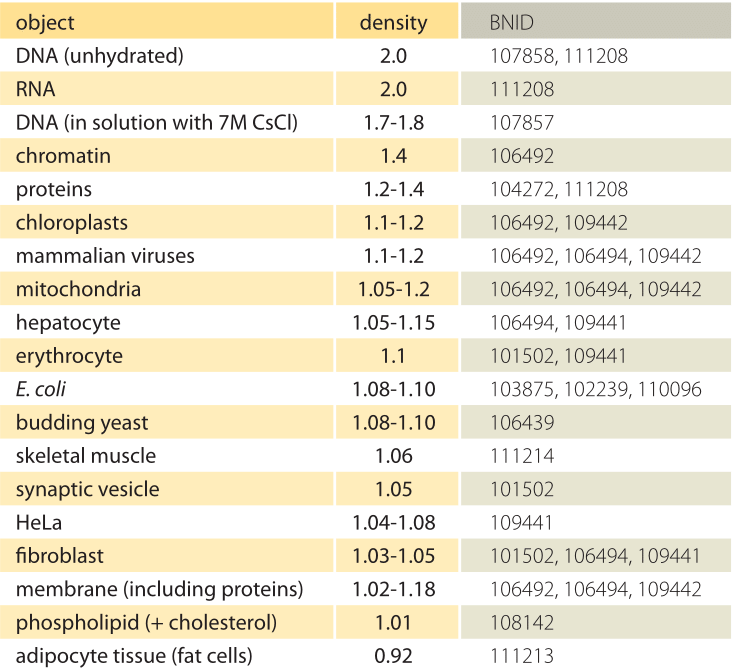
Taulukko 1: biologisten kohteiden tiheydet suhteessa veteen. Tämä vastaa lähes sitä, että ne annetaan yksikköinä g / ml tai 1000 kg / m3. Arvot lajitellaan alenevaan järjestykseen. Ellei toisin mainita, arvot mitattiin sakkaroosista tai ficoll-liuoksesta.
mihin perustuu eri organellien ja solutyyppien vaihteleva tiheys? Nämä erot johtuvat suurelta osin vesipitoisuuden ja kuivan massan suhteesta. Proteiinien tiheys on ≈1,3-1,4 (BNID 104272, 101502) suhteessa veteen (tai lähes samanarvoisesti yksikköinä g/ml tai 1000 kg/m3). Kun otetaan huomioon veden tiheyden viitearvo 1, kennotiheyden 1: n ja 1: n väliarvojen spektri.3 saadaan proteiinien ja veden suhteellisen runsauden perusteella. Lipidit ovat alapäässä veden vieressä tiheydellä noin 1 (BNID 108142). Toisessa ääripäässä tärkkelysrakeet, joiden tiheys on ≈1,5 (BNID 103206) ja nukleotidit ≈1,7, voivat siirtää kokonaismassatasetta vastakkaiseen suuntaan.
tiheyden tunteminen perustuu usein paikkaan, johon tietty biologinen komponentti asettuu kehrättyään sentrifugissa, jossa on gradientti pitoisuuksia, jotka usein syntyvät sakkaroosin tai DNA: n tapauksessa cesiumkloridin avulla. Tiheys heijastaa massaa jaettuna tilavuudella, mutta varautuneiden yhdisteiden osalta liuoksessa tiheyteen vaikuttavat myös niin sanotun sidotun veden kuoret. Tiheys muuttuu tällöin tehokkaaksi tiheydeksi, jota sitova vesi vähentää ja joka on siten jonkin verran riippuvainen suolapitoisuudesta (BNID 107858).
sentrifugissa tapahtuva sedimentaationopeus kvantifioidaan Svedbergin yksikköinä, josta ovat peräisin nimet 70S, 23s jne. ribosomille ja sen rRNA-alayksiköille. 23S rRNA sedimentoituu nopeudella 23×10-12 m/s normaalissa painovoimassa. Ultracentrifugissa, joka tuottaa miljoonan g: n kiihtyvyyden, nopeus skaalautuu suhteellisesti arvoon 23×10-6 m/s eli noin 1 mm/min. Sedimentaation nopeus riippuu molekyylin tiheydestä, koosta ja muodosta. Samankaltaisten muotojen ja tiheyksien osalta sedimentaationopeusasteikot ovat molekyylimassan neliöjuuria. Tällaisissa tapauksissa molekyylimassa menee sedimentaationopeuden neliöksi siten, että ribosomin 23S-ja 16s-alayksiköiden molekyylimassan suhde on karkeasti (23/16)2 tai noin 2, joka on läheisesti linjassa mittausten 0,9 ja 0 kanssa.5 MDa (BNID 110972, 110967). Klinikalla punasolujen (punasolujen) sedimentaationopeutta käytetään rutiininomaisesti tulehduksen mittaamiseen. Hinnat paljon suurempi kuin 10 mm / h osoittavat yleensä pro-sedimentaatio tekijä fibrinogeeni, joka on yleinen indikaattori tulehdustila.
tiedetään hyvin, että vesi on solujen runsain molekyylifraktio, mutta kuinka runsas se tarkalleen ottaen on? Jos tutkimme kudoksia monisoluisista organismeista, vesipitoisuuden löytäminen on yksinkertainen tehtävä mitata kudoksen massa ennen kuivausta ja sen jälkeen. Mutta miten voidaan suorittaa tällaisia mittauksia soluille? Kun punnitsemme solumassan ennen kuivausta ja sen jälkeen, miten mittaamme vain solut ilman vettä niiden ympärillä? Sentrifugoinnin jälkeenkin solupellettiin jää vettä, mikä aiheuttaa epäselvyyttä itse kuivamassasta.
jälleen kerran radioisotooppinen merkintä tulee hätiin (Cayley et al 1991). Ensin mitataan merkittyä vettä (käyttäen tritiumia, 3H) solupelletissä. Tämä osoittaa solujen sisä-ja ulkopuolella olevan veden summan. Sitten toinen liukoinen yhdiste, joka on merkitty, mutta joka ei pääse soluun, kuten 14C-inuliini tai 3H-PEG, mittaa solujen ulkopuolella olevan veden tilavuuden sentrifugoidussa pelletissä (esimerkiksi E. coli-bakteerissa noin 25-35% pelletin tilavuudesta (BNID)). Ero kertoo vesipitoisuudesta solujen sisällä. Tällaiset menetelmät johtavat tyypillisiin arvoihin, jotka vaihtelevat aloittelevien hiivan ja punasolujen ≈60-65% massasta E. colin ja ameeba D. diskoideumin ≈70% ja rotan lihas-ja siansydänkudosten ≈80% (BNID 105938, 103689). Koska kuiva-aineen osuutta hallitsevat osatekijät, joiden tiheys on ≈1,3 (eli proteiinit), tämä johtaa tyypilliseen kokonaistiheyteen ≈1,1 (bnid 103875, 106439, 101502). Näistä tyypillisistä fraktioista kuiva massa tilavuutta kohti voidaan päätellä olevan noin 300-500 mg/ml (BNID 108131, 108135, 108136), mutta hitaan kasvun aikana arvot voivat olla korkeampia. Matalatiheydet ovat yleisiä kuivilla siemenillä ja vedenalaisilla kasveilla, joiden kelluvien osien tiheys on pienempi kuin ympäröivässä vedessä, jolloin ne pääsevät kellumaan. Veden tiheyttä pienemmät pitoisuudet voidaan saavuttaa joko kaasulla kuten rakkolevässä ja joissakin bakteereissa tai käyttämällä molekyylipainoltaan (MW) pienempiä liuoksia kuin ympäröivässä elatusaineessa (esim.korvaamalla natrium MW≈23: lla ammoniumilla MW≈18: lla), kuten pienissä äyriäisissä, Etelämantereen kopepodeissa.
ihmisistä noin 60% on vettä (40% soluissa, 15% interstitiaalinesteessä ja 5% veriplasmassa, BNID 110743) ja useimmat meistä ovat kokeneet nestehukan voimakkaat vaikutukset unohdettuaan juoda edes muutaman lasillisen. Jotkin solut voivat kuitenkin olla yllättävän kestäviä vesipitoisuutensa laskemiseen. Esimerkiksi rotan maksasolujen glukoosiaineenvaihdunnan nopeuteen ei vaikuttanut solunsisäisen veden häviäminen 25%: lla. Tällainen lasku voidaan saavuttaa osmoosilla muuttamalla solunulkoisen nesteen tonisuutta (liukenemakonsentraatiota). Äärimmäisenä esimerkkinä mainittakoon merkittävä suolakatkarapu. Elävät ympäristöissä, joissa ulkopuolinen suolapitoisuus voi vaihdella ja olla erittäin korkea, se on osoitettu olevan kystat, jotka voidaan kuivattaa vain 2% vettä ilman peruuttamattomia vaurioita ja nesteytys tasoilla yli 37% (vain noin puolet sen täysin sammutettua tila) niiden fysiologia käyttäytyy normaalisti. Tämä kestävyys edessä veden menetys saattaa liittyä ero joskus tehdään kahden muodon vettä solun sisustus. Normaali ”irtotavarana oleva vesi”, joka on tarpeettomampi, ja” sitoutunut vesi”, joka liittyy solukomponentteihin ja toimii liuottimena, joka on välttämätön asianmukaisen toiminnan kannalta.





