elektronegatiivisuus ja sidoksen polariteetti
vaikka määrittelimme kovalenttisen sidoksen elektronien jakamiseksi, eivät kovalenttisen sidoksen elektronit aina jakaudu tasan kahden sidostuneen atomin kesken. Ellei sidos yhdistä kahta saman alkuaineen atomia, on aina yksi atomi, joka vetää sidoksessa olevia elektroneja puoleensa voimakkaammin kuin toinen atomi, kuten kuvassa 4.3 ”polaariset ja ei-polaariset kovalenttiset sidokset”esitetään. Kun tällainen epätasapaino ilmenee, syntyy jonkin negatiivisen varauksen (jota kutsutaan osittaiseksi negatiiviseksi varaukseksi ja nimetään δ−) kertyminen sidoksen toiselle puolelle ja jonkin positiivisen varauksen (nimetty δ+) toiselle puolelle sidosta. Kovalenttista sidosta, jolla on epäyhtenäinen elektronien jako, kuten osassa (B) Kuvassa 4.3 ”polaarinen vs. ei-polaarinen kovalenttinen sidos”, kutsutaan polaariseksi kovalenttiseksi sidokseksi, jossa on epätasapainoinen elektronijakauma sidoksen poikki.. Kovalenttinen sidos, jolla on yhtä suuri elektronien jako (kuvan 4 Osa (A).3 ”polaarinen vs. ei-polaarinen kovalenttinen sidos”) kutsutaan ei-polaariseksi kovalenttiseksi sidokseksi, jolla on tasapainoinen elektronijakauma sidoksen poikki..
kuva 4.3 polaarinen verrattuna ei-polaarisiin Kovalenttisiin sidoksiin
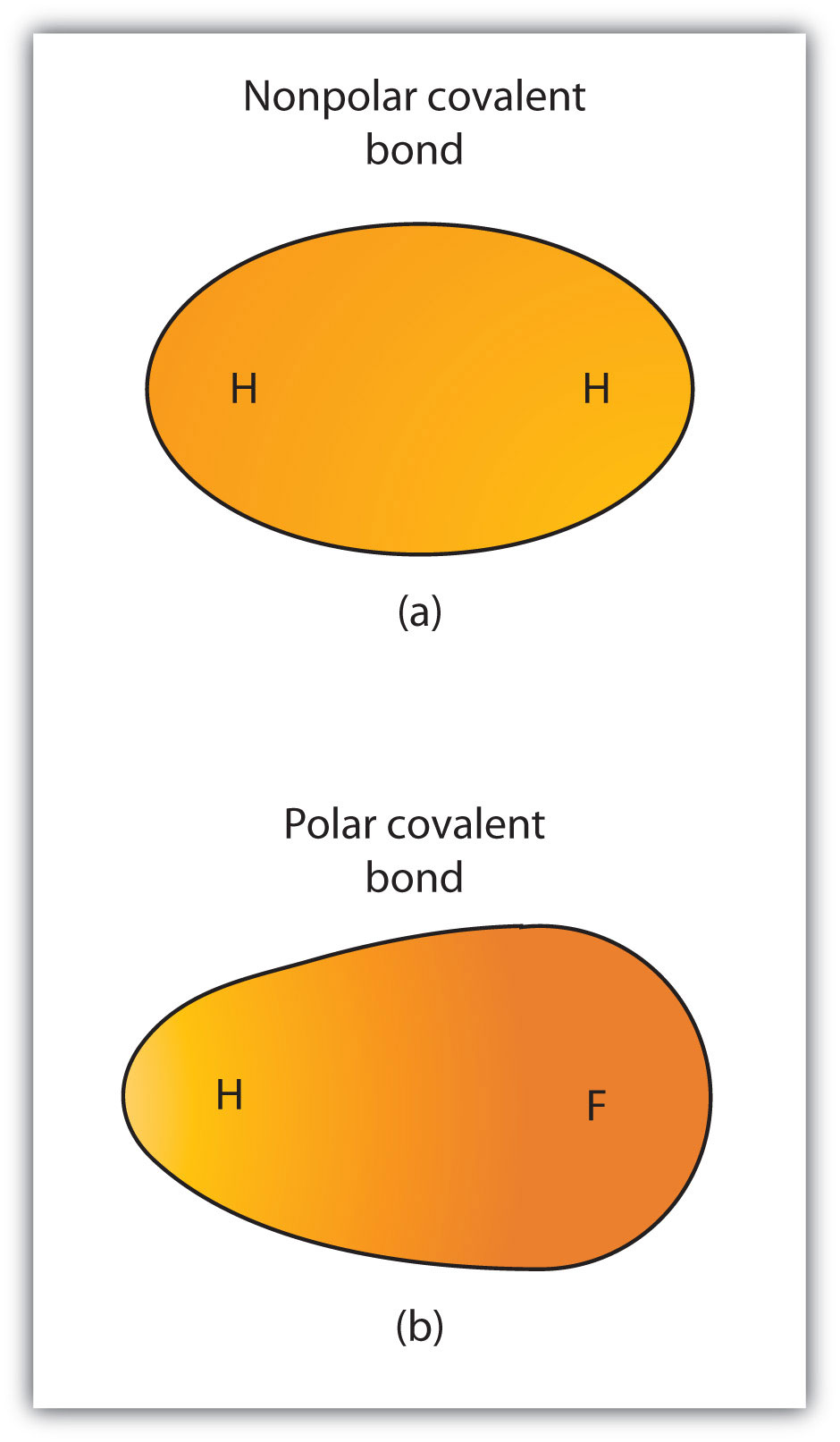
(a) kovalenttisen sidoksen elektronit ovat tasan molempien vetyatomien kanssa. Tämä on ei-polaarinen kovalenttinen sidos. B) fluoriatomi vetää sidoksessa olevia elektroneja puoleensa enemmän kuin vetyatomi, mikä johtaa elektronijakauman epätasapainoon. Tämä on napainen kovalenttinen sidos.
mikä tahansa kovalenttinen sidos eri alkuaineiden atomien välillä on polaarisidos, mutta polariteetin aste vaihtelee suuresti. Jotkut sidokset eri alkuaineiden välillä ovat vain minimaalisesti polaarisia, kun taas toiset ovat voimakkaasti polaarisia. Ionisidoksia voidaan pitää polariteetin perimmäisinä, jolloin elektroneja siirretään eikä jaeta. Kovalenttisen sidoksen suhteellisen napaisuuden arvioimiseksi kemistit käyttävät elektronegativitya suhteellista mittaa siitä, kuinka voimakkaasti atomi vetää elektroneja puoleensa, kun se muodostaa kovalenttisen sidoksen., joka on suhteellinen mitta siitä, kuinka voimakkaasti atomi vetää elektroneja puoleensa muodostaessaan kovalenttisen sidoksen. On olemassa erilaisia numeerisia asteikkoja luokitus elektronegatiivisuus. Kuva 4.4 ”Elektronegativities eri elementtien” osoittaa yksi suosituimmista-Pauling mittakaavassa. Kovalenttisen sidoksen napaisuus voidaan arvioida määrittämällä sidoksen muodostavien kahden atomin elektronegatiivisuuksien ero. Mitä suurempi ero elektronegatiivisuuksissa on, sitä suurempi on elektronin jakautumisen epätasapaino sidoksessa. Vaikka kovia ja nopeita sääntöjä ei ole, yleissääntö on, että jos elektronegatiivisuuden ero on alle 0,4, sidosta pidetään ei-polaarisena; jos ero on suurempi kuin 0,4, sidosta pidetään polaarisena. Jos ero elektronegatiivisuuksissa on riittävän suuri (yleensä suurempi kuin noin 1,8), muodostuvaa yhdistettä pidetään ennemmin ionisena kuin kovalenttisena. Elektronegatiivisuusero nolla, tietenkin, osoittaa ei-polaarinen kovalenttinen sidos.
kuva 4.4 eri alkuaineiden Elektronegatiivisuudet
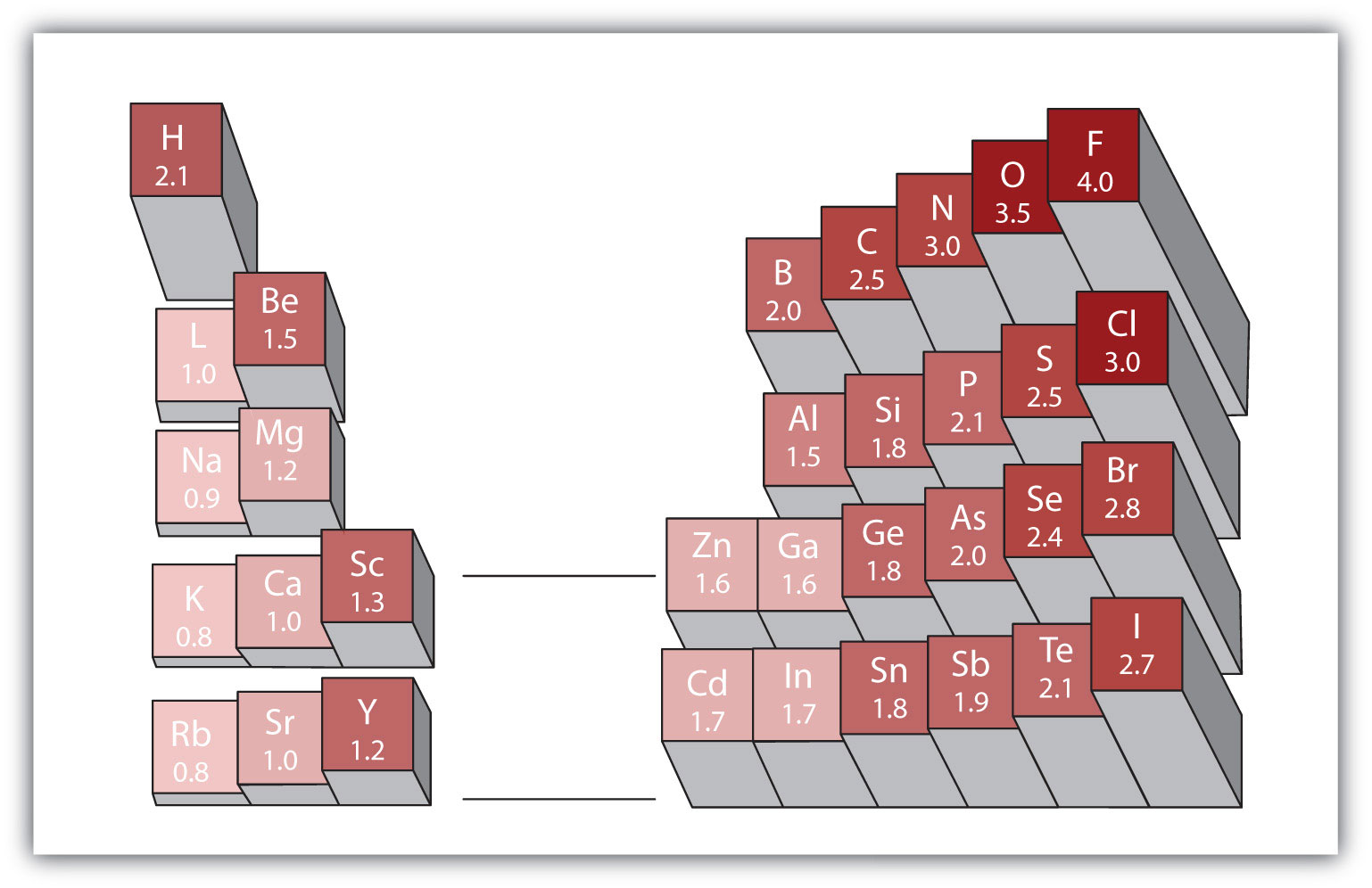
suositussa elektronegatiivisuusasteikossa fluoriatomien arvoksi on asetettu 4,0, korkein arvo.
lähempää: Linus Pauling
kiistatta 1900-luvun vaikutusvaltaisin kemisti Linus Pauling (1901-94) on ainoa henkilö, joka on voittanut kaksi yksittäistä (eli koruttomasti) Nobelia. 1930-luvulla Pauling käytti uusia matemaattisia teorioita esittääkseen joitakin kemiallisen sidoksen perusperiaatteita. Hänen vuonna 1939 ilmestynyt kirjansa ”The Nature of the Chemical Bond” on yksi merkittävimmistä kemian alalta koskaan julkaistuista kirjoista.
vuoteen 1935 mennessä Paulingin kiinnostus kääntyi biologisiin molekyyleihin, ja hän sai 1954 Nobelin kemianpalkinnon työstään proteiinin rakenteen parissa. (Hän oli hyvin lähellä DNA: n kaksoiskierteen rakenteen löytämistä, kun James Watson ja James Crick ilmoittivat omasta löydöstään sen rakenteesta vuonna 1953.) Hänelle myönnettiin myöhemmin vuoden 1962 Nobelin rauhanpalkinto pyrkimyksistään kieltää ydinaseiden testaus.
myöhempinä vuosinaan Pauling vakuuttui siitä, että suuret C-vitamiiniannokset ehkäisisivät sairauksia, muun muassa flunssaa. Useimmat kliiniset tutkimukset eivät osoittaneet yhteyttä, mutta Pauling jatkoi suurten annosten ottamista päivittäin. Hän kuoli vuonna 1994, vietettyään eliniän luomalla tieteellisen perinnön, jota harvat tulevat koskaan vertaamaan.

Linus Pauling oli 1900-luvun vaikutusvaltaisimpia kemistejä.
esimerkki 6
kuvaa elektronegatiivisuusero kunkin atomiparin ja tuloksena olevan napaisuuden (tai sidostyypin) välillä.
- C ja H
- H ja h
- Na ja Cl
- O ja H
liuos
- hiilen elektronegatiivisuus on 2,5, kun taas vedyn arvo on 2,1. Ero on 0,3, mikä on melko pieni. C-H-joukkovelkakirjalainaa pidetään sen vuoksi ei-polaarisena.
- molemmilla vetyatomeilla on sama elektronegatiivisuusarvo—2,1. Ero on nolla, joten sidos on nonpolaarinen.
- natriumin elektronegatiivisuus on 0,9, kun taas kloorin on 3,0. Ero on 2,1 eli melko suuri, joten natrium ja kloori muodostavat ioniyhdisteen.
- kun vedyllä on 2,1 ja hapella 3,5, elektronegatiivisuusero on 1,4. Odottaisimme hyvin polaarista sidosta, mutta emme niin polaarista, että O–H-sidosta pidettäisiin ionisena.
Taitojenrakennusharjoitus
-
c ja o
-
K ja Br
N ja n
-
p> Cs ja F
kuvaa kunkin atomiparin elektronegatiivisuuseroa ja siitä johtuvaa napaisuutta (tai sidostyyppiä).
kun molekyylin sidokset ovat polaarinen, molekyyli kokonaisuutena voi näyttää epätasaisen varausjakauman riippuen siitä, miten yksittäiset sidokset ovat orientoituneet. Esimerkiksi vesimolekyylin kahden O–H-sidoksen orientaatio (Kuva 4.5 ”fysikaaliset ominaisuudet ja napaisuus”) on taivutettu: molekyylin toisessa päässä on osittainen positiivinen varaus ja toisessa päässä osittainen negatiivinen varaus. Lyhyesti sanottuna molekyyli itsessään on polaarinen. Veden polaarisuudella on valtava vaikutus sen fysikaalisiin ja kemiallisiin ominaisuuksiin. (Esimerkiksi näin pienellä molekyylillä veden kiehumispiste on korkea ja se johtuu siitä, että polaariset molekyylit vetävät toisiaan voimakkaasti puoleensa.) Sen sijaan vaikka hiilidioksidin kaksi c=O-sidosta ovat polaarisia, ne sijaitsevat suoraan vastakkain ja kumoavat siten toistensa vaikutukset. Näin ollen hiilidioksidimolekyylit ovat kaiken kaikkiaan ei-polaarisia. Tämä polaarisuuden puute vaikuttaa joihinkin hiilidioksidin ominaisuuksiin. (Esimerkiksi hiilidioksidi muuttuu kaasuksi -77°C: ssa, lähes 200° alempana kuin lämpötila, jossa vesi kiehuu.)
kuva 4.5 fysikaaliset ominaisuudet ja polariteetti

veden ja hiilidioksidin fysikaalisiin ominaisuuksiin vaikuttavat niiden polariteetit.
Konseptiarvosteluharjoitukset
-
mikä on nimitys kahden atomin väliselle etäisyydelle kovalenttisessa sidoksessa?
-
Mitä atomin elektronegatiivisuus osoittaa?
-
millainen sidos muodostuu kahden atomin välille, jos ero elektronegatiivisuuksissa on pieni? Medium? Iso?
vastaa
-
sidoksen pituus
-
elektronegatiivisuus on kvalitatiivinen mittari sille, kuinka paljon atomi vetää elektroneja puoleensa kovalenttisessa sidoksessa.
-
nonpolaarinen; polaarinen; ioninen
eri atomien väliset kovalenttiset sidokset ovat eri sidoksen pituisia.
harjoitukset
-
kumpi on pidempi—C–H–sidos vai C-O-sidos? (KS.taulukko 4.2 ”joidenkin yksittäisten joukkovelkakirjalainojen likimääräiset pituudet”.)
-
kumpi on lyhyempi-N-H-bond vai C-H-bond? (KS.taulukko 4.2 ”joidenkin yksittäisten joukkovelkakirjalainojen likimääräiset pituudet”.)
-
A nanometri on 10-9 m. käyttäen taulukon 4.2 ”likimääräiset sidosten pituudet joidenkin yksittäisten sidosten osalta” ja taulukon 4 tietoja.3 ”sidosten pituuksien Vertailu Yhden ja usean sidoksen osalta”, määritetään kunkin sidoksen pituus nanometreinä.
- A C–O bond
- a h–N bond
- A C≡n bond
-
an angstrom (Å) määritellään 10-10 m: ksi. käytetään taulukkoa 4.2 ”likimääräiset Bond Lengths of Some Single Bonds” ja taulukkoa 4.3 ”Comparison of Bond Lengths for Single and Multiple bond”. kunkin sidoksen pituus angstromeissa.
- A C–C bond
- A C=C bond
- an N≡N bond
-
viittaa harjoitukseen 4. Miksi angstrom-yksikkö on hyödyllinen yksikkönä bondipituuksien ilmaisemiseen?
-
käyttäen kuvaa 4.4 ”eri alkuaineiden elektronegatiivisuus”, määritetään kummalla atomilla kussakin parissa on suurempi elektronegatiivisuus.
- h tai C
- O tai Br
- Na tai RB
i tai Cl
-
käyttäen kuvaa 4.4 ”eri alkuaineiden elektronegatiivisuus”, määritetään kummalla atomilla kussakin parissa on pienempi elektronegatiivisuus.
- Mg tai O
- s tai F
- Al tai Ga
- O tai i
-
Jakautuvatko elektronit tasan tai epätasa-arvoisesti jokaiselle kovalenttiselle sidokselle? Jos se on epätasa-arvoista, niin mihin atomiin elektronit vetävät voimakkaammin puoleensa?
- C–O–sidos
- S–N–sidos
- i-Cl-sidos
-
Jakautuvatko elektronit tasan tai epätasa-arvoisesti kunkin kovalenttisen sidoksen kesken? Jos se on epätasa-arvoista, niin mihin atomiin elektronit vetävät voimakkaammin puoleensa?
- A C–C bond
- A S–C bond
- an O–H bond
-
A C–O bond on pidempi.
- 0,143 nm
- 0,120 nm
- 0,100 nm
- 0.116 nm
-
todelliset sidoksen pituudet ovat hyvin pieniä, joten nanometriyksikkö helpottaa pituuden ilmaisua.
- C
- Na
- epäyhtenäisesti kohti O: ta
viittaa harjoitukseen 3. Miksi nanometriyksikkö on käyttökelpoinen yksikkönä sidosten pituuksien ilmaisemiseen?
vastauksia
yhtä tasaisesti epäyhtenäisesti kohti N: ää
