tärkeä osa ymmärrystä siitä, miten nämä järjestelmät toimivat kontrolloida solujen jakautumista oli havainto, että p53 vaikuttaa sekä syövän andaging. Tyner ym. (2002) laati ageneettisen strategian hiirillä verratakseen p53: n puuttumisen tai normaalia p53-proteiinia pienemmän vaikutuksen vaikutuksia. Kahdesta siirtogeenisestä hiirilinjasta oli joko poistettu kokonaan p53-geeni (p53 -) tai typistetty muoto p53 (p53m, mutantti), jolla ei ollut p53-geenin kuutta ensimmäistä eksonia (kuva 2).
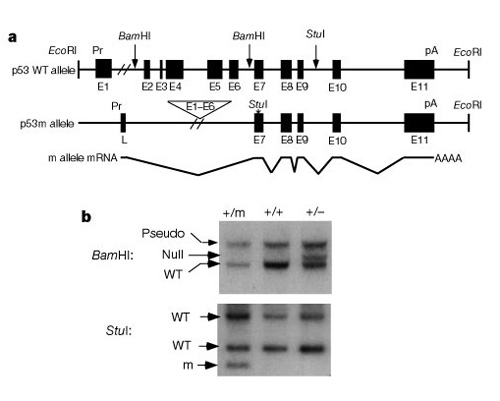
tutkimuksen alkupuoliskolla verrattiin kolmea hiiriryhmää:ryhmä 1, p53+ / p53-(yhden kopion poisto p53: sta); ryhmä 2, p53+ / p53m(osittainen deleetiomutantti); ja ryhmä 3, p53+ / p53+(villi tyyppi, normaali). Taulukossa 1 esitetään nämä kolme ryhmää ja niiden kokeelliset tulokset, jotka liittyvät syöpään ja ikääntyviin fenotyyppeihin. Mielenkiintoista on, että yksikään ryhmän 2 hiiristä, joilla on typistetty p53-proteiini, ei kehittynyt hengenvaarallisia kasvaimia,kun taas 45% ryhmän 3 hiiristä (villi tyyppi) ja yli 80% ryhmän 1 hiiristä kehitti elämää uhkaavia kasvaimia. Ryhmän 2 hiirten elinikä oli myös keskiväli ryhmän 1 hyvin lyhyen ja ryhmän 3wild-tyypin hiirten pidemmän eliniän välillä. Näiden tietojen perusteella voidaan päätellä, että osittainen p53-mutaatio vähensi syövän esiintyvyyttä ja näytti samalla aiheuttavan vajeen eliniässä, ei pidentynyttä elinikää.
| taulukko 1. Experimental results from genetic mousestudies with p53 mutants | |||
| Genotype | Cancer phenotype | Agingphenotype | |
| Group 1 | p53+/p53- (complete deletion) | 80%had tumors | Muchshorter life span |
| Group 2 | p53+/p53m (partial mutant) | None | Shorterlife span |
| Group 3 | p53+/p53+ (wild type) | 45%had tumors | Normallife span |
| sovitettu Tyner etalista. 2002 | |||
tekijät totesivat myös, että ryhmän 2 hiirille kehittyi vanhoille hiirille tyypillisiä fenotyyppejä, kuten hidas karvankasvu ja luustomuutoksista johtuva kyttyräpäinen piikki, varhaisempi kuin villihiiret (kuva 3).

tutkimuksen jälkipuoliskolla Tyner ja kollega selvittivät, toimiko p53: n mutantti eri tavalla normaalin p53: n läsnä ollessa. He kasvattivat ylimääräisen siirtogeenisen hiirilinjan p53- / p53m-mutantalleleilla ja havaitsivat, että näillä hiirillä ei ollut vahvaa kasvainsuojaa ja niillä oli paljon pienempi elinajan vaikutus. Mutantti p53: n täytyi toimia epätarkasti normaalin p53: n kanssa. Yleisenä havaintona tutkijat kertoivat, että p53+/p53m-heterotsygootin solut osoittautuivat noin kolme kertaa niin koviksi totransformeiksi kuin villin tyypin solut. Näin ollen, vaikka nämä solut olivat vastustuskykyisiä syöpää vastaan, tämä p53+ / p53mbackground aiheutti myös aikaisempaa vanhenemista. P53: n aktiivisuus näissä meterotsygooteissa näyttikin olevan huomattavasti suurempi kuin sen aktiivisuus luonnossa. type.It näytti siltä, että tällainen muutos, vaikka apriori, olisi hyvä vastaan sekä syöpää ja vanhenemista,mutta että osoittautui ole niin.
myöhemmin, Mooreet al. osoitti, että viljelmissä, joissa on sama mutaatio, joka aiheuttaa typistettyä p53-proteiinia, tämä typistetty proteiini tuli tumaan ja kolokalisoitui normaalin p53: n kanssa. He tutkivat myös p53-proteiinin puoliintumisajan soluissa ja havaitsivat, että heterotsygooteilla, joilla oli yksi mutanttikopio p53: sta, oli noin kolminkertaistunut normaalin p53-proteiinin stabiilisuus verrattuna pelkästään villityypin stabiiliuteen, eli proteiinin stabiilisuus parani normaalista. Nämä tulokset viljellyt solut laajennettu ja vahvistettu studyconducted Tyner et al. hiirillä. Lisäksi tämä oli ensimmäinen solunjakautumiseen reagointireitti, jonka havaittiin toimivan p53: n kautta ja selvästi moduloivan sekä cancerincidencea että ikääntymistä.
RB-reitissä, joka voi lähettää signaalin solunjakautumissyklistä, tapahtumat, kuten DNA-vaurio tai riittämätön replikaatio, joka johtaa lyhyisiin telomeereihin kromosomin päissä, aiheuttavat CDK-signaloinnin vähenemistä. Tämä, inturn, lisää RB-proteiinikinaasin aktiivisuutta ja siten lisää transkriptiotekijän E2F aktiivisuutta. mikä on E2F: n merkitys? Tämä tekijä sitoutuu RNA-polymeraasialayksiköiden ja muiden s-vaiheen alkamiseen tarvittavien proteiinien promoottoreihin ja auttaa soludivisionin käynnistämisessä (Campisi 2003; Weinberg 1995). Näyttää siis siltä, että sekä p53-että Rb-reitit vaikuttavat samoihin solusyklin säätelymekanismeihin.
