

hiilidioksidi (CO2) on kemiallinen yhdiste. Se on huoneenlämpötilassa kaasua. Se koostuu yhdestä hiili-ja kahdesta happiatomista. Ihmiset ja eläimet vapauttavat hiilidioksidia hengittäessään ulos. Lisäksi joka kerta, kun jotain orgaanista poltetaan (tai tehdään nuotio), syntyy hiilidioksidia. Kasvit käyttävät ravinnokseen hiilidioksidia. Tätä prosessia kutsutaan fotosynteesiksi. Hiilidioksidin ominaisuuksia tutki skotlantilainen tiedemies Joseph Black 1750-luvulla.
hiilidioksidi on kasvihuonekaasu. Kasvihuonekaasut sitovat lämpöenergiaa. Kasvihuonekaasut muuttavat maapallon ilmastoa ja säätä. Tätä kutsutaan ilmastonmuutokseksi. Kasvihuonekaasut aiheuttavat ilmaston lämpenemistä, maan pintalämpötilan nousua.
biologinen rooli
hiilidioksidi on lopputuote eliöissä, jotka saavat energiaa hajottamalla sokereita, rasvoja ja aminohappoja hapen kanssa osana aineenvaihduntaansa. Tätä prosessia kutsutaan soluhengitykseksi. Tähän kuuluvat kaikki kasvit, eläimet, monet sienet ja jotkin bakteerit. Korkeammilla eläimillä hiilidioksidi kulkeutuu veressä elimistön kudoksista keuhkoihin, joista se hengitetään ulos. Kasvit ottavat ilmakehästä hiilidioksidia yhteyttämiseen.
kuivajää
kuivajää eli kiinteä hiilidioksidi on CO2-kaasun kiinteä olomuoto alle -109,3 °F (-78,5°C). Kuivajää ei esiinny maapallolla luonnostaan, vaan se on ihmisen tekemää. Se on väritön. Ihmiset käyttävät kuivajäätä viilentääkseen asioita ja saadakseen juomat kuohumaan, tappaakseen taskurottia ja jäädyttääkseen syyliä. Kuivajään höyry aiheuttaa tukehtumisen ja lopulta kuoleman. Varovaisuutta ja ammattiapua suositellaan aina, kun kuivajää on käytössä.

tavanomaisessa paineessa se ei sula kiinteästä nesteeksi, vaan muuttuu suoraan kiinteästä kaasuksi. Tätä kutsutaan sublimaatioksi. Se muuttuu suoraan kiinteästä kaasuksi missä tahansa erittäin kylmässä lämpötilassa. Kuivajää sublimoituu normaalissa ilman lämpötilassa. Normaalille ilmalle altistuneesta kuivajäästä lähtee hiilidioksidikaasua, joka ei ole värillistä. Hiilidioksidi voi nesteytyä yli 5,1 ilmakehän paineessa.
kuivajäästä irtoava hiilidioksidikaasu on niin kylmää, että sekoittuessaan ilmaan se jäähdyttää ilmassa olevan vesihöyryn sumuksi, joka näyttää paksulta valkoiselta savulta. Sitä käytetään usein teatterissa sumun tai savun vaikutelman luomiseen.
eristäminen ja tuotanto
kemistit voivat saada hiilidioksidia jäähdytysilmasta. Tätä kutsutaan ilmatislaukseksi. Tämä menetelmä on tehoton, koska suuri määrä ilmaa on jäähdytettävä, jotta pieni määrä CO2. Kemistit voivat myös käyttää useita erilaisia kemiallisia reaktioita hiilidioksidin erottamiseen. Hiilidioksidia muodostuu useimpien happojen ja useimpien metallikarbonaattien välisissä reaktioissa. Esimerkiksi suolahapon ja kalsiumkarbonaatin (kalkkikiven tai liidun) välisessä reaktiossa syntyy hiilidioksidia:
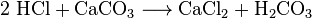
hiilihappo (H2CO3) hajoaa sitten vedeksi ja CO2: ksi. Tällaiset reaktiot aiheuttavat vaahtoamista tai kuplimista tai molempia. Teollisuudessa tällaisia reaktioita käytetään monta kertaa neutraloimaan jätehappovirtoja.
kalkkia (Cao), joka on laajalti käytetty kemikaali, voidaan valmistaa kuumentamaan kalkkikiveä noin 850 °C: seen. Tämä reaktio tekee myös CO2:
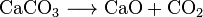
hiilidioksidia valmistetaan myös kaikkien hiiltä sisältävien polttoaineiden, kuten metaanin (maakaasu), maaöljytisleiden (Bensiini, diesel, petroli, propaani), hiilen tai puun poltossa. Useimmissa tapauksissa vapautuu myös vettä. Esimerkkinä metaanin ja hapen välinen kemiallinen reaktio on:
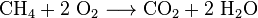
hiilidioksidia valmistetaan terästehtaissa. Rauta pelkistetään oksideistaan koksilla Masuunissa, jolloin syntyy harkkorautaa ja hiilidioksidia:

hiiva metaboloi sokerin hiilidioksidiksi ja etanoliksi, joka tunnetaan myös alkoholina, viinien, oluiden ja muiden väkevien alkoholijuomien tuotannossa, mutta myös bioetanolin tuotannossa:
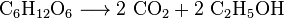
kaikki aerobiset eliöt tuottavat hiilidioksidia hapettaessaan hiilihydraatteja, rasvahappoja ja proteiineja solujen mitokondrioissa. Asiaan liittyvien reaktioiden suuri määrä on äärimmäisen monimutkainen, eikä sitä ole helppo kuvailla. (Niihin kuuluvat soluhengitys, anaerobinen hengitys ja fotosynteesi). Fotoautotrofit (eli kasvit, syanobakteerit) käyttävät toista reaktiota: kasvit absorboivat ilmasta hiilidioksidia ja yhdessä veden kanssa reagoivat sen muodostaen hiilihydraatteja:
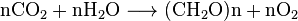
hiilidioksidi liukenee veteen, jossa se spontaanisti konvertoi CO2: n ja H2CO3: n välillä hiilihappo). CO2: n, H2CO3: n ja deprotonoitujen muotojen HCO−
3 (bikarbonaatti) ja CO2−
3(karbonaatti) suhteelliset pitoisuudet riippuvat happamuudesta (pH). Neutraalissa tai hieman emäksisessä vedessä (pH > 6.5) bikarbonaattimuoto on vallitsevinta (>50%) ja esiintyy eniten (>95%) meriveden pH: ssa, kun taas hyvin emäksisessä vedessä (pH > 10, 4) vallitseva (>50%) muoto on karbonaatti. Bikarbonaatti-ja karbonaattimuodot ovat hyvin liukoisia. Niinpä ilmatasapainotettu merivesi (lievästi emäksinen, tyypillinen pH = 8,2–8,5) sisältää noin 120 mg bikarbonaattia litrassa.
teollisuustuotanto
teollisuuden hiilidioksidia tuotetaan pääasiassa kuudesta prosessista:
- ottamalla talteen luonnollisia hiilidioksidilähteitä, joissa sitä tuotetaan happamoituneen veden vaikutuksesta kalkkikiveen tai dolomiittiin.
- vedyntuotantolaitosten sivutuotteena, jossa metaani muutetaan CO2: ksi;
- fossiilisten polttoaineiden tai puun poltosta;
- sokerin käymisen sivutuotteena oluen, viskin ja muiden alkoholijuomien panimossa;
- kalkkikiven, CaCO3, lämpöhajoamisesta kalkin valmistuksessa (kalsiumoksidi, CaO);
kemiallinen reaktio
hiilidioksidia voidaan luoda yksinkertaisella kemiallisella reaktiolla:
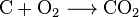 carbon + oxygen → carbon dioxide
carbon + oxygen → carbon dioxide
Images for kids
-

Crystal structure of dry ice
-

Pellets of ”dry ice”, a common form of solid carbon dioxide
-

Carbon dioxide bubbles in a soft drink.
-

Dry ice used to preserve grapes after harvest.
-

Use of a CO2 fire extinguisher.
-

A carbon dioxide laser.
-

CO2 in Earth’s atmosphere if half of global-warming emissions are not absorbed.(NASA computer simulation).
-

pterapodin kuori, joka on liuotettu merivedessä ennustettuun merikemiaan vuodelle 2100.
-

fotosynteesin ja hengityksen yleiskatsaus. Hiilidioksidi (oikealla) muodostaa veden kanssa yhteyttämällä happea ja orgaanisia yhdisteitä (vasemmalla), jotka voivat hengittyä veteen ja (CO2).
-

nouseva CO2-taso uhkasi Apollo 13: n astronautteja, jotka joutuivat muokkaamaan komentomoduulin patruunoita syöttämään kuumoduulin hiilidioksidipesuria, jota he käyttivät pelastusveneenä.
-

CO2 concentration meter using a nondispersive infrared sensor
