Introduction
sytotoksiset solut ovat olennaisia taistelussa virusinfektoituneita soluja ja syöpäsoluja vastaan. Nämä solut tappavat kolmea eri reittiä, lyyttisten rakeiden vapautumista, FAS-reseptori-ligandireittiä tai TRAIL–TRAIL-reseptorireittiä. Tässä asiakirjassa keskitymme degranulaatioon. Kun sytotoksinen solu kohtaa kohdesolun, se kiinnittyy siihen tiukasti muodostaen immuunisynapsin. Tämän jälkeen lyyttiset rakeet polarisoituvat kohti immunologista synapsia ja vapautuvat sytotoksisesta solusta kohti kohdetta (1). Nämä rakeet sisältävät erilaisia sytotoksisia välittäjäaineita, kuten perforiini-ja grantsyymejä. Vapautunut perforiini voi muodostaa kohdesolukalvoon ohimeneviä huokosia, jolloin grantsyymit pääsevät kohdesoluun. Sisäänpääsy tapahtuu todennäköisesti myös perforiinioligomeerien välityksellä, jotka muodostavat epätäydellisiä huokosia (kaaria) (2), ja on myös ehdotettu, että granzymejä ja perforiinia voidaan viedä kohdesoluihin endosomaalisen reitin kautta (3, 4). Näiden ehdotettujen mekanismien taustalla olevista tiedoista on äskettäin keskusteltu yksityiskohtaisesti (5). Kun granzymit tulevat kohdesoluihin, kaspaasireitti aktivoituu ja tuloksena on apoptoosi (6, 7). Näiden sytotoksisten rakeiden kalvo sisältää lysosomiin liittyvää membraaniglykoproteiini – 1: tä (LAMP1), joka tunnetaan myös nimellä CD107a (8). Rotan cd107a: n luminaalinen osa altistuu transitiivisesti solukalvon solunulkoiselle puolelle degranulaation jälkeen ennen kuin se jälleen sisäistyy. Siksi cd107a-värjäys osoittaa, että degranulaatiotapahtuma on tapahtunut (9). CD107a: n roolia vielä selvitetään, mutta Sirna-tutkimukset CD107a: ta vastaan ovat osoittaneet, että se on välttämätön perforiinin kulkeutumiselle rakkuloiden sisällä, koska perforiinin kulkeutuminen lyyttirakeisiin estyy CD107a: n puuttuessa (10). CD107a: n on myös osoitettu suojaavan sytotoksisia soluja kuolemalta sitoutumalla perforiiniin ja estämällä solukalvoon joutumisen (11).
sytotoksisia lymfosyyttejä on kahta päätyyppiä, luonnollisia tappajasoluja (nk) ja CD8 T-soluja. Molemmat solutyypit tappavat vapauttamalla lyyttisiä rakeita, FAS-reseptori/FAS-ligandireitin ja TRAIL/TRAIL-reseptorireitin, mutta näiden kahden soluryhmän aktivoimiseen tarvittava ärsyke on erilainen. T-solut tunnistavat MHC-luokan I molekyylien esittämän antigeenin aktivoivien t-solureseptoreidensa (TCR) kautta, kun taas NK-solut tunnistavat kohdesoluantigeenit erilaisista inhiboivista ja aktivoivista reseptoreista. Inhibitorireseptorit ovat tärkeitä estämään NK-soluja tappamasta terveitä soluja samalla kun reseptoreita aktivoivat aiheuttavat NK-solujen sytotoksisuutta.
ennen CD107a: n tunnistamista degranulaation merkkiaineena NK-soluissa (12) sytotoksisuuden mittaustulos oli kohdesolujen kuolema. CD107a: n osoittaminen virtaussytometrialla antoi tutkijoille mahdollisuuden tunnistaa spesifiset efektorisolut, joilla on sytotoksinen kyky. Sen löytämisen jälkeen on valmistunut laaja valikoima hiiri-ja ihmistutkimuksista saatuja tietoja, jotka osoittavat anti-CD107a-vasta-aineen käytön edut. Rotta on arvokas immunologinen eläinmalli tutkittaessa sairauksia, kuten leukemiaa ja siirteen vs. isäntäsairaus (13), mutta toimintaa on vaikeuttanut se, että virtaussytometriaan ei ole saatu laadukkaita spesifisiä Anti-rotille tarkoitettuja CD107a-vasta-aineita. Tässä asiakirjassa kuvataan vasta-aineen muodostumista rotan CD107a: lle ja degranulaatiovasteen luonnehtimista rotan nk-ja CD8+ T-soluissa.
materiaalit ja menetelmät
Eläimet
Armenian Sisäsiittoiset hamsterit (Cytogen Research and Development Inc., MA, USA) sijoitettiin Oslon yliopistollisen sairaalan Rikshospitaletin vertailevan lääketieteen osastolle institutionaalisten ohjeiden mukaisesti. Rotan kantoja PVG-RT1U, PVG-RT7b, PVG-RT1N ja PVG-R23 käytettiin vaihdellen, ja niitä säilytettiin yli 20 sukupolven ajan ja säilytettiin Norjan maatalousministeriön alaisuudessa toimivan Koe-Eläinkomitean ja kokeellisiin ja muihin tieteellisiin tarkoituksiin käytettävien selkärankaisten eläinten suojelusta tehdyn eurooppalaisen yleissopimuksen ohjeiden mukaisesti. Rottia käytettiin 8-12 viikon ikäisinä. Koe-eläinlaitoksille tehdään rutiininomainen terveyden seurantaohjelma ja testataan tarttuvien organismien varalta Federation of European Laboratory Animal Science Associationin suositusten muutoksen mukaisesti. Eläinkokeita säädeltiin laboratoriomääräyksillä, joista säädetään eläinsuojelulaissa, jossa Norja noudattaa EU: n laboratoriomääräyksiä ja eurooppalaista laboratoriomääräystä.
Abs ja reagenssit
vasta-aineet NKp46 , NKR-P1A 3.2.3-PB, tai konjugoitumaton (sitova vain NKR-P1A, mutta ei NKR-P1B, PVG-kannassa), CD8 (OX8-biotiini), CD2 (OX34, konjugoimaton), TCR (R73-Alexa647), hiiren IgD B allotyyppi (TIB96-konjugoimaton, käytetään hiiren IgG-isotyyppinä) ja CD45.2 (His41-FITC, käytetään hiiren IgG-isotyyppinä) tehtiin laboratoriossamme ja konjugoitu standardiprotokollien mukaan. Vasta-aineet CD3: a (IF4, konjugoitumaton) ja sen isotyyppiä hiiren IgM: ää (MM-30, konjugoitumaton) ja armenialaisen hamsterin IgG: n isotype control (HTK88-FITC) vastaan ostettiin biolegendistä (San Diego, CA, USA). Kaupallisia anti-CD107a-vasta-aineita ostettiin AbCam: lta (Cambridge, UK) (H4A3-FITC), ebioscienceltä (San Diego, CA, USA) (ID48-PerCP-eFluor) ja Lifespan: lta (Seattle, WA, USA) (LS-c8580-konjugoimaton). LS-C8580 konjugoitiin Alexa488 NHS-Esterin (Sigma-Aldrich, St. Louis, MO, USA) kanssa käytettäväksi funktionaalisissa määrityksissä. Anti-FLAG antibody (m2, konjugoitumaton) ja anti-hiiri IgG (goat polyclonal-FITC) ostettiin Sigma-Aldrichilta (St. Louis, MO, USA). IL-2 saatiin dialysoidusta soluviljelmän supernatantista kiinanhamsterin munasarjasolulinjasta (cho), johon on transfektoitu rotan IL-2-ilmentymärakenne. BD biosciences (Franklin Lakes, NJ, USA) osti peridiniiniklorofylli-a-proteiinin (PerCP) konjugoidun streptavidiinin, FITC hamster IgG polyklonaalisen isotyyppikontrollin, FITC mouse IgG1 isotype Controlin (Mopc-FITC) ja Golgistopin. Goat anti-Armenian hamster (polyclonal-FITC) ostettiin Jackson Immunoresearch (West Grove, PA, USA). Hybridomas OX41: n, CD172a: n (SIRPa), R73: n (anti-rat TCRaß), OX19: n (anti-CD5), OX12: n (anti-Igk-ketju) ja OX33: n (anti-CD45RA) supernatantit valmistettiin talon sisällä. Kontrollihamsterin seerumi oli peräisin immunisoimattomista armenialaisista hamstereista.
rotan CD107a: n Kloonaus
rotan CD107a: n PCR monistettiin rotan PVG-splenosyyteistä saadusta cDNA: sta ja subklonoitiin PMX-ekspressiovektoriksi, joka sisälsi puromysiiniresistenssigeenin (antelias lahja tohtori Michael R. Dawsilta) (14). CD107 alukkeet suunniteltiin rotan CD107a (LAMP1) cDNA-sekvenssin (GenBank: NM_012857) pohjalta. Forward primer: 5′-GCCCAGCACTGTTCGAGGT-3′; Reverse primer: 5′-GTTGTTACCGTACACT-3′. Lausekevektorissa käytettiin anionista trypsiini-1-leader-peptidiä (MSALLILALVGAAVA), ja alkuperäinen CD107-transmembraanialue korvattiin CD8-transmembraanikappaleella korkean pinnan ilmentymisen helpottamiseksi. CD107-proteiinin N-terminaaliin liitettiin LIPPUTAGI (DYKDDDK), jotta pinnan ekspressio olisi havaittavissa. Kaikki lisätyt sekvenssit ja avoin lukukehys lopullisessa kimeerisessä plasmidirakenteessa tutkittiin ja vahvistettiin Sangerin DNA-sekvensoinnilla.
Transfecting BWZ.36 solua, joissa oli PMX-CD107a-plasmidi
293t-soluja, kylvettiin 6-kuoppaiseen soluviljelylevyyn, jossa oli 4 ml RPMI 1640-väliainetta, transfektoitiin 7, 5 µl FuGENE6-reagenssilla (Roche, valmistajan protokolla) ja inkuboitiin 37°C: ssa 5% CO2: lla. FuGENE6-reagenssi esilaimennettiin Opti-mem-valmisteella (Gibco) ja sekoitettiin 1, 5 µg: n PMX-CD107a-plasmidiin ja 1 µg: n pCL-ECO-jyrsijäspesifiseen retroviruspakkausplasmidiin (Addgene #12371). Kaksikymmentäneljä tuntia verensiirron jälkeen supernatantti puhdistettiin ja korvattiin rpmi1640-liuoksella, jossa oli 2% FBS: ää, ja siirrettiin 32°C: seen retroviraalista tuotantoa varten. Neljäkymmentäkahdeksan tuntia myöhemmin supernatantti kerättiin ja suodatettiin 0,2-µm Filtropur s-suodattimella (Sarstedt) ja säästettiin -80°C: ssa retroviraalista transduktiota varten.
105 BWZ.36 solua kylvettiin kaivoa kohti 24-kuoppaiseen Soluviljelylevyyn (Corning) ja viljeltiin tuoreella rpmi1640-elatusaineella 10 prosentin FBS: llä yön yli. Supernatantti poistettiin ja rpmi1640, joka sisälsi 10% FBS: ää, 16 µg polybreeniä (lopulliseksi pitoisuudeksi 8 µg/ml) ja 1, 5 ml retroviraalista supernatanttia, lisättiin ja sentrifugoitiin 32°C: ssa nopeudella 2400 rpm 2 tunnin ajan. Soluja inkuboitiin 32°C: ssa 1 tunnin ajan, minkä jälkeen supernatantti poistettiin ja korvattiin tuoreella rpmi1640-liuoksella, jossa oli 10% FBS: ää, ja sitä viljeltiin 3 päivän ajan 37°C: ssa, jossa oli 5% CO2: ta (päivänä 2 voitiin käyttää täydellistä liuosta, jossa oli 1 ng/ml puromysiiniä). Laajennettu BWZ. CD107a-LIPPUSIIRROILLA tutkittiin lippulapun pinnan ilmentymistä, minkä jälkeen niitä käytettiin vasta-aineiden immunisointiin tai vasta-aineiden seulontaan.
generoiva CD107a, joka ilmentää Transfektantteja
kimeerinen rotta CD107a plasmidi transfektoitiin CHO-soluihin. Lyhyesti cho-soluja viljeltiin täydellisessä rpmi1640-väliaineessa (cRPMI; RPMI1640-väliaineessa, jossa on 10% FBS, 1mm Na-pyruvaatti, 50µm 2-merkaptoetanoli), kunnes ne saavuttivat 30% konfluenssin. 2,5 µg plasmidia sekoitettiin 7,5 µl: aan Fugeeni 6-reagenssia (Roche) ja lisättiin soluihin pisaroittain. Kahden päivän kuluttua cho-solut irrotettiin rpmi1640-alustalla, jota täydennettiin 2 mm: n EDTA: lla, ja kylvettiin 96-kuoppaisiin tasapohjaisiin soluviljelylevyihin (25 solua/kuoppa) valintaväliaineella (cRPMI täydennettynä 20 µg/ml puromysiinillä) stabiilien transfektanttien kloonausta varten. 10-12 päivän viljelyn jälkeen aikuiset kloonit seulottiin anti-FLAG-vasta-aineella (M2). Rokotuksiin käytettiin yhtä Flagin ja CD107a: n korkeinta pintatasoa ilmentävistä klooneista.
immunisaatio ja Solufuusio
3 – 10 viikon ikäiset Armenian Sisäsiittoiset hamsterit immunisoitiin intraperitoneaalisilla injektioilla (i.p.) 2 × 106 CHO.CD107a-LIPPUSOLUILLA kerran viikossa 3 viikon ajan. Boost 4 × 106 vakaasti transfektoidun BWZ.CD107a-FLAG-solun kanssa annettiin 32 päivän kuluttua ensimmäisestä rokotuksesta ja seerumeista analysoitiin sekä cho.CD107a-FLAG-että BWZ-solujen pintavärjäys. CD107a-lipun transfektantit. Kaksi kolmesta eläimestä oli positiivisia, ja 3 päivää tehostamisen jälkeen pernasolut kerättiin ja yhdistettiin kahdesta eläimestä, joista toisella oli splenomegalia. Noin 2, 0 × 108 pernasolua ja 1, 4 × 108 NS0 myeloomasolua pestiin kolme kertaa dmem: ssä lisäaineilla (1 mm natriumpyruvaatti, 0, 05 mM 2-merkaptoetanoli ja antibiootti/antimykoottinen) ja sentrifugoitiin 90 grammassa 10 minuutin ajan. Pitäen kaiken 37°C: ssa tästä eteenpäin, pelletti liuotettiin napauttamalla putkea ja esivaimennettu polyetyleeniglykoli 1500 (Roche) lisättiin tippa pisaralta samalla varovasti sekoittaen 1 min. Kolme millilitraa dmem: tä lisäaineineen lisättiin asteittain seuraavan 3 minuutin ajan 7 ml: lla ennen sentrifugointia 500 g: ssa. pelletti pestiin huolellisella huuhtelulla (ei sekoittamista) dmem: llä lisäaineilla ja 20% FBS: llä (DMEM-20) ja viljeltiin yön yli. Solut kerättiin seuraavana päivänä ja 100 ml dmem–20: tä lisättiin 2× hypoksantiini–aminopteriini-tymidiinillä (SIGMA) ja 10% hybridoomakloonauslisällä (HCS) (PAA). Kennosuspensio siirrettiin 96-kuoppaisille levyille. 12 päivän kuluttua kasvukloonien supernatantit testattiin virtaussytometrialla pinta-antigeenien värjäämiseksi BWZ.CD107a-FLAG-ja cho.CD107a-FLAG-testeissä, mutta ei BWZ-testeissä.36 solua, joissa on epäolennaisia antigeenejä negatiivisina kontrolleina. Spesifisiä vasta-aineita tuottavista 12 positiivisesta kloonista 9 aliklonoitiin edelleen käyttämällä dmem-20: tä, johon oli lisätty hypoksantiini-tymidiiniä ja HCS: ää. Vain yksi klooni (SIM1) tuotti vasta-aineita aliklonoinnin jälkeen ja tämä subklonoitiin vielä kerran. CD107a spesifiset hamsterin IgG-vasta-aineet todettiin FITC anti-Armenian hamster IgG: llä (Jackson Immunoresearch). SIM1 hybridoomasta saatu Anti-CD107a puhdistettiin HiTrap-proteiinilla G HP (GE Healthcare, Life Sciences) ja FITC-konjugoidulla standardimenetelmien mukaisesti tai alexa488-konjugoidulla valmistajan protokollan mukaan.
efektorisolujen sukupolvi
pernasta valmistettiin Yksisolususpensioita. Lymfosyytit eristettiin Lymfoprep-gradientin avulla ja sitten ajettiin nailonvillakolonnin yli B-solujen ja makrofagien poistamiseksi. IL-2-aktivoitujen NK-solujen (LAK) tuottamiseksi loput solut viljeltiin yön yli IL-2: ssa. Seuraavana päivänä ei-kiinnittyneet solut poistettiin pesemällä PBS: llä ja kiinnittyneet NK-solut säilytettiin RPMI: ssä täydennettynä IL-2: lla, 10% lämpö inaktivoidulla FBS: llä, 1% streptomysiinillä/penisilliinillä, 1mm natriumpyruvaatilla ja 50 µM 2-merkaptoetanolilla. Soluja viljeltiin 8-10 päivää. Rikastettujen NK-solujen eli lajiteltujen T-ja NK-solujen tuottamiseen solut rikastettiin negatiivisella valinnalla nailonvillavaiheen jälkeen. NK-solujen rikastamiseksi pan-hiiren IgG-Dynabeadit (Invitrogen Dynal) päällystettiin makrofagien (OX41), T-solujen (R73 ja OX19) ja B-solujen (OX12 ja OX33) vasta-aineilla. T-solujen rikastamiseksi pan-hiiren IgG-Dynabeadit värjättiin makrofagien (OX41) ja B-solujen (OX12 ja OX33) vasta-aineilla. Solut rikastettiin kahdella negatiivisen valinnan vaiheella värjätyillä helmillä 30 minuutin ajan 4°C: ssa. Rikastettujen NK-solujen puhtaus oli noin 50-60% ja niitä käytettiin degranulaatiotutkimuksissa. Rikastettuja TCR+ – soluja (puhtausaste 79-85%) lajiteltiin edelleen FACS Aria-menetelmällä (BD Biosciences).
Degranulaatiokokeet
degranulaatiovasteen mittaamiseksi värjäämällä rotan anti-CD107a: lla (SIM1) kohdesolujen stimulaation aikana NK-efektoreita ja YAC-kohdesoluja inkuboitiin 1: 1 suhteessa 3 × 105 solua / kuoppa (ellei toisin mainita) väliaineessa, joka sisältää SIM1 mAb: tä, muita kaupallisesti saatavilla olevia anti-CD107a-vasta-aineita tai isotyyppikontrollia. NK-solujen vasta-ainestimulaation degranulaatiovasteen mittaamiseen käytimme tasapohjaisia 96-kuoppalevyjä, jotka oli päällystetty vaihtelevilla pitoisuuksilla anti-Nkp46 (Wen23), anti-NKR-P1A (3.2.3) ja hiiren IgG1 isotype control (TIB96). Seuraavana päivänä levyt pestiin PBS: llä ja blokattiin cRPMI: llä ennen kuin kaivoon lisättiin 3 × 105 rikastettua NK-solua, jotka oli ripustettu CRPMI: hen sisältäen SIM1: tä. Degranulaation mittaamiseksi T-soluista ne lajiteltiin ja viljeltiin cRPMI: ssä IL-2: lla 2-3 päivän ajan. 96-kuoppaiset tasapohjaiset levyt pinnoitettiin yön aikana CD3: n (IF4), CD2: n (OX34) tai IgM: n isotyyppikontrollin (MM-30) vasta-aineilla. SIM1: tä sisältävään cRPMI: hen lisättiin noin 3 × 105 T kennoja kaivoa kohti. Kaikki määritykset inkuboitiin 4 tunnin ajan. Golgistoppia lisättiin viimeisen 3 tunnin inkubaation ajaksi, jotta vältettäisiin sisäelinten CD107a: n hajoaminen. tämän jälkeen solut pestiin ja värjättiin vasta-aineilla sopiviin pintareseptoreihin ja analysoitiin käyttäen FACS Canto-tai LSR II-menetelmää (BD Biosciences).
Krominvapautusmääritys
YAC-1 kohdesolut (5 × 106 solua / ml cRPMI) lisättynä 3.7 MBq51Cr inkuboitiin 37°C: ssa 1 tunnin ajan sekoittaen 15 minuutin välein. Tämän jälkeen solut pestiin kolme kertaa PBS: llä, jossa oli 2% FBS: ää, ja suspendoitiin uudelleen tasolle 1 × 105 solua/ml cRPMI: ssä. LAK-efektorisolut ja kohdesolut pinnoitettiin määritetyillä suhteilla 200 µl: n lopullisessa tilavuudessa. Kennot sentrifugoitiin ja inkuboitiin 4 tunnin ajan 37°C: n lämpötilassa.51Cr: n spesifinen vapautuminen mitattiin Cobra auto-gammalla (Packard).
tulokset
vasta-aineen luomiseksi CD107a: ta vastaan teimme lausekevektorin, joka sisältää rotan CD107a: n solunulkoisen kalvoalueen, rotan CD8: n transmembraanialueen ja 3′-terminaalisen LIPPUTUNNUKSEN pinnan ekspression havaitsemiseksi (Kuva 1a). Vektori transfektoitiin CHO-ja BWZ-soluihin.36 T solulinjaa ja suojattu CD107a-ilmentymistä varten lippujen vastaisella vasta-aineella (M2) (Kuva 1B). CD107a stably transfected CHO-soluja ruiskutettiin armenialaisiin sisäsiittoisiin hamstereihin kerran viikossa 3 viikon ajan, ja CD107a stably transfected BWZ-solujen lopullinen tehostus 3 päivää ennen fuusiota NS0 myelooma-solulinjaan. Eri kloonien supernatanttien spesifisyyttä BWZ: iin testattiin CD107a-lipulla, mutta ei merkityksettömällä lipulla merkityllä BWZ: llä.36 transfektanttia. Yhden kloonin, SIM1: n, havaittiin sitoutuvan nimenomaan transfektanttia ilmaisevaan CD107a: han, mutta ei lipun transfektoituun kontrolliin (Kuva 1c).

kuva 1. Rotille valmistettavan CD107a-monoklonaalisen vasta-aineen (SIM1) muodostuminen. (A) PMX-lausekevektorin kaavamainen vektorikartta, jossa on leader-peptidi, FLAG-tag, CD107a-insertti ja CD8: n transmembrane-verkkotunnus. (B) stabiilisti transfektoitu kiinanhamsterin munasarja ja BWZ.36 solua testattiin lipulla merkityn CD107a: n solun pinnan ilmentymiseksi käyttäen anti-FLAG-vasta-ainetta (m2) (varjostetut histogrammit). Negatiivinen kontrolli on pelkkä toissijainen vasta-aine (läpinäkyvä histogrammi). C) BWZ-solut, joihin transfektoitiin CD107a-FLAGILLA tai epäolennaisella antigeenillä (NKR-P1F-FLAG), värjättiin hamsterin verrokkiseerumilla, SIM1-supernatantilla tai anti-FLAG-vasta-aineella (m2).
kloonia SIM1 testattiin edelleen funktionaalisissa määrityksissä rinnakkain kahden kaupallisesti saatavilla olevan CD107a-vasta-aineen kanssa, jotka voivat mahdollisesti ristiinreaktiota rotan cd107a: n kanssa virtaussytometriassa. Testatut vasta-ainekloonit olivat ABCAM: n H4A3 (joka reagoi ristiin ihmisen, rotan, hiiren ja kädellisten kanssa virtaussytometriassa) ja LifeSpan BioSciences: n vasta-aineklooni LS-C8580 (joka risteytyi hiiren, ihmisen ja rotan cd107a: n kanssa immunohistokemiassa ja Western blots: n mukaan). SIM1-vasta-aineklooni tunnisti degranuloivia soluja kohdesolujen läsnä ollessa ja osoitti vain vähän taustavärjäystä kohteiden puuttuessa (yläpaneelin Kuva 2A). Klooni H4A3 värjäsi NK-solujen suurimman prosenttiosuuden kohdesolustimulaation jälkeen (keskimmäinen paneeli). Kohdesolujen puuttuessa havaittiin kuitenkin myös runsaasti taustavärjäystä, mikä viittaa epäspesifiseen sitoutumiseen. LS-C8580 mAb-klooni (alempi paneeli) mittasi mahdollisesti hyvin alhaiset degranulaatiotasot. Näiden vasta-aineiden spesifisyys varmistettiin BWZ.CD107a-LIPPUSIIRTÄJÄN positiivisella värjäyksellä, mutta ei BWZ: llä.NKR-P1F-LIPPUVALVONTA (Kuva 2B). Vasta-aineklooni H4A3, jonka on osoitettu sitoutuvan ihmisen CD107a: han (16), ei tahrannut rotan cd107a: n transfektoimia BWZ-soluja, mikä viittaa siihen, että rotan CD107a: n kanssa ei ole ristireaktiota. hiirtä vastustava cd107a-klooni ID48 ei myöskään tahrannut rotan CD107a-transfektanttia. Konjugoitumattomissa LS-C8580-soluissa sen sijaan esiintyi spesifisiä värjäytymiä transfektoiduissa CD107a-soluissa (tietoja ei näy). LS-C8580-kloonia on kuitenkin saatavilla vain konjugoitumattomana vasta-aineena, joka ei sovellu degranulaatiotutkimuksiin. Toistuvat yritykset laboratoriossamme konjugoida LS-C8580 alexa488: aan eivät valitettavasti ole toimittaneet voimakkaita värjäyskonjugaatteja, vaikka pieni otoskoko ja Ls-C8580: n pitoisuus voivat olla syynä huonoon konjugaatioon. Konjugoitu LS-C8580 osoittaa cd107a transfektoitujen solujen vähentyneen mutta spesifisen värjäytymisen (Kuva 2b), mutta kuten kuvassa 2a on esitetty, emme pystyneet havaitsemaan degranuloivia soluja funktionaalisten määritysten aikana tällä konjugaatilla. Yhteenvetona voidaan todeta, että SIM1 mAb nimenomaan tahraa rotan NK-solujen degranuloinnin kohdesoluilla tehtävän stimulaation jälkeen.

kuva 2. SIM1 mittaa degranulaatiota luonnollisesta tappajasta (nk) ja CD8 T-soluista. (A) degranuloivien solujen prosenttiosuus mitattiin anti-CD107a-vasta-aineilla SIM1, H4A3 ja LS-C8580, ja ärsykeenä oli YAC-1-kohdesoluja tai ei. Yksi edustava koe neljästä esitetään (B). BWZ.CD107a-LIPPUSOLULINJAN värjäys SIM1 -, H4A3 -, LS-C8580-tai ID48-vasta-aineklooneilla. VWZ.36 solua transfektoitu epäolennaisella lipulla merkityllä antigeenillä (BWZ.NKR-P1G-FLAG) otettiin mukaan negatiivisena kontrollina, C) rikastettuja NK-soluja stimuloitiin levyyn sitoutuneella anti-nkp46: lla, anti-NKR-P1A: lla tai hiiren IgG1: llä isotyyppikontrollina ja SIM1: tä käytettiin degranuloivien solujen prosenttiosuuden mittaamiseen. Nkp46+ (Wen23) tai NKR-P1Abright (3.2.3) – solut oli aidattu. (D) TCR+-solut lajiteltiin (puhtaus 99%) ja niitä viljeltiin IL-2: ssa 2-3 päivän ajan. Tämän jälkeen soluja stimuloitiin levyyn sitoutuneella anti-CD3: lla ja anti-CD2: lla tai hiiren IgM-ISOTYYPPIKONTROLLILLA anti-CD3: lle. Alapaneelissa näkyy stimulaatio anti-CD3-ja anti-CD2-valmisteilla ja värjäys SIM1-isotyyppikontrollilla (FITC hamster IgG polyclonal). T-solut lajiteltiin R73-Alexa647: n ja 3.2.3− PB-vasta-aineiden avulla, jolloin R73+/3.2.3-soluissa. Esitetyt tiedot ovat peräisin yhdestä edustavasta kokeesta kolmesta erillisestä itsenäisestä kokeesta.
aktivoivien NK-reseptorien suora stimulointi levyyn sitoutuneiden vasta-aineiden avulla on toinen voimakas menetelmä degranulaation indusoimiseksi. Testataksemme SIM1-kloonia tässä funktionaalisessa määrityksessä inkuboimme rikastettuja NK-soluja levyillä, jotka on päällystetty vasta-aineilla kohti aktivoivia reseptoreita NKp46 ja NKR-P1A (Kuva 2C). Negatiivisena torjuntana levyt päällystettiin hiiren IgG1-isotyyppiohjauksella. SIM1-vasta-aineella värjätyissä levyissä, jotka oli päällystetty 5 µg/ml anti-NKP46: lla tai anti-NKR-P1A: lla, tunnistettiin NK-solujen stimulaation jälkeen 25, 5% degranuloivista soluista tai 44% degranuloivista soluista. Degranuloivien solujen osuus kasvoi entisestään, kun levyt päällystettiin suuremmalla stimuloivien vasta-aineiden pitoisuudella (10 µg/ml). Degranulaatiota ei indusoitu hiiren IgG1-isotyyppiohjauksella päällystetyissä kaivoissa.
näimme selvästi degranulaation NK-soluissa, joita oli stimuloitu joko kohdesoluilla tai vasta-aineilla aktivaatioreseptoreita vastaan käyttämällä SIM1-vasta-ainettamme. Halusimme varmistaa tämän myös sytotoksisissa T-soluissa. T-soluja lajiteltiin pernasoluista ja viljeltiin IL-2: ssa 2-3 päivän ajan. Tämän jälkeen T-soluja stimuloitiin levyyn sitoutuneilla anti-CD3: lla ja anti-CD2: lla (Kuva 2D). Degranulaatio mitattiin viljellyistä CD8 + T-soluista, kun sitä stimuloitiin anti-CD3: lla ja anti-CD2: lla molempina päivinä 2 ja 3. Degranulaatiota ei mitattu ei-sytotoksisista CD4 T-soluista eikä isotyyppikontrollivasta-aineella tehdyn stimulaation jälkeen, mikä osoittaa edelleen SIM1-vasta-aineemme spesifisyyden.
Lymphokine-activated killer (LAK) cells created by culturing NK cells in IL-2 for 7-10 days and the used as very potent effector cells in Kromi release assays to study cytotoxicity and, so, should be able to generate high levels of degranulation. Mittaamaan degranulaatiota LAK-soluista käytimme aluksi 1:1 efektorin suhde kohteisiin, mutta havaittu odottamattoman Alhainen degranulaatio (tietoja ei näy). Kuitenkin, kun titrattiin optimaalisen efektori-tavoite-suhteen löytämiseksi, näimme, että degranulaatiotasoja voitiin lisätä, kun efektori-tavoite-suhde oli alle 1 (kuva 3A). Degranulaatiokokeiden optimaalinen suhde on siis päinvastainen kuin sytotoksisuuskokeiden, joissa sytotoksisuus lisääntyy suuremmilla efektori: tavoitesuhteilla (kuva 3B).
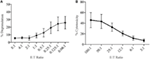
kuva 3. Matala efektori:tavoitesuhteet ovat tärkeitä riittävän herkkyyden varmistamiseksi degranulaatiokokeissa rotan NK-soluilla. (A) LAK-solujen degranulaatio, jota viljeltiin 8-10 päivää IL-2:ssa YAC-1-tavoitteita vastaan eri efektori: tavoitesuhteilla. B) Il-2-viljellyn LAK: n sytotoksisuus YAC-1-kohdesoluja vastaan vahvistettiin kromin vapautumiskokeella, joka valmistui päivinä 8-10. Kaikki graafit ovat kumulatiivisia kolmesta tai useammasta erillisestä kokeesta, joissa palkit osoittavat SD: tä.
Keskustelu
SIM1: n ja erilaisten kaupallisten CD107a-vasta-aineiden alustavassa testauksessa rotilla tehdyissä degranulaatiokokeissa valitsimme pienen efektori-tavoitesuhteen, jossa efektorisolut ovat nykykirjallisuuden perusteella (12, 16, 17) parempia kuin tavoitteet. Efektori – kohdesolu-suhde voi vaihdella paperista toiseen, mutta aiemmat tutkimukset, joissa efektori-kohdesuhde titrattiin, ovat osoittaneet, että optimaalinen degranulaatio hiiren NK-soluista saavutti huippunsa 4.5: 1 suhteessa YAC-1-kohdesoluihin (18) ja ihmisen NK-solut tappoivat k562-soluja parhaiten suhteessa 5:1 tai 10:1 (12). Kuitenkin käytettäessä suurempaa efektori-tavoitesuhdealuetta osoitamme, että degranulaatio rotan LAK-soluilla indusoitui tehokkaammin, kun käytettiin neljää tai useampaa kohdetta efektorisolua kohti. Tämä ero optimaalisessa efektori-kohdesuhteessa rotan ja muiden lajien välillä saattaa johtua käytettyjen kohdesolujen tyypistä, koska ihmisen ja hiiren efektori-kohdesuhteen titrauksissa käytettiin edellä mainituissa tutkimuksissa samasta lajista peräisin olevia kohdesoluja. Efektorisolut saattavat olla herkempiä saman lajin kohdesoluille ja tarvitsevat siksi vähemmän kohdesoluja aktivoituakseen. Tutkimuksessamme käytetty YAC-1-solulinja on hiiren T-solulymfooma, joka on ollut standardi jo vuosia rotan NK-solujen sytotoksisuuden stimuloimiseksi. Emme voi sulkea pois sitä mahdollisuutta, että rotan kohdesolun käyttäminen johtaisi NK-solujen voimakkaampaan stimulaatioon ja myöhemmin degranulaation aikaansaamiseksi tarvittaisiin vähemmän kohdesoluja.
tästä tutkimuksesta ilmenee myös, että sytotoksisuusmäärityksissä käytetyt efektori-kohde-suhde ei korreloi hyvin efektorisolujen optimaalisen degranulaatiovasteen mittaamiseen tarvittavien suhteiden kanssa. Tämä ei ole yllättävää, sillä näiden kahden määrityksen tulokset ovat erilaiset: sytotoksisuus mittaa kohdesolukuolemaa ja degranulaatio NK-vastetta kohteille.
yhteenvetona totean, että olemme nostaneet vasta-ainetta rotalle CD107a (SIM1) ja osoittaneet sen kyvyn havaita degranulaatio rotan sytotoksisissa lymfosyyteissä. Olemme osoittaneet, että SIM1 on spesifinen degranuloituville soluille, ja degranulaatioprotokollan optimoinnin avulla olemme määrittäneet, että käyttämällä efektoria:kohdesolusuhteita alle 1:4 takaavat LAK-solujen optimaalisen stimulaation. Rotan anti-CD107a: n (SIM1) kehittäminen mahdollistaa rotan lymfosyyttien sytotoksisten vasteiden paremman analysoinnin ja karakterisoinnin ja on arvokas työkalu rotan monissa tautimalleissa.
eettinen lausunto
tutkimus on Norjan kansallisen Eläintutkimusviranomaisen (FDU) hyväksymä (lupanumero: ID-1698).
Tekijäosuudet
AS on vastannut käsikirjoituksen ilmaisuanalyysistä, funktionaalisista määrityksistä ja kirjoittamisesta. K-ZD on suorittanut cDNA: n kloonauksen ja transfektanttien generoinnin. JTV on ollut mukana hankkeen suunnittelussa ja valvonnassa sekä käsikirjoituksen laatimisessa. LK on vastannut rokotuksista, hybridoma-teknologiasta, käsikirjoituksen kirjoittamisesta ja projektien valvonnasta.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
kiitokset
kirjoittajat kiittävät Ulla Heggelundia ja Stine Martinsenia teknisestä avusta laboratoriossa sekä Oslon yliopistollisen sairaalan Rikshospitaletin vertailevan lääketieteen laitoksen eläinsairaalan henkilökuntaa rokotusavusta. Kiitos Marit Inngjerdingen tieteellisistä keskusteluista.
rahoitusta
tutkimusta rahoittivat Oslon yliopisto, Kaakkois-Norjan alueellinen Terveys (2009104) ja Legatet til Henrik Homans Minde.
1. Orange JS. Lyytisen NK-solujen immunologisen synapsin muodostuminen ja toiminta. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038/nri2381
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Metkar SS, Marchioretto M, Antonini V, Lunelli L, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. Endosomikalvon perforiinihuokoset käynnistävät endosytosoituneen granzyme B: n vapautumisen kohdesolujen sytosoliin. Nat Immunoli (2011) 12(8):770-7. doi: 10.1038 / ni.2050
PubMed Abstract | CrossRef Full Text/Google Scholar
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforiini ja granzymes: toiminta, toimintahäiriö ja ihmisen patologia. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens a, Benestad HB, Vaage JT, et al. Toinen ennaltaehkäisevä MHC-epämuodostunut luuytimensiirto suojaa rotan akuuttia myelooista leukemiaa (BNML) vastaan ilman tappavaa käänteishyljintäsairautta. Elinsiirto (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Onishi M, Kinoshita S, Morikawa Y, Shibuya A, Phillips J, Lanier LL, et al. Retrovirusvälitteisen ilmaisukloonauksen Sovellukset. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Vähentynyt NK-solujen degranulaatio potilailla, joilla on usein toistuva herpes. Clin Vaccine Immunol (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed Abstract | CrossRef Full Text/Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Wood SM, Björkström NK, Long EO, et al. Funktionaalinen analyysi ihmisen NK-soluista virtaussytometrialla. Methods Mol Biol (2010) 612:335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
