yksilöllisen muodostumisen prosessi alkiosta
ihmisruumis koostuu kaikkiaan noin 60 biljoonasta solusta. Jokainen näistä soluista on lopulta peräisin yhdestä hedelmöittyneestä munasolusta, joka alkoi jakautua ja lopulta erilaistua somaattisiksi soluiksi, joilla on erilainen morfologia ja toiminta, jotka muodostavat ihmiskehon eri kudoksia ja elimiä. Pluripotenteilla kantasoluilla katsotaan olevan samanlainen potentiaali ilman ekstrembryonista erilaistumista.
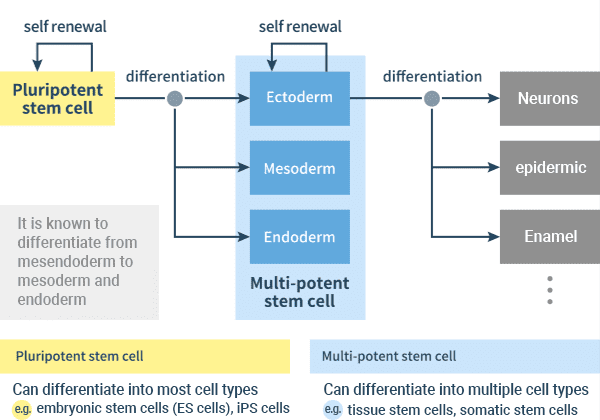
kuva: Kun eri kudossolutyypit indusoituvat pluripotenteista kantasoluista kolmen itukerroksen kautta
muodostettaessa yksilöä, kantasolut muuttuvat (erilaistuvat) soluiksi, jotka eroavat toisistaan säilyttäen samalla proliferaatiokyvyn jakautua ja luoda lisää samantyyppisiä soluja tai erilaistua edelleen erikoistuneempaan muotoon. Näin syntyy erilaisia elimiä.
blastokystivaiheessa, alkionkehityksen varhaisessa vaiheessa, on soluja, jotka kykenevät erilaistumaan lähes mihin tahansa solutyyppiin, joka muodostaa kehon, kyky tunnetaan pluripotentcy.In vitro, pluripotentit kantasolut mukaan lukien ES-ja iPS-solut voivat erilaistua solutyypeiksi, jotka ovat peräisin endodermin, mesodermin ja ektodermin, mutta eivät kykene kehittymään kokonaiseksi organismiksi yksin. Sen sijaan kantasoluja, jotka pystyvät erilaistumaan vain rajalliseksi määräksi solutyyppejä, kuten kudoksen kantasoluja ja somaattisia kantasoluja, kutsutaan multipotenteiksi kantasoluiksi.
näitä soluja käytetään paitsi perustutkimukseen, jossa ne eriytetään erityissoluiksi niiden ominaisuuksien tutkimista varten, myös ”lääkeainelöytöjen seulontaan” lääkeaihioiden etsimiseen, ja ”regeneratiiviseen lääketieteeseen”, jossa niitä siirretään tai annetaan potilaille terapeuttisena aineena. Pluripotenttien kantasolujen viljely eroaa kuitenkin monin tavoin perinteisestä somaattisesta soluviljelmästä, ja sen sanotaan olevan vaikeaa ylläpitää erilaistumatonta tilaa ja varmistaa korkea toistettavuus.
Multipotenttien kantasolujen ja pluripotenttien kantasolujen luokitus ja ominaisuudet
Multipotenttien kantasolujen
Multipotenttien kantasolujen kyky erilaistua soluiksi, jotka koostuvat tietyistä kudoksista ja elimistä ja joihin kuuluu sekä kudoksen kantasoluja että somaattisia kantasoluja.
kudoksen kantasolut ovat kudosspesifisiä, ja niillä on kyky joko uusiutua itsestään jakautumalla samankaltaisiin tytärsoluihin tai erilaistua erikoistuneemmiksi soluiksi kudoksen sisällä.
somaattiset kantasolut ovat olemassa vivo ja voivat erilaistua rajalliseksi määräksi solutyyppejä. Mesenkymaaliset kantasolut (MSCs), ovat eräänlainen somaattisten kantasolujen, ja voi erilaistua luun, rusto, verisuonet, ja kardiomyosyyttejä. MSC: t saadaan suhteellisen helposti luuytimestä, napanuoran kudoksesta, napanuoran verestä ja rasvakudoksesta.
Multipotenteilla kantasoluilla on raportoitu olevan anti-inflammatorinen vaikutus, kasvutekijöitä indusoiva vaikutus, proangiogeneettinen vaikutus ja niillä on tärkeä rooli kudosten korjaamisessa. Lisäksi niillä sanotaan olevan pienempi peruutusriski kuin pluripotenteilla kantasoluilla, mikä on tärkeä turvallisuusnäkökohta.
uusiutuvia lääkkeitä on jo hyväksytty maailmanlaajuisesti selkäydinvamman ja hematopoieettisen kantasolusiirron jälkeisen akuutin käänteishyljintäsairauden hoitoon.
taulukko: Examples of Approved Regenerative Medical Products That Use Human MSCs in the World-
| Regenerative Medical Products | Approved Countries | Manufacturing Distributors | Origin MSC | Applications |
|---|---|---|---|---|
| PROCHYMAL® | Canada, New Zealand | Mesoblast | Allogeneic bone marrow-derived MSC | Acute GVHD*(pediatric) |
| TEMCELL® HS Inj. | Japan | JCR Pharma | Allogeneic bone marrow-derived MSC | Acute GVHD* |
| Stemirac® Inj. | Japan (conditional approval) | Nipro | Autologous bone marrow-derived MSC | Spinal cord injury |
| Heartcellgram-AMI® | South Korea | Pharmicell | Autologous bone marrow-derived MSC | Acute myocardial infarction |
| Cupistem® | South Korea | Anterogen | MSC derived from own fat | Crohn’s disease |
| CARTISTEM® | South Korea, EU | Medipost | Allogeneic cord blood-derived MSC | Knee osteoarthritis |
| Stempeucel® | EU, India (conditional approval) |
Stempeutics Research |
Allogeneic bone marrow-derived MSC | Knee osteoarthritis |
| Allostem® | USA | Allosource | Allogeneic fat derived MSC (A combination product composed of human demineralized bone matrix) |
Bone damage |
| Osteocel® Plus | US | NuVasive | Allogeneic bone marrow-derived MSC (A combination product composed of osteoprogenitor cells and human demineralized bone matrix) |
Bone repair (361HCT/P) |
*GVHD: Käänteishyljintä Versus Isäntäsairaus
pluripotentit kantasolut
pluripotentit kantasolut ovat kantasoluja, jotka voivat erilaistua lähes miksi tahansa soluksi, joka muodostaa elimistön. TSK: t, alkion sukusolut (EGC) ja IPSC: t ovat toistaiseksi vakiintuneet pluripotenttien kantasolujen tyypeiksi.
ESC: t muodostuvat onton blastokystan sisäsolumassasta, joka on alkionkehityksen varhainen vaihe tsygootin jakauduttua blastulaksi. Japanissa ES-solut perustetaan hedelmöittyneiden munasolujen ylijäämävarastosta, joka hylätään hedelmättömyyshoidon jälkeen. EGC: t ovat kehittyneet sperman ja munasolujen solujen esiasteista (esiasteiset sukusolut), ja niillä on lähes samat ominaisuudet kuin ESC: llä.
IPSC: t syntyvät ohjelmoimalla somaattiset solut erilaistumattomaan tilaan tiettyjen geenien käyttöönoton kautta. IPSCs: n perustaminen on mahdollistanut TSK: n kaltaisten solujen hankkimisen luovuttajilta. On myös mahdollista saada potilaan toimittamaa kudosta, luoda ipscs kudoksesta ja indusoida erilaistumista, jotta saadaan anin vitro-malli taudista. Siksi somaattisilla soluilla, kuten hermosoluilla tai kardiomyosyyteillä, jotka on luotu ipscs: n indusoidulla erilaistumisella, on suuri potentiaali sovellutuksiin, kuten sairauden etiologian määrittämiseen, lääkkeiden tehon ja sivuvaikutusten arviointiin ja potilaan siirtämiseen regeneratiivisina lääkehoitoina. Tahattomia geenimutaatioita on kuitenkin raportoitu IPSC-kulttuurien perustamisen yhteydessä sekä IPSC-ja Esc-järjestelmien alakasvatuksessa pitkiä aikoja. Tällä hetkellä ei tiedetä, ovatko kaikki nämä geneettiset mutaatiot vaarallisia, ja tutkijat keskustelevat siitä, miten niiden turvallisuutta voidaan parhaiten arvioida käytännön käyttöä varten tulevaisuudessa.
