Introduction
Cell or tissue renewation and regeneration ovat kaksi tärkeintä aikuisten organismien kehitysvaatimusta. Molemmissa prosesseissa lähtökohtana on kantasolupopulaatio, joka tavallisesti sijaitsee tietyssä ympäristössä, jota kutsutaan ”kapeaksi”, ja joka antaa niille tarvittavat signaalit varren ominaisuuksien ylläpitämiseksi tai eriytymiseksi vaadittuihin eri solutyyppeihin (Kuva 1). Stemcell proliferaatio ja erilaistuminen on sovitettava yhteen niiden solujen kuoleman kanssa, jotka on korvattava. Lisäksi prosessit, kuten solujen muuttoliike, epigenetiikka ja soluviestintä,ovat myös välttämättömiä solujen kunnollisen uusiutumisen kannalta . Nopea uusiutuminen voidaan tunnistaa korkeammasta mitoottisesta aktiivisuudesta. Vastaavasti hidas uudistuminen kudokset sisältävät vähemmän mitoosia, eikä sitä välttämättä tunnisteta helposti uusimattomilta alueilta, jotka voivat myös esittää somemitoosia . Kantasolujen kohtalonpäätökset proliferaation aikanaoikea vaikutus kudosten uudistumiseen ja homeostaasiin. Siksi tasapainoista jakautumista ja eriyttämistä ylläpitävien sääntelymekanismien ymmärtäminen on ratkaisevan tärkeää. Solunulkoiset signaalit (esim.kudoksen mikroympäristö, solunsisäinen ROS ja sytokiinit) sekä solunsisäiset tekijät (esim. epigeneettiset koneet, transkriptiotekijät ja DNA-vauriovaste) ovat vastuussa kantasolujen jakautumisen säätelystä.
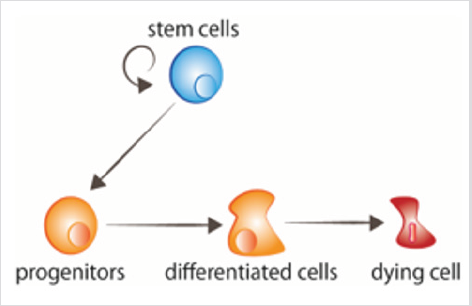
kuva 1: solujen vaihtuminen kantasolut lisääntyvät, jolloin kantasolut saavat sen jälkeen erilaistumissignaaleja. Ikääntyneet solut saavat signaaleja kuolemaan.
kantasoluissa on kolme mahdollista jakovaihtoehtoa: epäsymmetrinen jako, jossa yksi kantasolu ja yksi sitoutuva tytärsolu ovat syntyneet; symmetrinen sitoutuminen, joka koskee kahta sitoutunutta tytärsolua; ja symmetrinen jako,joka tuottaa kaksi tytärsolua, jotka säilyttävät kantasolujen ominaisuudet kuviossa 2. Vaikka voidaan ennustaa, että asymmetrinen jakaantuminen on ainoa mekanismi, joka mahdollistaa kantasolupopulaation säilymisen vakaana, lineaarisista tutkimuksista saadut tämänhetkiset tiedot osoittivat, että useimmissa kudoksissa kantasolujen proliferaation ja differentiaalisen alkulähteen syntymisen välinen tasapaino saavutetaan koko kantasolupopulaation tasolla.Erilaistumisesta tai soluvaurioista johtuva kantasolujen häviäminen saa aikaan tämän aukon täyttämisen . Kantasolujen jakautumisen jälkeen erilaistumisprosessia seuraavat solut kulkevat eri vaiheissa, jotka on määritelty sellaisten transkriptiotekijöiden yhdistelmällä, jotka säätelevät geenien sopivan repertuaarin toimintaa ja mahdollistavat niiden sitoutumisen ja terminaalisen erilaistumisen. Kunkin solulinjan osalta päätöksentekojärjestyksen lopputuote on erityinen erilaistunut solutyyppi Kuva 3a.useimmissa tapauksissa solulinjan identiteetti – normaalin erilaistumisen tuote – on vakaa kudoksissa,ja sen säilyminen on ratkaisevan tärkeää normaalin kudostoiminnan kannalta. Stabiilisuus saavutetaan epigeneettisellä säätelyllä – esimerkiksi histonidemetylaatiolla ja asetylaatiolla-joka johtaa kudosspesifisten geeniekspressioiden periytymiseen.
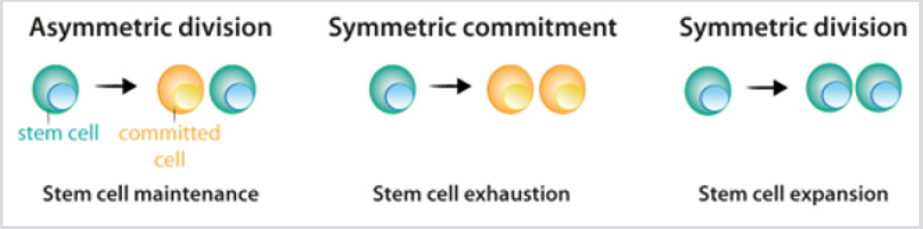
kuva 2: kantasolujen Jakautumistapa.
a) epäsymmetrisen jakautumisen aikana kantasolut synnyttävät yhden kantasolun, joka ylläpitää kantasolupopulaatiota, ja yhden solun, joka sitoutuu erilaistumiseen.
b) symmetrisen sitoutumisen aikana kantasolujen jakautumisesta syntyy kaksi tytärsolua, jotka sitoutuivat erilaistumiseen.
c) symmetrisessä jakautumisessa kantasolujen jakautumisesta syntyy kaksi kantasolua. Kuten tekstissä selitetään, nykyinen kokeellinen tieto osoittaa, että nämä kolme jakotilaa voivat tapahtua kantasolupopulaation säilyttäen.
solun identiteetti voi kuitenkin hävitä. Itse asiassa Drosophila imaginal disc-solut pystyvät transdeterminoimaan ja hankkimaan uuden aikuisen kohtalon elinsiirron jälkeen . Tässä tilanteessa solunulkoiset vihjeet näyttävät uudelleenohjelmoivan joitakin esiasteita tai erilaistuneita soluja saadakseen joko stemmatilan tai uuden erilaistuneen tilan ominaisuudet. On olemassa kaksi mekanismia, joiden avulla solu voi muuttaa identiteettiään: dedifferentiaatio ja transdifferentiaatio. Differentiaatiolla tarkoitetaan prosessia, jolla erilaistunut tai sitoutunut solu hankkii vähemmän kypsän solun 3b ominaispiirteet. Dramaattisin esimerkki dedifferentiaatiosta on terminaalisesti erilaistuneiden solujen in vitro muuttuminen pluripotenteiksi soluiksi (indusoidut pluripotentsteemisolut, iPSCs) rajallisen määrän transcriptiotekijöiden yliekspressiolla . Transdifferentiaatio sitä vastoin tapahtuu, kun erilaistunut solu muuttaa transkriptioohjelmaansa ja muuntuu toiseksi erilaistuneeksi solutyypiksi. Prosessi voi tapahtua välivaiheen dedifferentiaatiovaiheen kautta kohti alessakypsymisvaihetta ennen muuntumista uuteen differentioituneeseen soluun tai suoraan ilman välivaiheen lukua 3c-D. fibroblastien suora muuntuminen myoblasteiksi myodin ulkoloisekspressiolla on esimerkki toisesta prosessista .
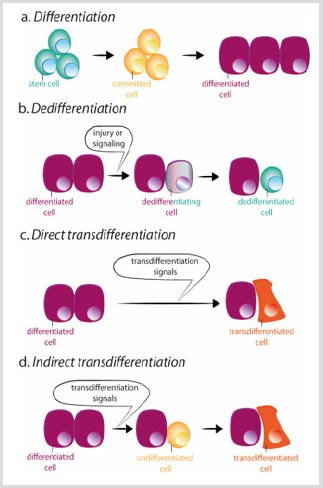
kuva 3: themes of differentation, dedifferentiation and trans differentation.
a) normaalin erilaistumisen aikana kantasolut synnyttävät sitoutuneita soluja, jotka puolestaan erilaistuvat eri solutyypeissä.
b) erilaistuminen tarkoittaa kantasolujen ominaisuuksien hankkimista erilaistuneen solun avulla. Transerottuminen voi tapahtua suoralla tai epäsuoralla tavalla.
c) suoran trans-erilaistumisen aikana erilaistunut solu hankkii toisen solutyypin transkriptioohjelman, joka yleensä liittyy eksokriinisesti endokriinisiin haimasoluihin ja muuttuu erilaistuneeksi soluksi.
d) epäsuoran Trans-differentiaation aikana erilaistunut solu differentioituu ennen toisen solutyypin uuden transkription käyttöönottoa.
Dedifferentiaatio ja transdifferentiaatio tapahtuvat myös luonnollisella tavalla vamman tai kudoshäviön seurauksena .Dedifferentiation, esimerkiksi, tapahtuu luonnollisesti limbregnation urodele sammakkoeläinten. Jälkeen raajan amputaatio, viereiset solut haavan dédifferentiate, muodostaen blastema that consists of differentiated soluja, jotka lisääntyvät ja lopulta, redifferentiate osaksi samaa solutyyppiä luoda kaikki osat kadonneen raajan. Luonnollinen transdifferentaatio tapahtuu epäsuorasti: ensin solu dedifferentiates, ja sitten luonnollinen kehitysohjelma aktivoituu, jolloin solu erilaistuu uuteen sukuun. Tsonis ja yhteistyökumppanit kuvattu naturalmechanism transdifferentiation in a newt. He havaitsivat, että kun solut poistetaan, pigmentoituneet epiteelisolut dorsaalisesta iristrans differentiate, ja uudistaa puuttuva kudos. Tämän saavuttamiseksi pigmentoitujen epiteelisolujen on ensin dédifferentiate andproliferate luodakseen uusia linssisoluja ja sitten erilaistuttava linssin ominaissoluiksi . Molemmissa tilanteissa-differentiaatio ja uudelleendifferentiaatio samaan solutyyppiin tai transdifferentiaatio uuteen solutyyppiin-monimutkainen signalointireittien verkosto voi ohjata kunkin solun saavuttamaa transkriptioohjelmaa tiettynä ajankohtana.
hus, geeniekspression spatiotemporaalista säätelyä tarvitaan jatkuvasti eläinten homeostaasin aikana ja aregeneratiivisen prosessin aikana. Uudistumisen aikana solujen on kuitenkin sopeuduttava uuteen tilanteeseen, mikä edellyttää parempia päätöksiä solutasolla, mukaan lukien usein defferentiation-ja transderentiation-prosessit, jotka ovat kotioloissa harvassa.
- Klevers H, Loh KM, Nusse R (2014) Stem cell signaling. Integroitu ohjelma kudosten uudistamiseen ja uudistamiseen WNT-signalointiin ja stemcell-ohjaukseen. Science 346(6205): 1-9.
- Leblond C P, Walker B (1956) Renewal of cell population 36(2): 255-276.
- Roostaee A, Benoit YD, Boudjadi S, Beaulieu JF (2016) epigenetiikka ruoansulatuskanavan epiteelisolun uudistumisessa. J-Solufysioli 231 (11): 2361-2367.
- Ito K, Ito K (2016) Metabolism and the Control of Cell Fate Decisions andStem Cell Renewal. Annu Rev Cell Dev Biol 32: 399-409.
- Simons BD, Clevers H (2011) Strategies for homeostatic stem cell selfrenewalin adult kudoksia. Cell 145 (6): 851-862.
- Yang Y, Akinci E, Dutton JR, Banga A, Slack JM W, et al. (2013) vaiheittainen hiiren alkion maksasolujen uudelleenohjelmointi beetasolun kaltaiseksi. Mech Dev 130(11-12): 602-612.
- Merrell AJ, Stanger BZ (2016) Adult cell plasticity in vivo: dedifferentiation and transdifferentiation are back in style. Nat Rev MolCell Biol 17 (7): 413-425.
- Worley MI, Setiawan L, Hariharan IK (2012) Regeneration andtransdetermination in Drosophila imaginal discs. Annu Rev Genet 46: 289-310.
- Raff M (2003) Adult Stem Cell Plasticity: Fact or Artifact? Annu Rev CellDev Biol 19: 1-22.
- Takahashi K, Yamanaka S (2006) Induction of Pluripotent Stem cells from Mouse Embryonic and Adult Fibroblast Cultures by DefinedFactors. Cell 126 (4): 663-676.
- Tapscotr SJ, Davis RL, Thayer MJ, Cheng PF, Weintraub H, et al. (1988) MyoDi: a Nuclear Phosphoprotein Reqiring a Myc Homology Region to convert Fibroblasts to Myoblasts. Science 242(4877): 405-411.
- Jopling C, Boue s, Izpisua Belmonte JC (2011) Dedifferentiation,transdifferentiation and regramming: three routes to regeneration.Nat Rev Mol Cell Biol 12 (2): 79-89.
- Tsonis PA, Madhavan M, Tancous EE, Del Rio-Tsonis K (2004) Del Rio-Tsonis, K. A newt s eye view of lens regeneration. Int J Dev Biol 48 (8-9): 975-980.
