oppimistavoitteet
- Kirjoita kemiallinen kaava yksinkertaiselle ioniyhdisteelle.
- tunnistaa polyatomiset ionit kemiallisissa kaavoissa.
olemme jo törmänneet joihinkin yksinkertaisten ioniyhdisteiden kemiallisiin kaavoihin. Kemiallinen kaava on tiivis luettelo yhdisteen alkuaineista ja näiden alkuaineiden suhdeluvuista. Jotta ymmärtäisimme paremmin, mitä kemiallinen kaava tarkoittaa, meidän on pohdittava, miten ioniyhdiste muodostuu sen ioneista.
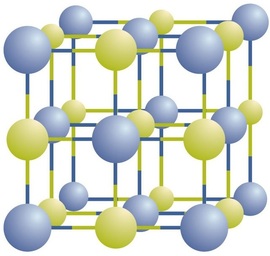
Ioniyhdisteet esiintyvät vuorottelevina positiivisina ja negatiivisina ioneina säännöllisissä, kolmiulotteisissa matriiseissa, joita kutsutaan kiteiksi (Kuva \(\PageIndex{1}\)). Kuten näette, jonossa ei ole yksittäisiä \(\ce{NaCl}\) ”hiukkasia”, vaan vuorottelevien natrium-ja kloridi-ionien jatkuva hila. Yhdistettä voidaan kuitenkin kuvata natriumionien ja kloridi-ionien suhteella, joka on ilmaistu pienimmillä mahdollisilla kokonaisluvuilla. Natriumkloridin tapauksessa natriumionien ja kloridi-ionien suhde pienimpinä kokonaislukuina ilmaistuna on 1:1, joten käytämme \(\ce{NaCl}\) (yksi \(\ce{Na}\) symboli ja yksi \(\ce{Cl}\) symboli) edustamaan yhdistettä. Siten \(\ce{NaCl}\) on natriumkloridin kemiallinen kaava, joka on ytimekäs tapa kuvata yhdisteen eri ionien suhteellista määrää. Makroskooppinen näyte koostuu myriadeista NaCl-pareista; jokaista yksittäistä paria kutsutaan kaavayksiköksi. Vaikka on kätevää ajatella, että \(\ce{NaCl}\) kiteet koostuvat yksittäisistä \(\ce{NaCl}\) yksiköistä, Kuva \(\PageIndex{1}\) osoittaa, ettei yksikään yksittäinen ioni liity yksinomaan mihinkään muuhun yksittäiseen ioniin. Jokaista Ionia ympäröivät vastakkaisvarauksiset ionit.
ioniyhdisteen kaava noudattaa useita konventioita. Ensinnäkin kationi on kirjoitettu ennen anionia. Koska useimmat metallit muodostavat kationeja ja useimmat epämetallit muodostavat anioneja, kaavoissa luetellaan tyypillisesti ensin metalli ja sitten Epämetalli. Toiseksi syytteitä ei ole kirjoitettu kaavalla. Muista, että ioniyhdisteessä komponenttilajit ovat ioneja, eivät neutraaleja atomeja, vaikka kaava ei sisällä varauksia. Lopuksi oikea kaava ioniyhdisteelle on aina nollavaraus, eli positiivisen kokonaisvarauksen on oltava yhtä suuri kuin negatiivisen kokonaisvarauksen. Määrittää oikea kaava tahansa ioniyhdistelmän, määrittää, kuinka monta kutakin Ionia tarvitaan tasapainottamaan yhteensä positiivisia ja negatiivisia varauksia yhdisteen.
tämä sääntö perustuu viime kädessä siihen, että aine on kaiken kaikkiaan sähköisesti neutraali.
konventiolla oletetaan, että atomia on vain yksi, jos alaindeksiä ei ole. Emme käytä 1: tä alaindeksinä.
Jos tarkastelemme litiumioneista ja bromidi− ioneista koostuvaa ioniyhdistettä, näemme, että litiumionilla on 1+ varaus ja bromidi-ionilla 1-varaus. Näiden varausten tasapainottamiseen tarvitaan vain yksi ioni kutakin. Litiumbromidin kaava on \(\ce{LiBr}\).
kun magnesiumista ja hapesta muodostuu ioniyhdiste, magnesiumionilla on 2+ varaus ja happiatomilla 2− varaus. Vaikka molemmilla ioneilla on suuremmat varaukset kuin litiumbromidin ioneilla, ne tasapainottavat silti toisiaan yksi-yksi-suhteessa. Siksi tämän ioniyhdisteen oikea kaava on \(\ce{MgO}\).
tarkastellaan nyt magnesiumin ja kloorin muodostamaa ioniyhdistettä. Magnesiumionilla on 2+ varaus, kun taas kloori-ionilla on 1-varaus:
\
yhdistämällä yksi ioni kustakin ei täysin tasapainota positiivisia ja negatiivisia varauksia. Helpoin tapa tasapainottaa nämä varaukset on olettaa, että jokaista magnesiumionia kohti on kaksi kloridi-Ionia:
\
nyt positiiviset ja negatiiviset varaukset ovat tasapainossa. Voisimme kirjoittaa tämän ioniyhdisteen kemiallisen kaavan \(\ce{MgClCl}\), mutta konventio on käyttää numeerista alaindeksiä, kun on enemmän kuin yksi tietyn tyypin ioni—\(\ce{MgCl2}\). Tämän kemiallisen kaavan mukaan tässä kaavassa on yksi magnesiumioni ja kaksi kloridi-Ionia. (Älä lue kaavan ”Cl2” – osaa diatomisen alkuaineen kloorin molekyylinä. Klooria ei esiinny tässä yhdisteessä diatomisena alkuaineena. Sen sijaan se esiintyy kahtena yksittäisenä kloridi-ionina.) Konventionaalisesti alinta kokonaislukusuhdetta käytetään ioniyhdisteiden kaavoissa. Kaavalla \(\ce{mg2cl4}\) on tasapainotettu varaukset ionien kanssa suhteessa 1:2, mutta se ei ole pienin kokonaislukusuhde.
yhdisteille, joissa ionien suhde ei ole yhtä ilmeinen, voidaan kaavan alaindeksit saada risteyttämällä varauksia: käytetään varauksen itseisarvoa yhdelle Ionille kuin alaindeksiä toiselle Ionille. Tämä menetelmä esitetään kaavamaisesti Kuvassa 3.3.2.
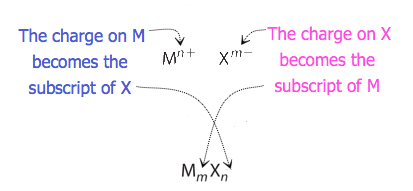
risteytettäessä varauksia joudutaan joskus lyhentämään alaindeksit yksinkertaisimpaan suhteeseensa empiirisen kaavan kirjoittamiseksi. Tarkastellaan esimerkiksi PB4+: n ja O2−: n muodostamaa yhdistettä. Käyttämällä ionien varausten itseisarvoja alaindekseinä saadaan formula_2o4. Tämä yksinkertaistuu oikeaan empiiriseen formula_2: een. Empiirisessä kaavassa on yksi PB4+− ioni ja kaksi O2-Ionia.
esimerkki \(\PageIndex{1}\)
kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- natriumioni ja rikki− ioni
- 3+ rauta-ioni ja happi-ioni
alumiini-ioni ja fluoridi-ioni
liuos
- valenssikuorioktetin saamiseksi natrium muodostaa ionin, jolla on 1+ varaus rikki-ionissa taas on 2-varaus. Rikki− ionin 2-varauksen tasapainottamiseen tarvitaan kaksi natrium-1+ – Ionia. Sen sijaan, että kirjoittaisimme kaavan \(\ce{NaNaS}\), lyhennämme sen konventiolla muotoon \(\ce{Na2S}\).
- alumiini− ionilla on 3+ varaus, kun taas fluorin muodostamalla fluoridi-ionilla on 1-varaus. Alumiini− ionin 3+ – varauksen tasapainottamiseen tarvitaan kolme fluori-1-Ionia. Tämä yhdistelmä kirjoitetaan \(\ce {AlF3}\).
- rauta voi muodostaa kaksi mahdollista Ionia, mutta tässä on määritelty ioni, jonka varaus on 3+. Happiatomilla on ionina 2-varaus. Tasapainottamaan positiivisia ja negatiivisia maksuja, katsomme vähiten yhteinen Useita-6: kaksi rauta 3 + ioneja antaa 6+, kun taas kolme 2-happi ioneja antaa 6 -, mikä tasapainottaa yleistä positiivinen ja negatiivinen maksuja. Näin tämän ioniyhdisteen kaava on \(\ce{Fe2O3}\). Vaihtoehtoisesti käytetään kuvassa 3.3.2 esitettyä ylitysmaksujen menetelmää.
Exercise \(\PageIndex{1}\)
kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- kalsiumioni ja happi-ioni
- 2+ kupari-ioni ja rikki-ioni
- 1+ kupari-ioni ja rikki-ioni
vastaus A:
CaO
vastaus b:
CuS
Vastaus c:
Cu2S
Polyatomiset ionit
jotkut ionit koostuvat atomiryhmistä, jotka ovat kovalenttisesti sitoutuneet toisiinsa ja joilla on yleinen sähkövaraus. Koska nämä ionit sisältävät enemmän kuin yhden atomin, niitä kutsutaan polyatomisiksi ioneiksi. Joidenkin polyatomisten ionien Lewis-rakenteet, nimet ja kaavat löytyvät taulukosta 3.3.1.
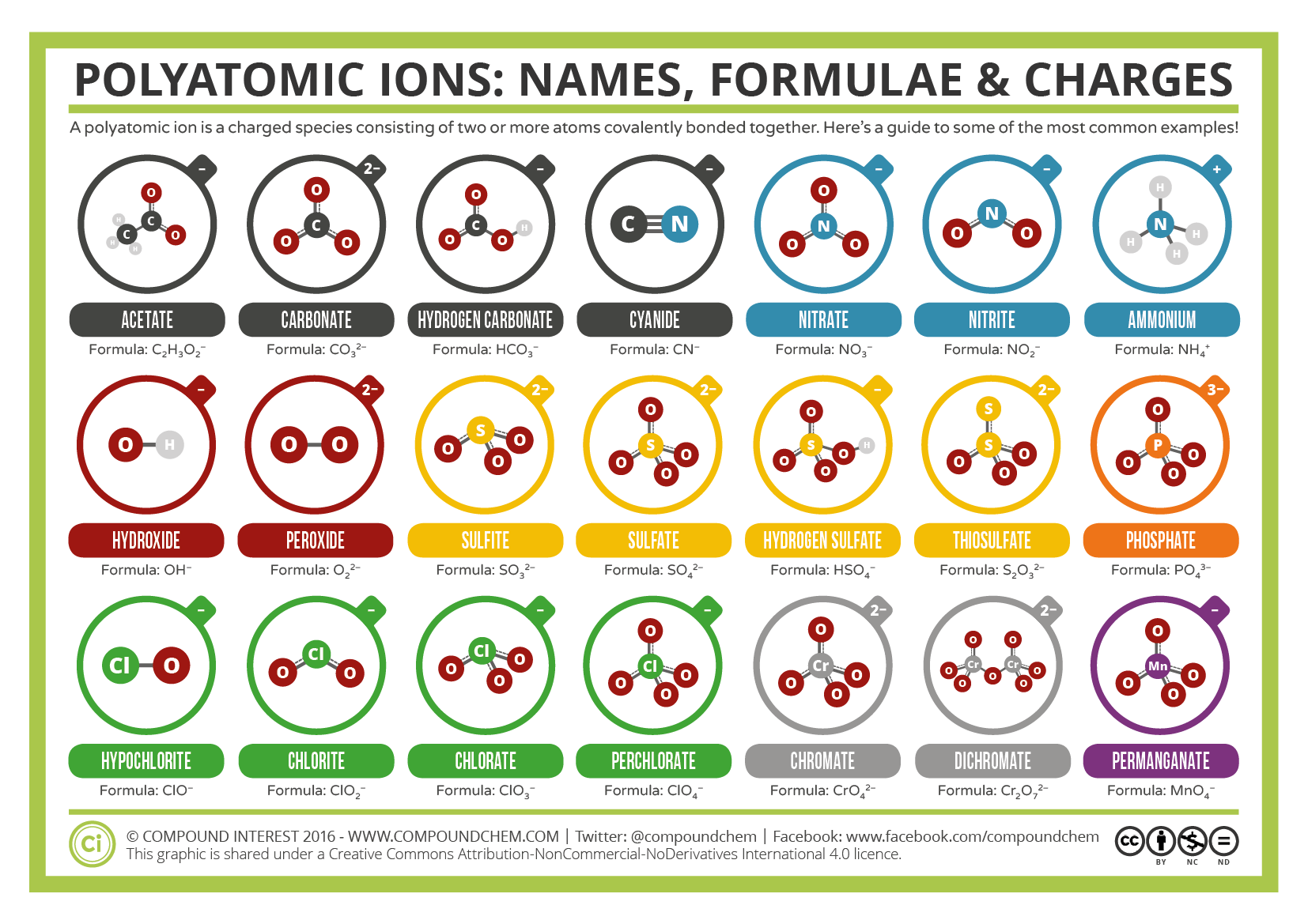
taulukko \(\PageIndex{1}\): joillekin Polyatomisille ioneille
Polyatomisille ioneille on määritelty kaavoja, nimiä ja varauksia, joita ei voi muuttaa millään tavalla. Taulukossa \(\PageIndex{2}\) luetellaan tavallisimpien polyatomisten ionien nimet ja ionikaavat. Esimerkiksi \(\ce {NO3^ { – }}\) on nitraatti− ioni; sillä on yksi typpiatomi ja kolme happiatomia ja yleinen 1-varaus. Kuvassa \(\PageIndex{2}\) luetellaan yleisimmät polyatomiset ionit.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. Jäljelle jääneet polyatomiset ionit ovat kaikki negatiivisesti varautuneita, minkä vuoksi ne luokitellaan anioneiksi. Näistä kuitenkin vain kaksi, hydroksidi-ioni ja syanidi-ioni, on nimetty käyttäen ”-ide” – päätettä, joka tyypillisesti viittaa negatiivisesti varautuneisiin hiukkasiin. Loput polyatomiset anionit, jotka kaikki sisältävät happea yhdessä toisen epämetallin kanssa, ovat olemassa osana sarjaa, jossa oksidien määrä polyatomisessa yksikössä voi vaihdella. Kuten tämän tekstin useissa kohdissa on toistuvasti korostettu, millään kahdella kemiallisella kaavalla ei pitäisi olla yhteistä kemiallista nimeä. Yksi pääte,”- ide”, ei riitä erottamaan anionien nimiä toisiinsa liittyvässä polyatomisessa sarjassa. Tämän vuoksi käytetään”- ate ”- ja” – ite ” – suffikseja, joiden tarkoituksena on osoittaa, että vastaavat polyatomiset ionit ovat osa sarjaa. Lisäksi nämä loppuliitteet osoittavat myös polyatomisten ionien sisältämien oksidien suhteellisen määrän. Huomaa, että kaikki polyatomiset ionit, joiden nimet päättyvät ”-ate”: iin, sisältävät yhden hapen enemmän kuin ne polyatomiset anionit, joiden nimet päättyvät ”-ite: hen.”Valitettavasti, kuten yleinen siirtymämetallien nimeämisjärjestelmä, nämä loppuliitteet osoittavat vain polyatomisten ionien sisältämien oksidien suhteellisen määrän. Esimerkiksi nitraatti-ionissa, jota symboloi no3−1, on yksi happi enemmän kuin nitriitti−ionissa, jota symboloi no2-1. Sulfaatti-ioni merkitään kuitenkin SO4−2: ksi. Vaikka sekä nitraatti-ionilla että sulfaatti-ionilla on yhteinen ”- ate” – pääte, edellinen sisältää kolme oksidia, mutta jälkimmäinen neljä. Lisäksi sekä nitraatti-ioni että sulfiitti-ioni sisältävät kolme oksidia, mutta näillä polyatomisilla ioneilla ei ole yhteistä päätettä. Valitettavasti näiden jälkiliitteiden suhteellinen luonne pakottaa siihen, että polyatomisten ionien ionikaava/ionin nimiyhdistelmät on yksinkertaisesti opeteltava ulkoa.
polyatomisia ioneja sisältävien ioniyhdisteiden kaavojen rakentamissääntö on sama kuin yksiatomisia (yksiatomisia) ioneja sisältävien kaavojen: positiivisten ja negatiivisten varausten on oltava tasapainossa. Jos varauksen tasapainottamiseen tarvitaan useampi kuin yksi tietystä polyatomisesta ionista, koko polyatomisen ionin kaava on suljettava sulkuihin ja numeerinen alaindeksi on sijoitettu sulkujen ulkopuolelle. Tällä halutaan osoittaa, että alaindeksi pätee koko polyatomiseen ioniin. Alla on kaksi esimerkkiä:

esimerkki \(\PageIndex{2}\)
kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- kaliumionin ja sulfaatti−ionin
- kalsiumionin ja nitraatti-ionin
- kaliumionien varaus on 1+, kun taas sulfaatti-ionien varaus on 2 -. Sulfaatti-ionin varauksen tasapainottamiseen tarvitaan kaksi kaliumionia, joten oikea Kemiallinen kaava on \(\ce{K_2SO_4}\).
- kalsiumionien varaus on 2+, kun taas nitraatti−ionien varaus on 1 -. Tarvitsemme kaksi nitraatti-Ionia tasapainottamaan kunkin kalsiumionin varausta. Nitraatin kaava on merkittävä sulkuihin. Täten kirjoitamme \(\ce {Ca (No3) 2}\) tämän ioniyhdisteen kaavaksi.
liuos
Exercise \(\PageIndex{2}\)
kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- magnesiumioni ja karbonaatti – ioni
- alumiini – ioni ja asetaatti-ioni
vastaus A:
Mg2+ ja CO32 – = MgCO3
vastaus b:
Al3+ ja c2h3o2 – = Al(C2H3O2)3
ioniyhdisteiden tunnistamiseen
ioniyhdisteiden tunnistamiseen on kaksi tapaa. Ensinnäkin metalli-ja epämetallielementtien väliset yhdisteet ovat yleensä ionisia. Esimerkiksi CaBr2 sisältää metallisen alkuaineen (kalsium, ryhmän 2A metalli) ja epämetallisen alkuaineen (bromi, ryhmän 7A Epämetalli). Siksi se on mitä todennäköisimmin ioniyhdiste. (Itse asiassa se on ioninen.) Sen sijaan yhdiste NO2 sisältää kaksi alkuainetta, jotka ovat molemmat epämetalleja (typpi ryhmästä 5A ja happi ryhmästä 6A). Se ei ole ioniyhdiste, vaan kuuluu muualla käsiteltävien kovalenttisten yhdisteiden luokkaan. Huomaa myös, että tämä typen ja hapen yhdistelmä ei ole määritelty sähkövaraus, joten se ei ole nitriitti-ioni.
toiseksi, jos tunnistaa yhdisteessä olevan polyatomisen ionin kaavan, yhdiste on ioninen. Esimerkiksi jos näet kaavan \(\ce{ba (NO3) 2}\), voit tunnistaa ”NO3″−osan nitraatti-ioniksi, \(\rm{NO_3^ -}\). (Muista, että ioniyhdisteiden kaavojen kirjoituskonventio ei sisällä ionivarausta.) Tämä on vihje siitä, että kaavan toinen osa, \(\ce{Ba}\), on itse asiassa \(\ce{Ba^{2+}}\) ioni, jossa 2+ varaus tasapainottaa kahden nitraatti− ionin kokonaisvarausta 2. Näin ollen myös tämä yhdiste on ioninen.
esimerkki \(\PageIndex{3}\)
tunnista jokainen yhdiste ioniseksi tai ei ioniseksi.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4CL}\)
- \(\ce{OF2}\)
ratkaisu
- natrium on metalli ja happi Epämetalli; siksi \(\ce{Na2O}\) oletetaan olevan ioninen.
- sekä fosfori että kloori ovat epämetalleja. Siksi \(\ce{PCl3}\) ei ole ioninen.
- \(\ce{NH4}\) kaavassa edustaa ammoniumionia, \(\ce{NH4^{+}}\), mikä osoittaa tämän yhdisteen olevan ioninen.
- sekä happi että fluori ovat epämetalleja. Siksi \(\ce{OF2}\) ei ole ioninen.
Exercise \(\PageIndex{3}\)
tunnista jokainen yhdiste ioniseksi tai ei ioniseksi.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(NH4)3PO4}\)
- \(\ce{SOCl2}\)
Vastaus a:
ei ioninen
vastaus b:
ioninen
Vastaus c:
ioninen
vastaus D:
ei ioninen
katso tarkemmin: veri ja merivesi
tiede on jo pitkään tunnustanut, että veri ja merivesi ovat koostumukseltaan samanlaisia. Kumpaankin nesteeseen on nimittäin liuennut ioniyhdisteitä. Samankaltaisuus voi olla enemmän kuin pelkkä sattuma; monet tiedemiehet ajattelevat, että ensimmäiset elämänmuodot maapallolla syntyivät valtamerissä. Lähempi tarkastelu kuitenkin osoittaa, että veri ja merivesi ovat aivan erilaisia. 0,9-prosenttinen natriumkloridiliuos lähentää veren suolapitoisuutta. Merivesi on sen sijaan pääasiassa 3-prosenttista natriumkloridiliuosta, joka on yli kolminkertainen veren pitoisuuteen verrattuna. Tässä on vertailu ionien määristä veressä ja merivedessä:
| Ion | prosenttia merivesi | prosenttia veressä |
|---|---|---|
| na+ | 2, 36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Ero on merkittävä, koska vetykarbonaatti-ionilla ja joillakin siihen liittyvillä ioneilla on ratkaiseva rooli veren happo-emäsominaisuuksien säätelyssä. Vetyfosfaatti—ionien−\(\ce{HPO4^{2−}}\) ja \(\ce{H2PO4^{—}}\)-määrä merivedessä on hyvin pieni, mutta niitä esiintyy suurempia määriä veressä, missä ne vaikuttavat myös happo-emäsominaisuuksiin. Toinen merkittävä ero on, että veressä ei ole merkittäviä määriä sulfaatti-Ionia (\(\ce{SO4^{2−}}\)), Tämä ioni on kuitenkin merivedessä.
Key Takeaways
- ioniyhdisteiden oikeat kemialliset kaavat tasapainottavat positiivisen kokonaisvarauksen negatiivisen kokonaisvarauksen kanssa.
- on myös Atomiryhmiä, joilla on kokonaisvaraus, joita kutsutaan polyatomisiksi ioneiksi.
harjoitukset
-
mitä tietoja ioniyhdisteen kaava sisältää?
-
miksi joidenkin ioniyhdisteiden kemialliset kaavat sisältävät alaindeksejä, kun taas toisten ei?
3. Kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- Mg2+ ja I−
- Na+ ja O2−
4. Kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- Na+ ja Br−
- Mg2+ ja Br−
- Mg2+ ja S2−
5. Kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- k+ ja Cl−
- Mg2+ ja Cl−
- Mg2+ ja Se2−
6. Kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- Na+ ja N3−
- MG2+ ja N3−
- Al3+ ja S2−
7. Kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- Li+ ja N3−
- Mg2+ ja P3−
- li+ ja P3−
8. Kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- Fe3+ ja Br−
- Fe2+ ja Br−
- Au3+ ja S2−
- Au+ ja S2−
9. Kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- Cr3+ ja O2−
- Cr2+ ja O2−
- PB2+ ja Cl−
- PB4+ ja Cl−
10. Kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- Cr3+ ja NO3−
- Fe2+ ja PO43−
- Ca2+ ja CrO42−
- Al3+ ja OH−
11. Kirjoita kunkin ioniparin muodostaman ioniyhdisteen kemiallinen kaava.
- NH4+ ja NO3−
- H+ ja Cr2O72−
- cu+ ja CO32−
- Na+ ja HCO3−
12. Kullekin alkuaineparille määritetään niiden ionien varaus ja kirjoitetaan oikea kaava niiden välille syntyvälle ioniyhdisteelle.
- Ba ja s
- cs ja I
13. Kullekin alkuaineparille määritetään niiden ionien varaus ja kirjoitetaan oikea kaava niiden välille syntyvälle ioniyhdisteelle.
- k ja s
- SC ja Br
14. Minkä yhdisteiden ennustaisit olevan ionisia?
- Li2O
- CO2
- FeSO3
- C6H6
- c2h6o
(NH4)2o
15. Minkä yhdisteiden ennustaisit olevan ionisia?
- Ba(OH)2
- CH2O
- NH2CONH2
- C8H18
- NH3
(NH4)2cro4
vastauksia
1. yhdisteen kunkin ionilajin suhde
2. Joskus tarvitaan enemmän kuin yksi ioni tasapainottamaan toisen ionin varausta ioniyhdisteessä.
- Mgi2
Na2O
- Nabr
- MgBr2
- KCL
- MgCl2
- na3n
- Mg3n2
- AL2S3
- li3n
- mg3p2
- febr3
- AU2S3
- au2s
- Cr2O3
- Cro
- PbCl2
- Cr(No3)3
- Fe3(PO4)2
- Cacro4
- NH4NO3
- h2cr2o7
- NaHCO3
- ba2+, S2−, bas
- CS+, i−, CSI
- k+, S2−, K2S
- SC3+, Br−, scbr3
- ei ionisia
- ei ionisia
- ei ionisia
- ei ionisia
- ei ioninen
- div>
- ionic
not ionic not ionic - ionic
not ionic not ionic
- ionic
PbCl4
l(OH)3
cu2co3
ioninen
