13.5 D: biotiini on CO2-kuljettava koentsyymi
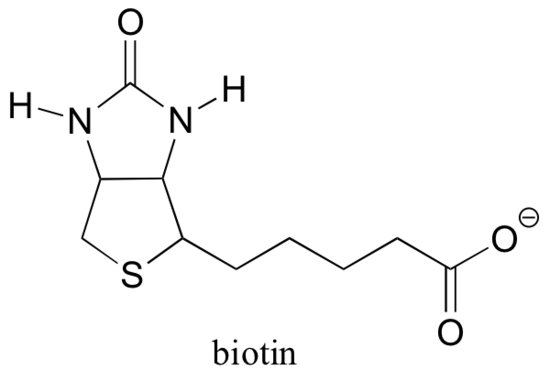
muistuttaa kohdasta 6.5 B, että monet entsyymit ovat riippuvaisia koentsyymien avustuksesta, jotka ovat pieniä (suhteessa proteiiniin) orgaanisia molekyylejä, jotka sitoutuvat – kovalenttisesti tai ei-kovalenttisesti – entsyymin aktiivisessa kohdassa ja auttaa sitä katalysoimaan reaktiotaan. S-adenosyylimetioniini (SAM, kohta 9.1 A) ja ATP (kohta 10.2) ovat kaksi esimerkkiä, jotka olemme kohdanneet tähän mennessä, ja näemme useita muita luvuissa eteenpäin. Vaikka Rubisco (kuvattu tämän jakson B osassa) on poikkeus, useimmat karboksylaatioreaktioita katalysoivat entsyymit ovat riippuvaisia koentsyymistä nimeltä biotiini, joka toimii hiilidioksidin väliaikaisena kuljettajana.
Pyruvaattikarboksylaasi, glukoneogensis-reitin ensimmäistä vaihetta katalysoiva entsyymi, on hyvä esimerkki biotiiniriippuvaisesta karboksylaatioreaktiosta. Huomaa, että tässä reaktiossa CO2 on peräisin bikarbonaatista, toisin kuin Rubisco-reaktiossa, jossa CO2 ’kiintyy’ suoraan ilmakehästä.

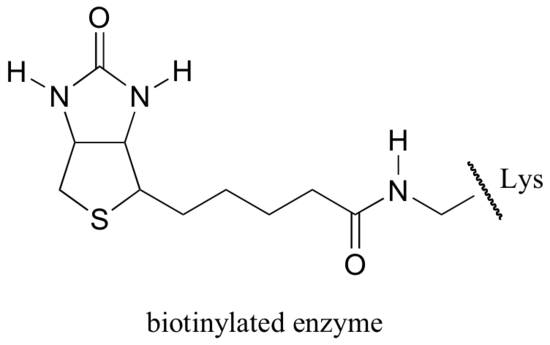
biotiini kiinnittyy kovalenttisesti entsyymiin amidiliitoksen kautta aktiiviseen kohtaan lysiiniin.
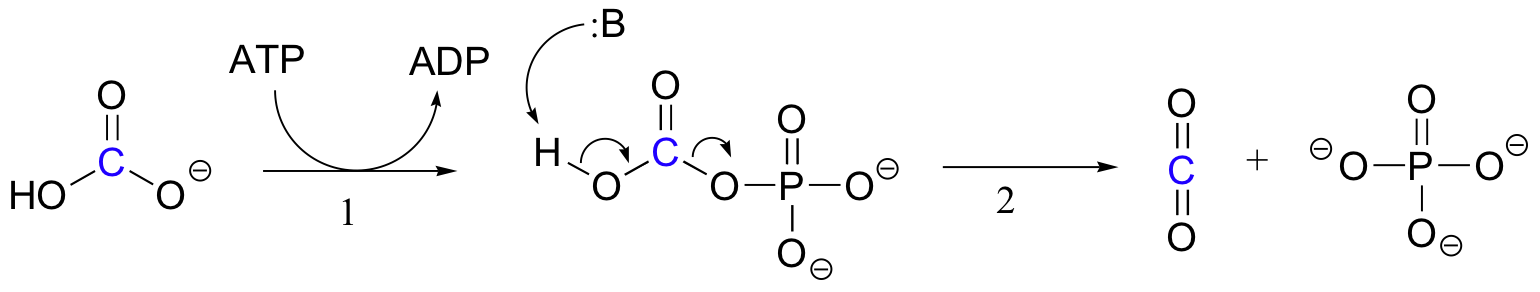
tarkkaa mekanismia, jolla biotiiniriippuvaiset karboksylaatioreaktiot toimivat, ei vielä täysin tunneta, mutta seuraava on todennäköinen kuva. Ensin bikarbonaatti-ioni fosforyloidaan ATP: n avulla (Vaihe 1, ks.kohta 10.2), jolloin se aktivoituu dekarboksylaatioksi, jolloin syntyy vapaata CO2: ta (Vaihe 2).
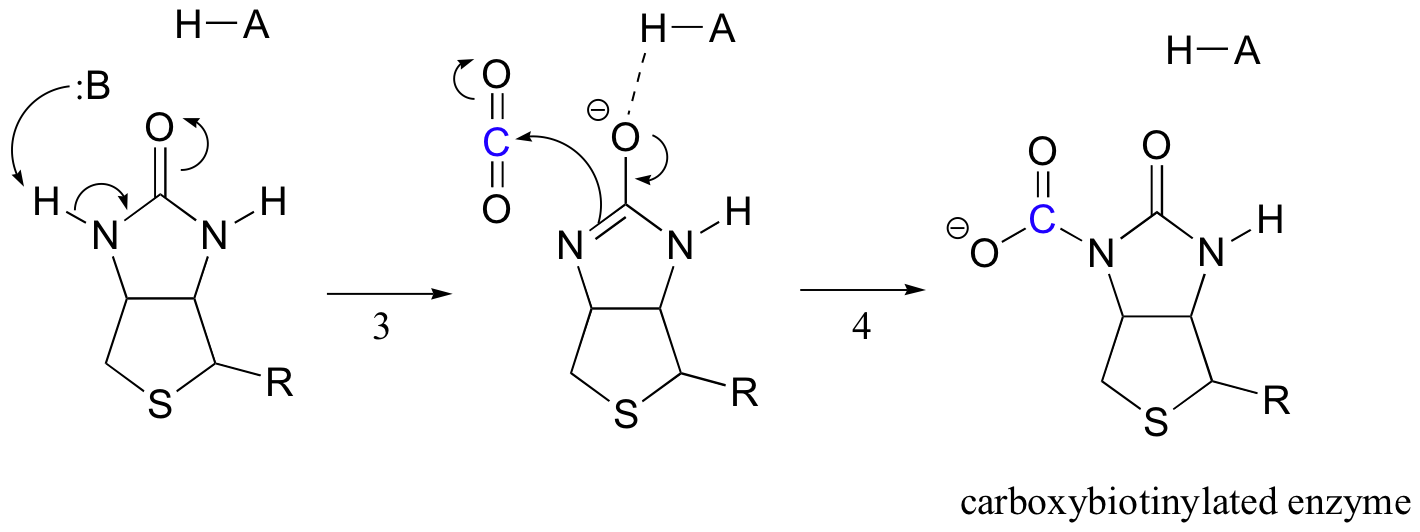
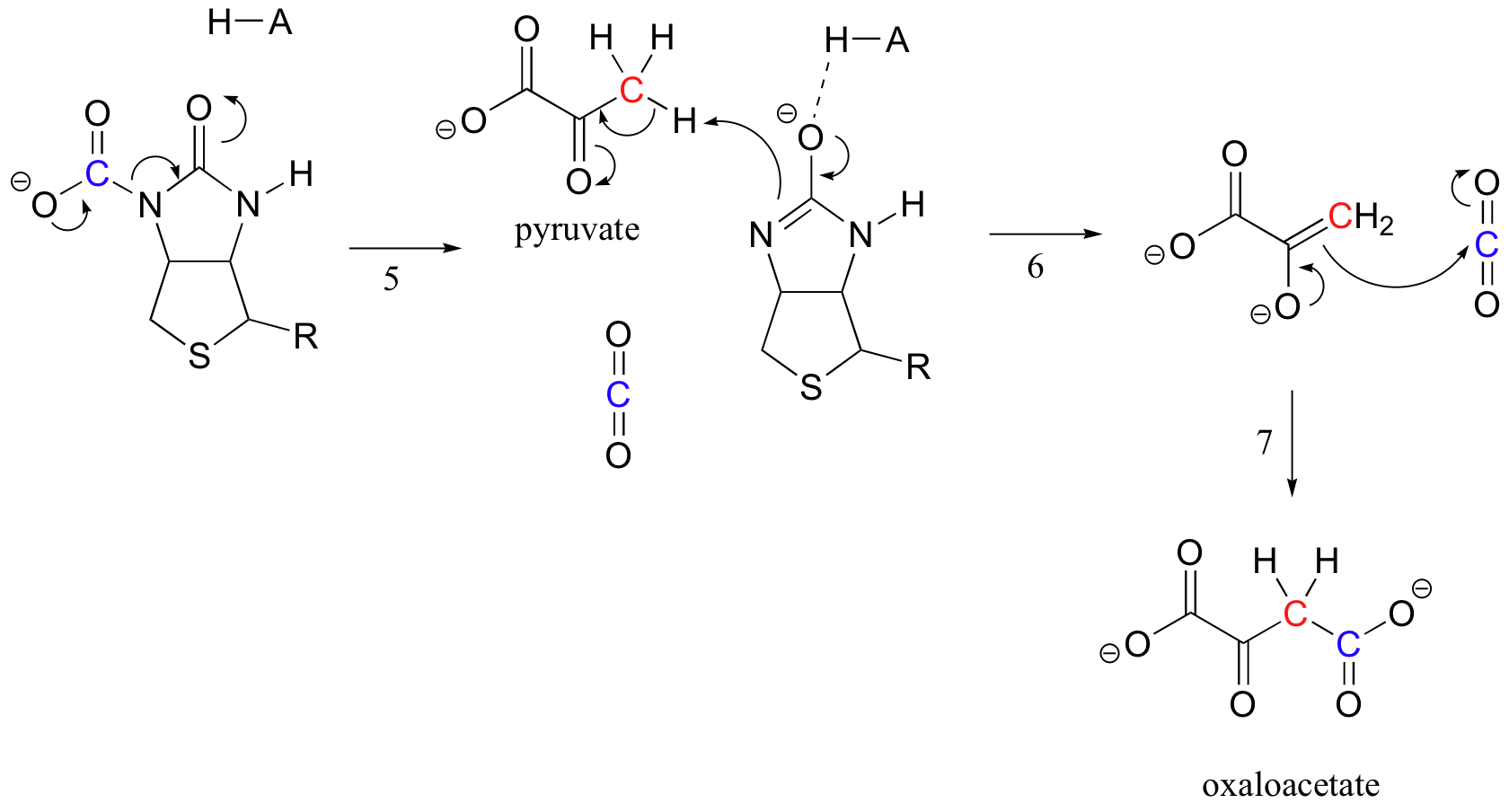
biotiinin tehtävänä on pitää kiinni hiilidioksidimolekyylistä, kunnes pyruvaatti tulee aktiiviseen kohtaan. Biotiinin karboksylaatiossa amiditypen deprotonaatio muodostaa enolaattimaisen välituotteen (vaiheen 3 – amidien pKa on noin 17, ja tätä alentaa aktiivisen kohdan happo lähellä happea). Tätä vaihetta seuraa nukleofiilisen typen hyökkäys hiilidioksidia vastaan karboksibiotinyloidun entsyymin muodostamiseksi (Vaihe 4).
kun pyruvaattimolekyyli sitoutuu, aktiivisen kohdan rakenteen uudelleenjärjestely aiheuttaa edellisen vaiheen kääntymisen (vaihe 5), jolloin hiilidioksidi vapautuu ja biotiiniemäs deprotonoi alfahiilen pyruvaatti niin, että se voi kondensoitua aldolimaisesti hiilidioksidin kanssa muodostaen oksaloasetaattia (vaiheet 6-7).
jos olet opiskellut jotain biokemiaa, olet ehkä kuullut biotiinista hieman eri kontekstissa, että mitä tässä jaksossa käsitellään. Avidin-niminen proteiini, jota esiintyy runsaasti munanvalkuaisessa, sitoutuu ei-kovalenttisesti ja erittäin tiukasti biotiiniin (itse asiassa avidin-biotiini on tiukin proteiini-ligandia sitova pari, jonka tiede tuntee). Biokemistit hyödyntävät usein tätä ominaisuutta liittämällä kovalenttisesti kiinnostavan biomolekyylin biotiiniin. ”Biotinyloidut” lajit voidaan sitten helposti eristää monimutkaisesta seoksesta juoksuttamalla seosta ”affiniteettikolonnin” läpi, joka on päällystetty avidiinilla.
