on olemassa useita tapoja, joilla solu voi siirtyä avaruuden pisteestä toiseen. Nestemäisessä väliaineessa tämä menetelmä voi olla jonkinlaista uintia, jossa käytetään sädekehän tai flagellarin liikettä solun kuljettamiseen. Kiinteillä pinnoilla nämä mekanismit eivät selvästikään toimi tehokkaasti, ja solu käy läpi indeksointiprosessin. Tässä osiossa aloitamme keskustelun sädekehä / flagellar liikkeen, ja sitten harkita monimutkaisempia vaatimuksia solujen indeksointi.
värekarvat ja flagella, jotka eroavat toisistaan lähinnä pituudeltaan eivätkä rakenteeltaan, ovat mikrotubuluspohjaisia organelleja, jotka liikkuvat edestakaisin. Tämä tarkoittaa suhteellisen lyhyen värekarvojen ”soutamista”, mutta pidemmässä flagellassa rakenteen joustavuus aiheuttaa edestakaisen liikkeen levittämisen aaltona, joten flagellarin liike on aaltoilevampaa tai piiskamaista (mieti mitä tapahtuu, kun heilutat puutarhaletkua nopeasti puolelta toiselle verrattuna lyhyeen saman letkun kappaleeseen). Jommankumman rakenteen ytimeksi kutsutaan aksoneemia, joka koostuu 9 mikrotubuluskaksikosta, jotka on liitetty toisiinsa sädedyneiinimoottoriproteiinien avulla ja jotka ympäröivät kahden erillisen mikrotubuluksen muodostamaa keskusydintä.
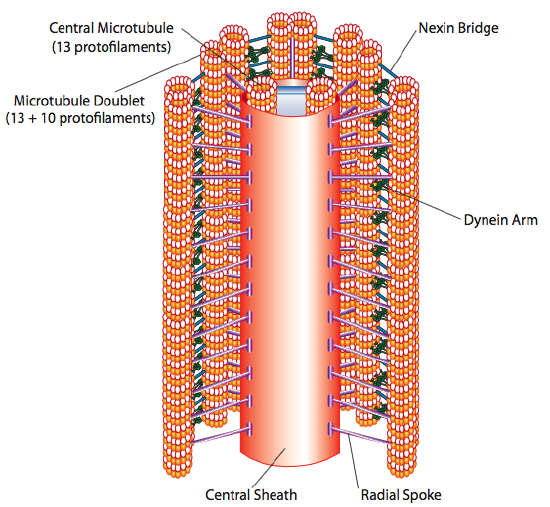
tätä kutsutaan ”9+2” – muodostumaksi, joskaan yhdeksän tuplaa eivät ole samat kuin kaksi keskusmikrotubulusta. A-tubulus on täysi 13-protofilamentti, mutta siihen fuusioitunut B-tubulus sisältää vain 10 protofilamenttia. Kukin keskusmikrotubuluksista muodostaa täydet 13 protofilamenttia. 9+2 aksoneemi ulottuu pituus cilium tai flagellum kärjestä, kunnes se saavuttaa pohja, ja yhdistää solun elin kautta basal elin, joka koostuu 9 microtubule kolmoset järjestää lyhyessä tynnyrissä, aivan kuten centriolit, joista ne ovat peräisin.
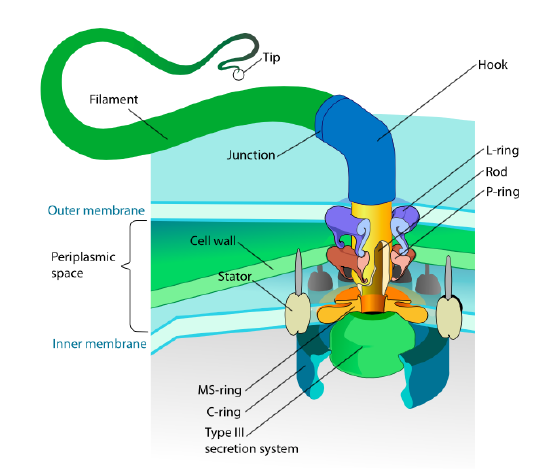
tässä jaksossa viitataan vain eukaryootteihin. Joillakin prokaryooteilla on myös liikkuvia lisäkkeitä nimeltä flagella, mutta ne ovat sekä rakenteeltaan että mekanismiltaan täysin erilaisia. Flagelliinit itsessään ovat pitkiä kierteisiä flagelliiniproteiinin polymeerejä, ja flagelliinikuitujen pohja on yhteydessä pyörimismotoriseen proteiiniin, ei translaatiomoottoriin. Tämä moottori (Kuva \(\PageIndex{18}\)) hyödyntää Ionia (h+ tai Na+ lajista riippuen) alas sähkökemiallista gradienttia, joka antaa energian pyörimään jopa 100000 kierrosta minuutissa. On arveltu, että pyörimisen taustalla ovat konformaatiomuutokset solukalvoon kätkeytyvässä staattorirenkaassa.
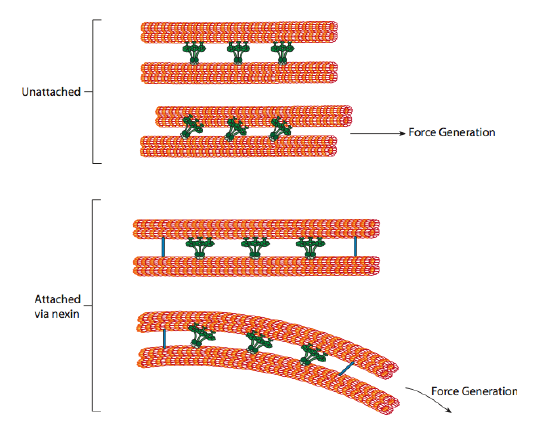
sädedyneiinit antavat motorisen kyvyn, mutta aksoneemissa on myös kaksi muuta sidosproteiinia. On nexiineja, jotka yhdistävät yhden doubletin a-tubuluksen viereisen doubletin B-tubulukseen ja yhdistävät siten ulomman renkaan. Ja, on säteittäisiä pinnoja, jotka ulottuvat a-tubulus kunkin doublet keskus pari Mikrotubulukset ytimessä aksoneemi. Kummallakaan ei ole motorista toimintaa. Ne ovat kuitenkin ratkaisevia värekarvojen ja flagellan liikkeille, koska ne auttavat muuttamaan liukuliikkeen taivutusliikkeeksi. Kun sädedyneiini (hyvin samankaltainen kuin sytoplasmadyneiinit, mutta sillä on kolme päätä kahden sijasta) on mukana, se sitoo a-mikrotubuluksen toiselta puolelta, B-mikrotubuluksen viereisestä doubletista ja siirtää yhden suhteessa toiseen. Jono näitä dyneineja liikkuisi yhtäaikaa liukuisi siten yksi doublet suhteessa toiseen, jos (ja se on suuri ”jos”) kaksi doublets oli täydellinen liikkumavapaus. Koska kaksoisolennot kuitenkin liittyvät toisiinsa nexinin proteiineilla, yhden kaksoisolennon yrittäessä liukua tapahtuu se, että se sen sijaan taivuttaa toisiinsa liitettyä rakennetta (Kuva \(\PageIndex{17}\)). Tämä mutka selittää värekarvojen soutuliikkeen, jotka ovat suhteellisen lyhyitä, sekä pitkän flagellan piiskausliikkeen, jotka levittävät taivutusliikkeen aksoneemia pitkin.
vaikka ajattelemme värekarvojen ja flagellaarien liikettä solun työntövoimamenetelminä, kuten sperman flagellaarista uintia munasolua kohti, on myös olemassa useita tärkeitä paikkoja, joissa solu on paikallaan ja värekarvoja käytetään nesteen siirtämiseen solun ohi. Itse asiassa on soluja, joilla on värekarvoja useimmissa kehon suurissa elimissä. Useita ciliary dyskinesioita on raportoitu, joista näkyvin, primaarinen ciliary dyskinesia (PCD), joka sisältää Kartagenerin oireyhtymä (KS), johtuu mutaatio dnai1 geeni, joka koodaa alayksikkö (väliketju 1) aksonemaalinen (ciliary) dynein. PCD: lle on ominaista toistuvasta infektiosta johtuva hengitysvaikeus, ja KS: n diagnoosi tehdään, jos on myös situs inversus, tila, jossa kehon normaali vasen-oikea epäsymmetria (esim.vatsa vasemmalla, maksa oikealla) on päinvastainen. Ensimmäinen oire johtuu lukuisten epiteelisolujen värekarvojen toimimattomuudesta keuhkoissa. Niiden normaali tehtävä on pitää limaa hengitysradalla jatkuvasti liikkeessä. Normaalisti lima auttaa pitämään keuhkot kosteina toiminnan helpottamiseksi, mutta jos lima tulee paikallaan, siitä tulee kasvualusta bakteereille sekä siitä tulee ärsyttävä ja este asianmukaiselle kaasun vaihdolle.
Situs inversus on mielenkiintoinen epämuodostuma, koska se syntyy alkionkehityksessä ja sillä on vain 50%: lla PCD-potilaista, koska sädekehän heikentynyt toiminta aiheuttaa vasemman ja oikean epäsymmetrian satunnaistumista, ei kääntymistä. Yksinkertaisesti sanottuna varhaisen alkion kehityksen aikana vasen-oikea-epäsymmetria johtuu osittain molekyylisignaalien liikkumisesta vasempaan suuntaan alkiosolmukkeessa. Tämä virtaus johtuu värekarvojen koordinoidusta hakkaamisesta, joten kun ne eivät toimi, virtaus häiriintyy ja tapahtuu satunnaistamista.
myös muut PCD-potilaiden oireet huomauttavat värekarvojen ja flagellan toiminnasta kehossa. Miesten hedelmättömyys on yleistä immotilin sperman vuoksi. Naisten hedelmättömyys, vaikkakin harvinaisempaa, voi myös esiintyä, koska toimintahäiriö värekarvojen oviduct ja munanjohtimet, jotka normaalisti siirtää munasolun pitkin munasarjasta kohtuun. Mielenkiintoista on myös alhainen yhteys hydrokefalus internus (ylitäyttö kammiot aivojen kanssa aivo-selkäydinnesteestä, aiheuttaa niiden laajentumista, joka pakkaa aivokudoksen ympärillä) PCD. Tämä johtuu todennäköisesti toimintahäiriö värekarvojen ependymal solujen vuori kammiot, ja jotka auttavat kiertämään CSF, mutta ilmeisesti ole täysin välttämätöntä. Koska CSF bulk flow uskotaan ajaa ensisijaisesti systole / diastole muutos verenpaineen aivoissa, jotkut hypoteeseja, että värekarvojen voi olla mukana ensisijaisesti ow kautta joitakin tiukempia kanavia aivoissa.
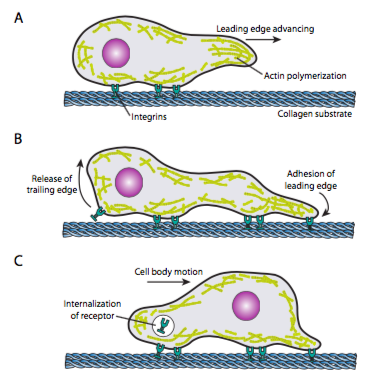
solujen ryömiminen (Kuva \(\PageIndex{19}\)) edellyttää etureunan mikrofilamenttiverkon koordinoitua uudelleenjärjestämistä, joka ulottuu (sekä polymeroimalla että liukumalla) ja muodostaa sitten kiinnikkeitä uuteen etummaisimpaan kohtaan. Tämä voi olla muotoa filopodia tai lamellipodia,ja usein molemmat samanaikaisesti. Filopodiat ovat pitkiä ja hyvin ohuita ulokkeita, joiden ydinkimpuissa on yhdensuuntaisia mikrofilamentteja ja suuria pitoisuuksia solun pintareseptoreita. Niiden tarkoitus on ennen kaikkea aistia ympäristöä. Lamellipodia ulottuu usein kahden lopodian väliin ja on enemmän leveä röyhy kuin sormi. Sisäisesti aktiini muodostuu enemmän silmiksi kuin nippuiksi, ja leveämpi reuna mahdollistaa useamman kiinnityksen alustaan. Tämän jälkeen mikrofilamenttiverkko järjestyy uudelleen, jolloin sytoplasmaan avautuu tila, joka toimii mikrotubulusten liikkeenä kohti solun etuosaa. Näin liikenneverkosto saadaan käyttöön, jotta solunsisäistä Irtomateriaalia voidaan siirtää eteenpäin. Tällöin solun hännänpäässä olevat vanhat kiinnikkeet vapautuvat. Tämä vapautuminen voi tapahtua kahden ensisijaisen mekanismin kautta: reseptorin endosytoosi tai reseptorin deaktivointi signaloimalla / konformaatiomuutoksella. Tämä liiallinen yksinkertaistaminen on tietenkin ristiriidassa kaikkien näiden toimintojen koordinoinnin ja valvonnan kanssa solun suunnatun liikkeen aikaansaamiseksi.
yksi mikrofilamenttivoiman tuottamisen malli, Elastic Brownian Ratchet-malli (Mogilner and Oster, 1996), esittää, että solukalvon jatkuvasta minuutin lämpövaihtelusta johtuvan Brownian liikkeen vuoksi aktiinifilamentit, jotka työntyvät kalvon reunoja kohti, taipuvat vaihtelevasti. Jos fleksi on tarpeeksi suuri, Uusi aktiinimonomeeri mahtuu kalvon ja hehkulangan kärjen väliin, ja kun nyt pidempi filamentti taipuu takaisin, se voi painostaa kalvoa voimakkaammin. Yksittäinen hehkulanka ei selvästikään tuota paljoa voimaa, mutta monien hehkulankojen koordinoitu laajennus voi työntää kalvoa eteenpäin.
kun solu saa signaalin liikkua, ensimmäinen sytoskeletaalinen vaste on polymeroida aktiini, rakentaen lisää mikrofilamentteja sisällyttämään etureunaan. Signaalista (houkutteleva tai vastenmielinen) riippuen polymeroituminen voi tapahtua samalla tai vastakkaisella puolella solua signaalireseptorin aktivaatiopisteestä. Merkittävää on, että pelkästään uuden f-aktiinin polymerointi voi tuottaa riittävästi voimaa kalvon liikuttamiseen eteenpäin, jopa ilman myosiinimoottoreiden osallistumista! Voimantuotantomalleista keskustellaan, mutta yleensä aloitetaan uuden G-aktiinin sisällyttämisellä hehkulankaan sen kärjessä eli hehkulangan ja kalvon rajapinnassa. Vaikka se teknisesti riittäisi, elävässä solussa myosiinit ovat mukana, ja ne auttavat työntämään ja järjestämään filamentteja suoraan uuden etureunan pystyttämiseksi. Lisäksi jotkin filamentit ja verkot on katkaistava nopeasti ja uusia yhteyksiä on tehtävä sekä filamenttien että filamenttien ja muiden proteiinien, kuten adheesiomolekyylien tai mikrotubulusten välille.
miten polymeroitumista ja aktiinin uudelleenjärjestymistä valvotaan? Reseptorit, jotka viestivät solujen liikkumisesta, voivat aloittaa hieman erilaisia reittejä, mutta monilla on joitakin yhtäläisyyksiä pienten Gtpaasien Ras-perheen yhden tai useamman jäsenen aktivoinnissa. Nämä signalointimolekyylit, kuten Rac, Rho ja cdc42, voivat aktivoitua reseptorityrosiinikinaasien avulla (KS.RTK-Ras-aktivaatioreitit, Chap. 14). Jokaisella näistä on hieman erilainen rooli solujen liikkuvuudessa: cdc42-aktivaatio johtaa filopodian muodostumiseen, Rac aktivoi reitin, joka sisältää Arp2 / 3: n ja cofilin lamellipodian muodostukseen, ja Rho aktivoi myosiini II: n kontrolloimaan fokaalista tarttumista ja stressikuidun muodostumista. Erityyppinen reseptorikaskadi, G-proteiinin signalointikaskadi (myös Luku 14), voi johtaa PLC: n aktivoitumiseen ja PIP2: n myöhempään pilkkoutumiseen ja sytosolisen Ca2+: n lisääntymiseen. Nämä muutokset, kuten aiemmin todettiin, voivat myös aktivoida myosiini II: ta sekä remodeloivia entsyymejä gelsoliini, cofilin ja profiliini. Tämä hajottaa olemassa olevia aktiinirakenteita tehdäkseen solusta enemmän nestettä, samalla kun se lisää g-aktiinia muodostaen uuden etureunan sytoskeletonin.
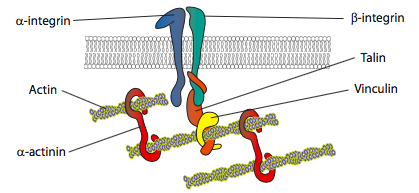
in vitro-kokeet osoittavat, että kalvon työntyessä eteenpäin syntyy uusia liimakontakteja substraattia sitovien adheesiomolekyylien tai reseptorien kautta (usein soluviljelmät tai-astiat on päällystetty kollageenilla, filamiinilla tai muilla solunulkoisilla matriisiproteiineilla). Kontaktit värväävät sitten sytoskeletaalisia elementtejä, jotka lisäävät vakautta muodostaen fokaalisen adheesion (Kuva \(\PageIndex{20}\)). Fokaalisten kiinnikkeiden muodostuminen näyttää kuitenkin olevan soluviljelmän artefakti, ja on epäselvää, rekrytoivatko in vivo muodostuvat kiinnikkeet samantyyppisiä sytoskeletaalisia komponentteja.
kolmas askel solun liikkumiseen on solun sisällön irtoliike eteenpäin. Tämän vaiheen mekanismit ovat epäselviä, mutta on jonkin verran näyttöä siitä, että mikrotubuluksen sytoskeletonin etureunan ja etummaisten osien välisten yhteyksien avulla Mikrotubulukset järjestetään uudelleen tehokkaan kuljetustien muodostamiseksi irtotavaraliikkeelle. Toinen näkökulma tähän voi olla aktiiniverkostojen ”corralling” – vaikutus, joka Suoraan avaa tilaa kohti etureunaa. Mikrotubulukset pääsevät sitten kyseiseen tilaan helpommin kuin ahtaan aktiiniverkon läpi, mikä pakottaa virtauksen oikeaan suuntaan.
suuri osa mikrotubuluksen ja aktiinin yhteisvaikutuksista solujen liikkuvuudessa on tehty tutkimalla hermosolun kasvukartiota, jota kutsutaan joskus hihnassa olevaksi soluksi, koska se toimii lähes itsenäisesti kuin ryömivä solu, etsien oikeaa reittiä johtaa aksoninsa soluruumiista sen oikeaan synaptiseen yhteyteen (A. W. Schaefer et al, Dev. Cell 15: 146-62, 2008).
lopuksi solun on kumottava Vanhat kiinnikkeensä takareunassa. Tämä voi tapahtua useilla eri tavoilla. In vitro-indeksoinnin on havaittu repivän itsensä irti substraatista, jättäen jälkeensä pieniä palasia kalvoja ja niihin liittyviä adheesioproteiineja prosessissa. Syntyvän voiman oletetaan tulevan aktiini-myosiini-stressikuiduista, jotka johtavat eteenpäin suuntautuvista fokusliimoista. Soluille on kuitenkin tarjolla vähemmän tuhoavia mekanismeja. Joissakin tapauksissa solunulkoisen substraatin solureseptorin adhesiiviteettia voidaan säädellä sisäisesti, ehkä fosforyloimalla tai defosforyloimalla reseptori. Toinen mahdollisuus on reseptorin endosytoosi, jolloin se poistuu solun pinnalta. Se voisi yksinkertaisesti kierrättää etureunaan asti, jossa sitä tarvitaan (eli transkytoosi), tai jos sitä ei enää tarvita tai vahingoitu, se voi hajota lysosomissa.
