El uso de terminología coherente dentro de los estudios y entre ellos es fundamental para permitir un proceso de ensayo eficiente. Los estándares CDISC como CDASH, SDTM, SEND y ADaM estandarizan las estructuras a utilizar al recopilar y enviar datos, pero ¿qué pasa con los valores de los datos en sí?
Esta publicación ofrece una visión general de la terminología controlada estandarizada del CDISC y cómo se debe usar para recopilar y enviar datos de una manera que acelere los ensayos y permita el análisis de estudios cruzados.
Si está interesado en leer más sobre los estándares CDISC, puede leer en nuestros blogs Todo lo que necesita saber sobre SDTM e Introducción a los estándares CDISC.
El CDISC se asoció con el NCI para definir terminología estandarizada
El CDISC se asoció con el Instituto Nacional del Cáncer (NCI) para ayudar a dar consistencia a la terminología en los ensayos clínicos. A través de esta colaboración, se ha definido un conjunto estándar de terminología que se actualiza trimestralmente, aportando coherencia semántica a todos los estudios. Utilizando esta terminología, la misma información se representará de la misma manera en todos los estudios.
Tomemos un ejemplo simple: Sexo:
- ¿Debe representarse a Masculino por «Masculino», «MASCULINO», «M» o «1»?
- ¿Cómo se debe registrar a una persona intersexual?
En el pasado, esta información se pudo haber recopilado de diferentes maneras para cada estudio. El Estándar Terminológico CDISC NCI ahora define que las únicas opciones permitidas son «F», «M», «U» e «INDIFERENCIADO», y que una persona intersexual debe ser registrada como «INDIFERENCIADA». Puede ver cómo este ejemplo tan simple ya hace que sea mucho más fácil comprender los datos subyacentes y segmentar fácilmente para diferentes poblaciones a través de los estudios.
![]() Nota
Nota
El catálogo de normas de datos de la FDA ahora exige que se use la terminología estandarizada del NCI para todos nuevos estudios. Esto hace que la vida de un revisor sea mucho más fácil, ya que saben cómo interpretar los datos.

¿Cómo se define la terminología del CDISC NCI?
La siguiente tabla muestra cómo se define la terminología sexual estándar.
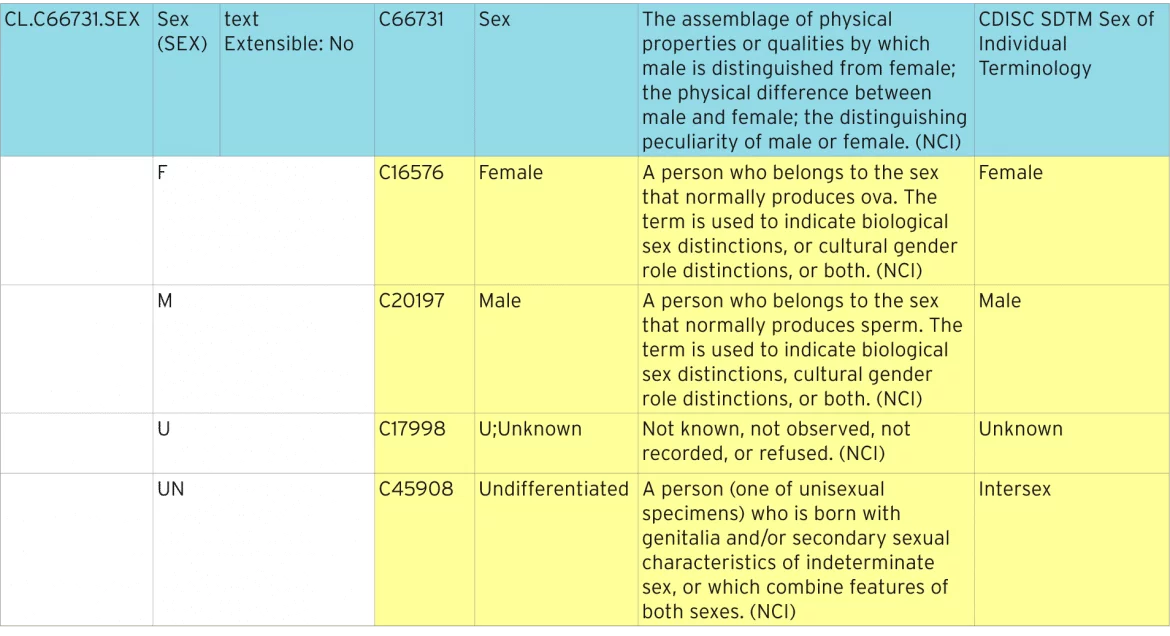
Identificación de terminología estandarizada
La línea azul representa la lista de códigos que contiene todos los códigos individuales. La lista de códigos tiene un «código C» estándar de «C66731». Cada uno de los códigos individuales tiene su propio código C, por ejemplo, «C16576». Estos códigos C se utilizan en metadatos ODM y Define-XML para identificar listas de códigos como terminología estándar del NCI.
Extensibilidad
Esta lista de códigos se define como no extensible, lo que significa que dondequiera que se use la lista de códigos, no debe contener ningún término que no esté enumerado aquí. Las listas de códigos que son extensibles pueden tener términos adicionales agregados. Estos términos adicionales deben describirse en Define-XML como términos extendidos y no pueden duplicarse ni ser sinónimos de términos existentes.
Valor de envío, Sinónimos y Término preferido
El valor de envío es lo que se debe enviar a un regulador. El valor realmente mostrado en un formulario puede ser diferente, y tal vez uno de los Sinónimos o el Término Preferido.
Disponible en muchos colores
Los estándares de terminología del NCI están disponibles en varios formatos para adaptarse a diferentes necesidades, incluidos Excel, ODM, HTML y RDF. El ejemplo anterior está tomado de la versión de Excel.
Agrupados en subconjuntos para CDASH, SDTM, ADaM y más
Para mayor comodidad, la terminología del NCI se agrupa en varios subconjuntos.
- La terminología SDTM contiene términos para usar en un envío basado en SDTM
- La terminología CDASH contiene términos para usar en la recopilación de datos basada en CDASH
- La terminología ADaM contiene términos para usar en conjuntos de datos ADaM
- La terminología SEND contiene términos para usar en un envío basado en SEND
- La terminología de protocolo contiene términos para usar con el Modelo de Representación de protocolos (PRM) y el Registro de Ensayos Clínicos XML (CTR-XML)
Uso de la terminología CDISC del NCI en un estudio
Al definir metadatos de envío en Define-XML, se utilizan listas de códigos para definir listas fijas de valores para ciertas variables. De acuerdo con la regulación actual de la FDA, estas listas de códigos deben ajustarse a la terminología estandarizada del CDISC del NCI, cuando exista dicha terminología. Se vinculan a la terminología estandarizada mediante la adición de alias a los códigos C, por ejemplo:
<Alias Name="C66731" Context="nci:ExtCodeID"/>
Al definir metadatos de recopilación de datos en ODM, no es necesario usar la terminología estandarizada, sin embargo, al hacerlo, se eliminará la necesidad de asignar términos de sus datos recopilados a sus datos enviados. Esto simplifica enormemente el proceso de estudio de principio a fin y aumenta la coherencia entre los estudios.
Gestión de actualizaciones
La gestión de actualizaciones terminológicas puede suponer una gran cantidad de trabajo, especialmente con las normas que se actualizan con tanta regularidad. ¿Cómo sabe qué estudios o estándares organizacionales podrían verse afectados por la nueva terminología? ¿Cómo se realizan las actualizaciones necesarias de forma eficiente y fiable?
La forma más fácil de administrar esto es mediante el uso de un repositorio de metadatos compatible con CDISC que le permite definir estándares organizacionales basados en la terminología estandarizada y construir sus estudios a partir de esos estándares. A medida que el repositorio comprende las relaciones entre todos los estándares y sus estudios, puede simplificar el proceso de actualización a nuevas versiones de los estándares terminológicos del CDISC NCI.
