Mensaje urgente: Cuando un paciente relativamente joven se presenta a atención de urgencia con dolor en el pecho, puede haber o no una causa «típica». La evaluación rápida y precisa de los factores de riesgo son esenciales para una atención eficiente y, a menudo, para la supervivencia del paciente.
Max Palatnik, MD
Presentación del caso
Un varón de 35 años se presentó a las 21:59 con una queja principal de dolor torácico; a las 22: 03, notamos lo siguiente:
Temp: 98.9
Pulso: 103
Resp: 16
Syst: 122
Diast: 69
O2Sat: 99%
Historia de Enfermedad Presente (22:47) (Verbatim)
Pt. varón de 38 años con una PMH de miocarditis y pericarditis en 1983 y 1991, que cenó a las 6:30 y comenzó a sentir presión en la parte anterior del pecho mientras veía la televisión a las 7:30 PM. – se sentía como «algunos estaban sentados en mi pecho». Sollozo asociado y radiación en su hombro y mano izquierda «hormigueo». Ha tenido acidez estomacal, pero esto se sintió diferente. Tomó bicarbonato de sodio (que normalmente toma para su acidez estomacal) y esto no ayudó. Ausencia de síncope, náuseas, vómitos, fiebre, dolor por RUQ o antecedentes de intolerancias alimentarias. Tuvo algunos síntomas virales hace 2 semanas (tos no productiva, HA sinusal y PND que se ha resuelto.) Sin ortopnea, DPN, relación del dolor con el ejercicio, traumatismo torácico, componente pleurítico
Antecedentes médicos/Triaje
Medicación, alergias comunes: Ninguno
PMH: Miocarditis/Pericarditis
PSH: Ninguno
SocHx: No fumador
FamHx: Positivo para EAC con un hermano de 52 años con IM, CABG del padre a los 53
Examen (22:52)
General: nutrido, sin angustia aparente.Cabeza: normocefálica; atraumática.Ojos: PERLA;EOM intacta ENT: TM’s normal; nariz normal; no hay rinorrea; la garganta es roja y exudados leves.. Membranas mucosas húmedas.Cuello: Flexible, no tendinoso, sin linfadenopatía cervical. Sin signos meníngeos Cardiovascular: S1, S2 normales; sin soplos, rozaduras o galopadas. Respiración: Excursión normal del pecho con la respiración; sonidos respiratorios claros e iguales bilateralmente; sin sibilancias, ronquidos o estertores.Abdomen: Sonidos intestinales normales; no distendido; no benigno; sin organomegalia palpable.Extremidades: ROM normal en las cuatro extremidades; no se corresponde con la palpación; los pulsos distales son normales e iguales.Piel: Normal para la edad y la raza; cálido; seco; buena turgencia; sin lesiones aparentes o exudado
Notas de progreso (23: 12)
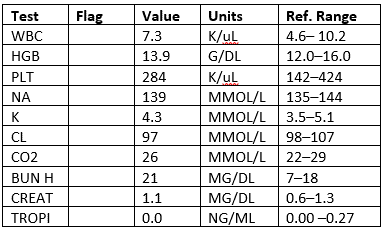
Recibió 2 aspirinas para bebés y NTG SL con alivio de las molestias en el pecho. Luego le colocaron 1 pulgada de Nitropaste. A las 00: 44 su dolor volvió y su ECG se repitió. Le dieron 15 mg de Maalox sin mejorar y luego ½ pulgada más de NTP, lo que alivió la incomodidad.Resultados ECG 1: Ondas T aplanadas inferiores y en V2-V6.ECG 2: Sin cambios Laboratorios
RXC: Diagnóstico negativo
(01:57)
Dolor torácico, antecedentes de miocarditis
Disposición (02: 02)
El paciente fue ingresado en el hospital por telemetría.
Curso de Hospital
Pt. se sometió a enzimas seriadas y se repitió el ECG por la mañana. Descartó MI y fue puesto en libertad. Un ECO de estrés posterior fue negativo después de hacer ejercicio durante 12,5 minutos sin molestias en el pecho ni cambios en el ECG.
Segunda visita
- El paciente siguió con su PCP, se le diagnosticó ERGE y se inició con un IBP.
- El paciente regresó a la sala de emergencias 6 semanas después con opresión en el pecho y disnea en el marco de una comida. Sus síntomas empeoraron con el esfuerzo, ocurren en reposo y mejoran con la posición vertical, así como con Prilosec.
- Sin fiebre asociada, tos, radiación, diaforesis, dolor de pantorrillas, edema periférico.
- El paciente tiene signos vitales normales, con un examen apropiado y sin complicaciones.
- El ECG revela TWI en aVL, así como nuevas ondas q en cambios V1-V2 y NSST.
- La RXC es negativa.
- Los laboratorios muestran una troponina que es > 20 veces el límite superior de la normalidad.
- El paciente recibe aspirina, heparina, Plavix, nitroglicerina y es ingresado por síndrome coronario agudo.
- El paciente se somete a una intervención coronaria percutánea (ICP) con colocación exitosa del stent y posteriormente es dado de alta en buenas condiciones.
Discusión
El dolor torácico es la queja que presenta más del 5% de los pacientes en los departamentos de urgencias de los Estados Unidos. La evaluación del paciente con dolor torácico es un tremendo desafío, en gran parte debido al amplio diagnóstico diferencial, pero también por el riesgo asociado con un diagnóstico erróneo. Entre las afecciones más rápidamente fatales en medicina de emergencia, muchas de las cuales pueden presentarse inicialmente para atención de urgencia, se encuentran el síndrome coronario agudo (isquemia e infarto de miocardio), disección aórtica, embolia pulmonar, pericarditis con taponamiento cardíaco, miocarditis, neumotórax a tensión y ruptura esofágica. Todas estas afecciones tienden a manifestarse con dolor torácico, y todas deben considerarse al principio de la evaluación del paciente con dolor torácico.
Es responsabilidad del médico evaluar a estos pacientes con la lista de posibles amenazas a la vida en la parte superior del diagnóstico diferencial. Un historial detallado, un examen físico (con enfoque en exámenes cardíacos, pulmonares y vasculares) y la información básica de las pruebas (por ejemplo, electrocardiograma, radiografía de tórax) a menudo pueden descartar rápidamente estas amenazas para la vida con una precisión razonable. Sin embargo, en los casos en que esta evaluación rápida inicial no descarta uno de los diagnósticos mortales, se puede justificar un análisis adicional en un entorno de mayor agudeza.
Aunque los síntomas típicos de SCA se describen como un inicio gradual de dolor o dolor de presión en el pecho con radiación en el brazo izquierdo, el cuello o la mandíbula, en realidad lo atípico puede ser más «típico».»En una gran síntesis de datos, las características históricas más útiles que aumentaron la probabilidad de infarto agudo de miocardio fueron la radiación en el brazo u hombro derecho, la radiación en ambos brazos, el dolor que empeoró con el esfuerzo, la diaforesis y las náuseas o vómitos.1 Ciertos subgrupos, como las mujeres, los diabéticos y los ancianos, tienen más probabilidades de presentar síntomas anginosos representados por disnea, vómitos, diaforesis, debilidad generalizada; algunos pueden tener presentaciones indoloras.2 Incluso en aquellos pacientes con síntomas atípicos como dolor pleurítico o sensibilidad palpable en la pared torácica, la probabilidad posterior a la prueba solo disminuye lo suficiente en aquellos que ya tienen un riesgo bajo.1 La enumeración de la carga histórica de factores de riesgo cardiacos tiene poco valor pronóstico, especialmente en pacientes mayores de 40 años.3
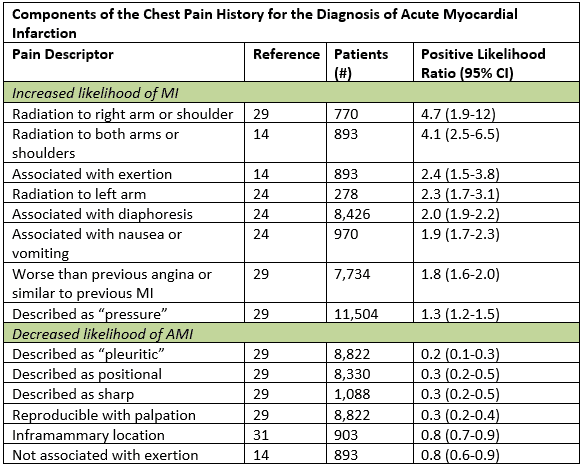
Adaptado de Swap CJ, et al. JAMA. 2005;294:2623-2629.
Los pacientes jóvenes (<de 45 años de edad) representan un grupo de alto riesgo de diagnóstico erróneo de SCA, principalmente debido a la tendencia de los médicos a subestimar el riesgo cardíaco. Hasta el 10% de los infartos de miocardio en los Estados Unidos ocurren en pacientes <de 45 años de edad, la mayoría de los cuales están relacionados con cardiopatía aterosclerótica. La enfermedad aterosclerótica se observó en el 17% de los adolescentes en un estudio,4 y la enfermedad multivaso se observó en el 20% de los adultos jóvenes (edad promedio: 26 años) en un estudio de autopsia de víctimas de violencia en el centro de la ciudad.5 Un estudio reciente de disfunción eréctil encontró que el 5,4% de los pacientes de 24 y 39 años de edad que presentaban dolor torácico presentaron un SCA, y el 2,2% tuvieron un evento cardíaco adverso (es decir, muerte, infarto de miocardio, necesidad de intervención coronaria percutánea o cirugía de bypass cardíaco) dentro de los 30 días.6 Aunque la incidencia global de SCA es menor en pacientes jóvenes, los médicos no deben descartar un IPH preocupante basándose exclusivamente en la edad del paciente.
La diabetes mellitus (DM) representa otra condición de alto riesgo en términos de potencial de diagnóstico erróneo de SCA. Los pacientes con DM son propensos a presentar síntomas indoloros cuando tienen isquemia cardíaca. Las presentaciones atípicas (por ejemplo, disnea, confusión, emesis, fatiga) ocurren en hasta el 40% de los casos. Los pacientes diabéticos también tienen más probabilidades de tener resultados adversos por SCA.7 Por lo tanto, los médicos encargados del tratamiento no deben confiar en las quejas típicas de presentación para iniciar un examen cardíaco en pacientes diabéticos, ni deben confiar en biomarcadores cardíacos positivos para impulsar un enfoque agresivo para el tratamiento en estos pacientes.
El consumo de cocaína debe considerarse un factor de riesgo independiente adicional para cardiopatía aterosclerótica e infarto de miocardio, especialmente en pacientes jóvenes. Algunos autores estiman que la cocaína representa hasta el 25% de los IM agudos en pacientes <45 años.7 El uso agudo de cocaína puede inducir vasoconstricción coronaria, aumento de la agregación plaquetaria y/o estimulación adrenérgica que conduce a arritmias e isquemia. El uso crónico de cocaína también se asocia con IM, causando aterogénesis marcadamente acelerada y posterior IM temprano. En general, los consumidores de cocaína tienen un riesgo de infarto de miocardio siete veces mayor.8
El lupus eritematoso sistémico (LES) es un factor de riesgo significativo pero poco apreciado para la aterosclerosis temprana y el infarto de miocardio. Se estima que los pacientes jóvenes con LES tienen un riesgo nueve veces mayor de infarto de miocardio temprano.9 Las mujeres < de 45 años, en particular, tienen un mayor riesgo, con estimaciones de un mayor riesgo de IM precoz de hasta cincuenta veces.10 La causa de la aterosclerosis prematura en el LES es probablemente multifactorial, pero en gran medida relacionada con la coexistencia de inflamación sistémica y dislipidemias.
La infección por el virus de inmunodeficiencia humana (VIH) también se ha identificado como un factor de riesgo independiente de aterosclerosis prematura. La evidencia sugiere que la infección por VIH causa lesión endotelial a los vasos coronarios, iniciando una cascada inflamatoria que conduce a lesiones ateroscleróticas.11 El hallazgo de aterosclerosis prematura es especialmente importante en pacientes con estadios tardíos de infección por VIH (recuento de CD4 <200).12 Los regímenes de medicamentos que se utilizan actualmente en el tratamiento del VIH (inhibidores de la proteasa) también exacerban el riesgo de aterosclerosis temprana. En general, los pacientes VIH con SCA se presentan a una edad más de 10 años menor que los pacientes no VIH.13
La enfermedad renal crónica (ERC) también se ha identificado recientemente como un factor de riesgo independiente para la aterosclerosis acelerada. La ERC se asocia con inflamación crónica14 y aumento de la agregación plaquetaria.15 Estos factores, combinados con una mayor prevalencia de factores de riesgo convencionales concomitantes, producen un riesgo desproporcionadamente alto de eventos cardíacos en estos pacientes.14
Aunque se debe obtener y evaluar dentro de los 10 minutos de la presentación en cuanto a isquemia cardíaca, el ECG no se debe utilizar para descartar SCA. Hasta el 50% de los pacientes con isquemia cardíaca o infarto tendrán un ECG inespecífico o normal.16 Los ECG seriados pueden aumentar el rendimiento diagnóstico al confirmar la presencia de SCA en pacientes con síntomas continuos.
Al igual que el ECG, los biomarcadores cardíacos son útiles cuando son positivos, pero tienen una utilidad limitada cuando son normales. Las pruebas seriadas de biomarcadores en el transcurso de 3─6 horas se han convertido en un protocolo de rutina en muchos EDs y tienen una excelente sensibilidad para detectar evidencia de IM. Sin embargo, no se puede confiar en los biomarcadores para descartar isquemia cardíaca. La validación prospectiva de la puntuación de «CORAZÓN» ha permitido a los profesionales diferenciar de manera confiable un subconjunto de pacientes de bajo riesgo que probablemente no se beneficiarían de pruebas adicionales.17
Las pruebas de esfuerzo y la angiografía coronaria se están utilizando con mayor frecuencia al inicio de la evaluación de pacientes con dolor torácico para determinar el SCA. Aunque una prueba de esfuerzo o angiografía negativa se asocia con un menor riesgo de EAC subyacente, ninguna de las pruebas puede descartar definitivamente un SCA o la presencia de trombosis coronarias subyacentes significativas. La mayoría de las modalidades de pruebas de esfuerzo detectan evidencia de lesiones coronarias significativas con solo 85 a 95% de sensibilidades.18-19 La angiografía coronaria también es una prueba imperfecta; las interpretaciones de angiografía falsa negativa no son infrecuentes en presencia de enfermedad difusa, placas excéntricas, oclusiones «rubor», lesiones ostiales de ramas, ramas laterales superpuestas e incluso cuando las lesiones están presentes dentro de la arteria coronaria principal izquierda.20 Además, los datos que indican que la mayoría de los IM se producen a partir de oclusiones dentro de arterias que anteriormente estaban obstruidas <50% antes de que se produjera el infarto comprometen la fiabilidad de estas pruebas.21-23
Este tipo de lesiones suelen asociarse con pruebas de esfuerzo negativas o angiogramas «no significativos» si las pruebas se realizan antes del infarto. Por su naturaleza de detección de estenosis coronaria fija, las pruebas de esfuerzo son incapaces de evaluar o predecir placas coronarias vulnerables que están en riesgo de desprenderse, lo que conduce a un evento coronario agudo. En un estudio de pacientes evaluados para SCA que tuvieron una prueba de esfuerzo negativa en los 3 años anteriores, más del 20% alcanzaron el índice compuesto de IAM, prueba de esfuerzo positiva, CABG o cateterismo con intervención, y la gran mayoría de las pruebas negativas ocurrieron dentro de 1 año de presentación.24 De manera similar, en pruebas aún más invasivas, hombres y mujeres con EAC normal o «mínima» en cateterismo cardíaco (1,2% y 3,3%, respectivamente) tuvieron IAM o fallecieron en el plazo de 1 año de seguimiento.25 Es vital que el médico no se base en pruebas objetivas previas frente a un paciente con signos y síntomas indicativos de SCA.
Resumen
La evaluación del dolor torácico y el posible SCA es un esfuerzo de alto riesgo. La decisión de realizar un «examen cardíaco completo» debe basarse principalmente en un HPI completo. Los médicos deben ser conscientes de la frecuencia de presentaciones atípicas, especialmente en mujeres, ancianos y pacientes diabéticos. Los pacientes jóvenes también merecen una consideración especial, ya que a menudo no se valora suficientemente su riesgo. Otros factores de riesgo cardiacos no tradicionales, como la cocaína, el lupus eritematoso sistémico, el virus de inmunodeficiencia humana y la enfermedad renal crónica, merecen atención adicional. Las pruebas diagnósticas consisten en electrocardiografía (útil para descartar el SCA, pero no para descartar el diagnóstico) y pruebas de biomarcadores cardíacos, que también son principalmente útiles cuando son positivas. Es importante destacar que la prueba de esfuerzo o angiografía negativa es muy útil para estratificar a los pacientes con un bajo riesgo de SCA y EAC, pero no descartan definitivamente el diagnóstico.
Cita: Palatnik M. Un hombre de 38 años con dolor en el pecho. J Medicina de Urgencias. Marzo de 2018. Disponible en: https://www.jucm.com/a-38-year-old-man-with-chest-pain/.
- Swap CJ, Nagurney JT. Valor y Limitaciones de los antecedentes de dolor torácico en la evaluación de pacientes con sospecha de síndromes coronarios agudos. JAMA. 2005;294:2623-2629.
- El-Menyar A, Zubaid M, Sulaiman K. Presentación atípica del síndrome coronario agudo: Un predictor independiente significativo de mortalidad intrahospitalaria. J Cardiol. 2011;57;165-171.
- Han JH, Lindsell CJ, Storrow AB, et al. El papel de la carga de factores de riesgo cardiacos en el diagnóstico de síndromes coronarios agudos en el entorno de urgencias. Ann Emerg Med. 2007;49;145-152.
- Tuzcu EM, Kapadia SR, Tutar E, et al. Alta prevalencia de aterosclerosis coronaria en adolescentes y adultos jóvenes asintomáticos: evidencia de ultrasonido intravascular. Circulación. 2001;103:2705-2710.
- Joseph A, Ackerman D, Talley JD, et al. Manifestaciones de aterosclerosis coronaria en jóvenes víctimas de trauma-un estudio de autopsia. J Am Coll Cardiol. 1993;222:459-467.
- Marsan RJ Jr., Shaver KJ, Sease KL, et al. Evaluación de una regla de decisión clínica para pacientes adultos jóvenes con dolor torácico. Acad Emerg Med. 2005;12:26-32.
- Fergus TS, Fazel R, Fang J, et al. Presentación, manejo y desenlaces de los pacientes diabéticos en comparación con los pacientes no diabéticos ingresados por síndromes coronarios agudos. Corazón. 2004;90:1051-1052.
- Qureshi AI, Suri MF, Guterman LR, et al. Consumo de cocaína y probabilidad de infarto de miocardio no mortal y accidente cerebrovascular: datos de la Tercera Encuesta Nacional de Examen de Salud y Nutrición. Circulación. 2001;103:502-506.
- D’Agate DJ, Kokolis S, Belilos E, et al. Enfermedad coronaria prematura en lupus eritematoso sistémico con reoclusión extensa después de la cirugía de revascularización coronaria. J Cardiol Invasivo. 2003;15:157-163.
- Manzi S, Meilahn EN, Rairie JE, et al. Tasas de incidencia específicas por edad de infarto de miocardio y angina de pecho en mujeres con lupus eritematoso sistémico: comparación con el estudio Framingham. Am J Epidemiol. 1997;145:408-415.
- Varriale P, Saravi G, Hernandez E, et al. Infarto agudo de miocardio en pacientes infectados por el virus de la inmunodeficiencia humana. Am Heart J. 2004; 147: 55-59.
- Hsue PY, Lo JC, Franklin A, et al. Progresión de la aterosclerosis evaluada por el grosor íntima-media de la carótida en pacientes con infección por VIH. Circulación. 2004;109:1603-1608.
- Hsue PY, Giri K, Erickson S, et al. Características clínicas de los síndromes coronarios agudos en pacientes con infección por el virus de inmunodeficiencia humana. Circulación. 2004;109:316-319.
- Yerkey MW, Kernis SJ, Franklin BA, et al. Disfunción renal y aceleración de la enfermedad coronaria. Corazón. 2004;90:961-966.
- Aggarwal A, Kabbani SS, Rimmer JM, et al. Efectos bifásicos de la hemodiálisis sobre la reactividad plaquetaria en pacientes con enfermedad renal terminal: un posible contribuyente al riesgo cardiovascular. Am J Enfermedad Renal. 2002;40:315-322.
- Brady WJ, Aufderheide TP, Chan T, et al. Diagnóstico electrocardiográfico de infarto agudo de miocardio. Emerg Med Clin North Am. 2001;19:295-320.
- Backus BE, Six AJ, Kelder JC, et al. Validación prospectiva de la puntuación CARDÍACA para pacientes con dolor torácico en el servicio de urgencias. Cardiología Interna. 2013;168;2153-2158.
- Ioannidis JPA, Salem D, Chew PW, et al. Precisión de las tecnologías de imagen en el diagnóstico de isquemia cardíaca aguda en el servicio de urgencias: un meta-análisis. Ann Emerg Med. 2001;37:471-477.
- Lateef F, Gibler WB. Pruebas provocativas para el dolor en el pecho. Am J Emerg Med. 2000;18:793-801.
- Schwartz L, Gourassa MG. Evaluación de pacientes con dolor torácico y coronariografías normales. Arch Int Med. 2001;161:1825-1833.
- Giroud D, Li JM, Urban P, et al. Relación del sitio del infarto agudo de miocardio con la estenosis arterial coronaria más severa en la angiografía previa. Am J Cardiol. 1992;69:729-732.
- Hackett D, Davies G, Maseri A. Las estenosis coronarias preexistentes en pacientes con primer infarto de miocardio no son necesariamente graves. Eur Heart J. 1988;9:1317-23.
- Hackett D, Verwilghen J, Davies G, et al. Estenosis coronaria antes y después del infarto agudo de miocardio. Am J Cardiol. 1989;63:1517-1518.
- Walker J, Galuska M, Vega D. Enfermedad coronaria en pacientes con dolor torácico en urgencias con pruebas de esfuerzo negativas recientes. West J Emerg Med. 2010;11;384-388.
- Hemingway H, McCallum A, Shipley M, et al. JAMA 2006; 295; 1404-1411.
