Breve descripción de dos tipos de muerte celular programada: apoptosis y autofagia
La apoptosis, o muerte celular programada tipo I, es la forma más ampliamente estudiada de muerte celular. Sus características morfológicas se pueden identificar bajo microscopía de luz, e incluyen contracción celular, compactación de la cromatina, formación de burbujas de la membrana citoplasmática y, finalmente, la formación de cuerpos apoptóticos (Figura 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
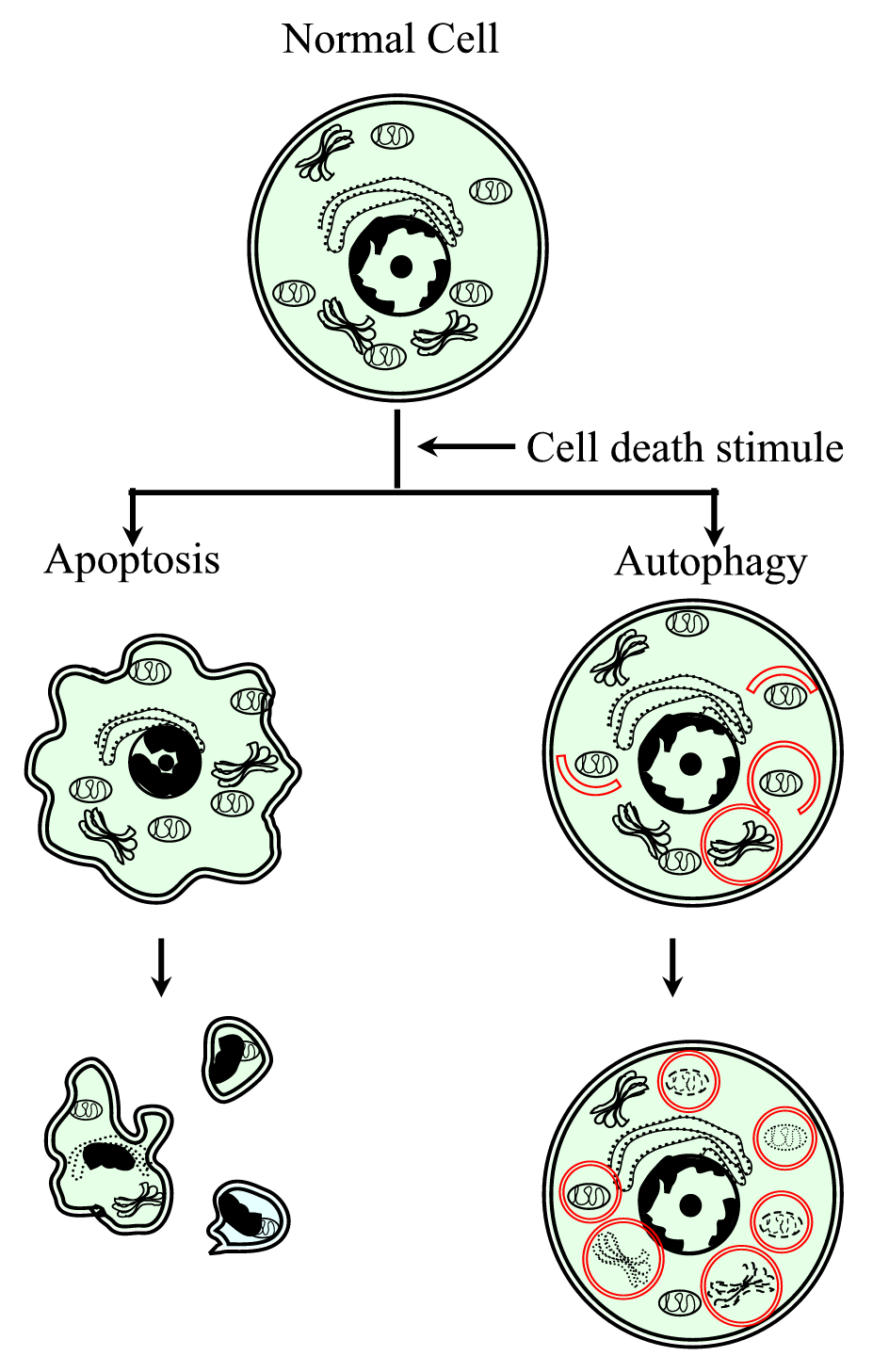
Figure 1.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceRepresentación esquemática del proceso de muerte celular programada tipo I (apoptosis) y tipo II (autofagia). La apoptosis se caracteriza por una contracción celular, compactación de la cromatina, brotes membranosos y la formación de cuerpos apoptóticos. La autofagia se caracteriza por la presencia de un gran número de autofagosomas con contenido citoplasmático. Ambos tipos de muerte celular no generan una respuesta inflamatoria ya que la membrana citoplasmática se conserva hasta que los restos celulares son eliminados por vecinos o por especialistas.
Las caspasas son proteasas específicas de cisteinil aspartato que se sintetizan en una forma inactiva como zimógenos llamados pro-caspasas (Figura 2). Es esta forma inactiva la que permite la ejecución controlada del proceso de muerte celular. Las caspasas se identificaron por primera vez en el nematodo Ceanorhabditis elegans, pero las formas homólogas están presentes en los mamíferos .
Las características distintivas de la apoptosis, como la fragmentación del ADN y la cromatina compactada, son el resultado de la actividad de la caspasa. Durante la apoptosis, el ADN se fragmenta en un tamaño de nucleosoma (200 pb) . El factor responsable de la fragmentación del ADN durante la apoptosis es una DNasa específica (CAD, DNasa activada por caspasa) que es activada por la caspasa-3 activa . La caspasa-3 activa, a su vez, está involucrada en cambios morfológicos celulares durante la apoptosis, donde escinde la quinasa-1 asociada a rho (ROCA-1) para activarla y esto, finalmente, afecta la disposición citoesquelética causando la morfología de contracción apoptótica .

Figura 2.
xmlns: xlink = «http://www.w3.org/1999/xlink » xmlns:mml = «http://www.w3.org/1998/Math/MathML » xmlns: xsi=»http://www.w3.org/2001/XMLSchema-instanceLas caspasas involucradas en el proceso apoptótico se sintetizan en una forma inactiva como zimógenos, están constituidas por un dominio pro, una subunidad grande y una subunidad pequeña. Los zimógenos se activan formando tetrámeros.
La muerte celular apoptótica está altamente regulada por los miembros de la familia del linfoma de células B 2 (Bcl-2). Los miembros de la familia Bcl-2 se han clasificado como proteínas antiapoptóticas y proapoptóticas de acuerdo con su homología Bcl-2 (HB) y organización de dominios (Figura 3). La presencia de los dominios BH1, BH2, BH3 y BH4 corresponde al grupo que inhibe la apoptosis. El grupo pro-apoptótico, por el contrario, se divide en dos grupos: aquellos con dominios BH1, BH2 y BH3, y aquellos con solo los dominios BH3 (definidos como solo BH3; ver la revisión en ). Esta familia de proteínas realiza sus funciones a nivel intracelular dentro de las mitocondrias, un elemento clave en la apoptosis.

Figura 3.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:proteínas de la familia del linfoma de células B 2 (Bcl-2) xsi=»http://www.w3.org/2001/XMLSchema-instance. A) Esquematización general de la estructura de las proteínas Bcl-2. B) Los miembros anti-apoptóticos-poseen los cuatro dominios BH. C) Los miembros pro-apoptóticos que a su vez se dividen en dos grupos: multidominio y BH3 solamente.
La apoptosis puede iniciarse por dos vías bien descritas: las vías extrínsecas e intrínsecas (Figura 4). La activación extrínseca se lleva a cabo mediante la participación de ligandos de muerte (como la superfamilia factor de necrosis tumoral – TNF, y ligandos inducidos por apoptosis relacionados con el TNF, o TRAIL) con sus receptores de muerte de superficie celular afines (como el receptor TNF 1, el Fas, el receptor TRAIL 1 o el receptor TRAIL 2) (revisado en ). Una vez que el ligando reconoce y se une a su receptor, se forman una serie de complejos intracelulares para activar las caspasas iniciadoras (como -8 y -10), que luego activan las caspasas ejecutoras (como -3, -6 y -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. La interacción ligando–receptor induce el ensamblaje del complejo de señalización inductor de muerte (DISC) para promover la activación de caspasa-8, que a su vez es capaz de activarse al ejecutor caspasa -3, -6 o -7, conduciendo a los cambios morfológicos de la apoptosis. La ruta intrínseca es dirigida por la permeabilización de la membrana externa mitocondrial, que permite la liberación de elementos pro-apoptóticos como el citocromo-C. El citocromo-C induce el factor activador de la proteasa de apoptosis 1 (Apaf-1) para promover la activación de la caspasa-9 para ensamblar el apoptosoma. El apoptosoma es capaz de activarse a las caspasas ejecutoras.
La vía apoptótica intrínseca, por el contrario, puede ser activada por varios estímulos, incluido el daño al ADN, la inanición del factor de crecimiento y el estrés oxidativo . Durante la exposición de las células a estos estímulos, las mitocondrias se ven afectadas, ya que varios miembros de la familia Bcl-2 se activan y promueven la permeabilización de la membrana externa de las mitocondrias (MOMP). La membrana de las mitocondrias externas permeadas permite la liberación del citocromo c (cyt c), que está asociado con la proteína Apaf-1. La unión del cyt c y el Apaf-1 se une al iniciador caspasa-9 para formar el complejo que constituye el apoptosoma, que tiene la capacidad de activar las caspasas iniciadoras que realizan sus funciones al escindir sustratos celulares específicos.
El segundo proceso de muerte celular, la autofagia, es un proceso genéticamente programado y conservado evolutivamente que produce la degradación de orgánulos y proteínas obsoletos. Se activa por estímulos extracelulares tales como hambre de nutrientes, hipoxia, alta temperatura y condiciones intracelulares alteradas, incluida la acumulación de orgánulos dañados o superfluos (revisado en ).
En organismos eucariotas, se han descrito tres tipos de autofagia: microautofagia, macroautofagia (comúnmente llamada simplemente autofagia) y autofagia mediada por chaperona (Figura 5). La microautofagia implica la envoltura de componentes citoplasmáticos directamente a nivel del lisosoma por medio de un proceso de invaginación, mientras que la macroautofagia implica la formación de vesículas de doble membrana que contienen componentes celulares, que se fusionan con lisosomas para formar un autofagolisosoma. Es en el interior del autofagolisosoma donde los componentes intra vesiculares son degradados y, si es posible, reciclados por la célula (revisados en ). La autofagia mediada por chaperonas, finalmente, implica la participación de chaperonas en el reconocimiento de las proteínas designadas para su eliminación por los lisosomas .

Figura 5.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instancerepresentaciones Esquemáticas de los diferentes mecanismos de la autofagia. La macroautofagia – autofagia-implica la formación de una vesícula de doble membrana, que envuelve el contenido citoplasmático que se llevará al lisosoma para ser degradado. La microautofagia se caracteriza por la absorción directa de los componentes citoplásmicos por el lisosoma. Este proceso implica la remodelación de la membrana del orgánulo mediante la formación de una invaginación de membrana lisosomal. Durante la autofagia mediada por chaperón, las proteínas que se degradan se dirigen a un Hsp70, que a su vez transporta la carga objetivo al lisosoma.
La autofagia está dirigida por genes Atg(relacionados con la autofagia), que son necesarios para activar el complejo de señalización que desencadena la formación de autofagosomas . Los atgenos se descubrieron en levaduras, pero muchos tienen ortólogos en eucariotas superiores (Figura 6). La formación de autofagosomas implica la participación de la proteína citoplasmática LC3 (Atg8), que sufre lipidación por fosfatidiletanolamina, y luego es reclutada a la membrana del autofagosoma naciente (Figura 7). La acumulación de proteína LC3 lipidificada (conocida como LC3-II) se utiliza como marcador de autofagia .

Figura 6.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. La proteína LC3 es lipidada por la fosfatidiletanolamina.
La muerte celular autofágica, o muerte celular programada de tipo II, se caracteriza por una envoltura masiva del citoplasma por vesículas autofágicas. Esta intensa actividad autofágica difiere sustancialmente de la autofagia que ocurre continuamente a niveles basales. Estudios ultraestructurales en Drosophila han revelado la acumulación de vacuolas autofágicas en la mayoría de los tejidos larvarios. Este tipo de muerte celular programada comienza con la degradación de los orgánulos citoplásmicos por autofagia, aunque los elementos citoesqueléticos se conservan hasta las últimas etapas del proceso (revisado en ).
