Introducción
Las células citotóxicas son esenciales en la lucha contra las células infectadas por virus y cancerosas. Estas células matan a través de tres vías diferentes, la liberación de gránulos líticos, la vía receptor-ligando del Saf o la vía RECEPTOR–SENDERO. Para el propósito de este artículo, nos centraremos en la degranulación. Cuando una célula citotóxica se encuentra con una célula diana, se adhiere firmemente a ella formando la sinapsis inmune. Los gránulos líticos se polarizan hacia la sinapsis inmunológica y se liberan desde la célula citotóxica dirigida hacia el objetivo (1). Estos gránulos contienen varios mediadores citotóxicos, como perforina y granzimas. La perforación liberada puede formar poros transitorios dentro de la membrana celular diana permitiendo que las granzimas entren en la célula diana. La entrada también está probablemente mediada por oligómeros de perforina que forman poros incompletos (arcos) (2), y también se ha sugerido que las granzimas y la perforina pueden ser absorbidas por las células diana a través de la vía endosómica (3, 4). Los datos en que se basan estos mecanismos propuestos se han debatido recientemente en detalle (5). Cuando las granzimas entran en las células diana, la vía de la caspasa se activa, lo que resulta en apoptosis (6, 7). La membrana de estos gránulos citotóxicos contiene glicoproteína de membrana asociada a lisosomas-1 (LAMP1), también conocida como CD107a (8). La parte luminal de la rata CD107a se expone transitoriamente al lado extracelular de la membrana celular después de la degranulación antes de que se internalice de nuevo. Por lo tanto, la tinción CD107a indica que se ha producido un evento de degranulación (9). Aunque todavía se está determinando el papel de CD107a, los estudios de siRNA contra CD107a han demostrado que es esencial para el tráfico de perforina dentro de las vesículas, ya que la entrega de perforina a gránulos líticos se inhibe en ausencia de CD107a (10). También se ha demostrado que el CD107a desempeña un papel en la protección de las células citotóxicas de la muerte al unirse a la perforina e impedir su inserción en la membrana celular (11).
Hay dos tipos principales de linfocitos citotóxicos, las células asesinas naturales (NK) y las células T CD8. Ambos tipos celulares matan a través de la liberación de gránulos líticos, la vía del receptor Fas/ligando Fas y la vía del receptor TRAIL/TRAIL, pero el estímulo necesario para activar estos dos grupos celulares es diferente. Las células T reconocen el antígeno presentado por las moléculas MHC clase I a través de su receptor activador de células T (TCR), mientras que las células NK reconocen los antígenos de las células diana a través de varios receptores inhibitorios y activadores. Los receptores inhibitorios son importantes para evitar que las células NK destruyan las células sanas, mientras que los receptores activadores inducen la citotoxicidad de las células NK.
Antes de la identificación de CD107a como marcador de degranulación en células NK (12), la salida para medir la capacidad citotóxica era la muerte de las células diana. La detección de CD107a por citometría de flujo permitió a los investigadores identificar las células efectoras específicas con capacidad citotóxica. Desde su descubrimiento, se ha completado una amplia gama de publicaciones de datos de estudios en ratones y seres humanos que muestran la ventaja de usar un anticuerpo anti-CD107a. La rata es un valioso modelo inmunológico animal para estudiar enfermedades como la leucemia y el injerto vs. enfermedad del huésped (13), pero las lecturas funcionales se han visto obstaculizadas por la falta de anticuerpos específicos anti-rata CD107a de alta calidad para citometría de flujo. Este artículo describe la creación de un anticuerpo contra CD107a de rata y la caracterización de la respuesta de degranulación en células T CD8+ y NK de rata.
Materiales y métodos
Animales
Hámsteres consanguíneos armenios (Cytogen Research and Development Inc. UU.) se alojaron en el Departamento de Medicina Comparada de Rikshospitalet, Hospital Universitario de Oslo, de acuerdo con las directrices institucionales. Las cepas de rata PVG-RT1U, PVG-RT7b, PVG-RT1N y PVG-R23 se utilizaron indistintamente y se mantuvieron durante más de 20 generaciones y se alojaron de conformidad con las directrices establecidas por la Junta de Animales Experimentales dependiente del Ministerio de Agricultura de Noruega y por el Convenio Europeo para la Protección de los Animales Vertebrados utilizados con Fines Experimentales y Otros Fines Científicos. Se utilizaron ratas a las 8-12 semanas de edad. Las instalaciones para animales de laboratorio se someten a un programa de vigilancia de la salud de rutina y se someten a pruebas de detección de organismos infecciosos de acuerdo con una modificación de las recomendaciones de la Asociación Europea de Ciencia de Animales de Laboratorio. Los experimentos con animales se regularon mediante reglamentos de laboratorio, que se establecen en la Ley de Bienestar Animal, en la que Noruega sigue la dirección de laboratorio de la UE y el convenio europeo de laboratorios.
Abs y reactivos
Anticuerpos contra NKp46, NKR-P1A 3.2.En nuestro laboratorio se fabricaron 3-PB o no conjugados (solo se unen NKR-P1A, pero no NKR-P1B, en la cepa PVG), CD8 (OX8-biotina), CD2 (OX34, no conjugado), TCR (R73-Alexa647), alotipo IGD b de ratón (TIB96-no conjugado, utilizado como isotipo IgG de ratón) y CD45.2 (His41-FITC, utilizado como isotipo IgG de ratón). conjugado según protocolos estándar. Se compraron anticuerpos contra CD3 (IF4, no conjugado) y su isotipo IgM de ratón (MM-30, no conjugado) y control del isotipo IgG de hámster armenio (HTK88-FITC) de Biolegend (San Diego, CA, EE.UU.). Los anticuerpos comerciales anti-CD107a se compraron en AbCam (Cambridge, Reino Unido) (H4A3-FITC), eBioscience (San Diego, CA, EE.UU.) (ID48-PerCP-eFluor) y Lifespan (Seattle, WA, EE. UU.) (LS-C8580-no conjugado). LS-C8580 fue conjugado con Alexa488 NHS ester (Sigma-Aldrich, st Louis, MO, USA) para su uso en ensayos funcionales. Se compraron anticuerpos anti-BANDERA (M2, no conjugados) e IgG anti-ratón (policlonal de cabras-FITC) a Sigma-Aldrich (St.Louis, MO, EE. UU.). La IL-2 se obtuvo de un sobrenadante de cultivo celular dializado de una línea celular de ovario de hámster chino (CHO) transfectada de forma estable con una construcción de expresión de IL-2 de rata. La estreptavidina conjugada con Proteína Clorofila a de peridinina (PerCP), el control policlonal del isotipo IgG de hámster FITC, el control del isotipo IgG1 de ratón FITC (MOPC-FITC) y el GolgiStop se compraron a BD biosciences (Franklin Lakes, NJ, EE.UU.). El hámster anti-armenio de cabra (policlonal-FITC) fue comprado a Jackson Immunoresearch (West Grove, PA, EE. UU.). Los sobrenadantes de hibridomas OX41, CD172a (SIRPa), R73 (anti-rata TCRaß), OX19 (anti-CD5), OX12 (cadena anti-Igk) y OX33 (anti-CD45RA) se fabricaron internamente. El suero de hámster de control se derivó de hámsters armenios no inmunizados.
La clonación de CD107a de rata
El CD107a de rata fue amplificado por PCR a partir de ADNc generado a partir de esplenocitos de rata PVG y subclonado en un vector de expresión pMX que contenía un gen de resistencia a la puromicina (un generoso regalo del Dr. Michael R. Daws) (14). Los cebadores CD107 se diseñaron sobre la base de una secuencia cDNA rat CD107a (LAMP1) (GenBank: NM_012857). Imprimación delantera: 5′-GCCCCAGCACTGTTCGAGGT-3′; Imprimación inversa: 5′-GTTGTTACCGTCCTGTACACACT-3′. Se utilizó un péptido líder aniónico tripsina-1 (MSALLILALVGAAVA) en el vector de expresión, y la región transmembrana CD107 original fue reemplazada por un fragmento transmembrana CD8 para facilitar la expresión de alta superficie. Se ligó una etiqueta DE BANDERA (DYKDDDDK) al terminal N de la proteína CD107 para que la expresión de la superficie fuera detectable. Todas las secuencias insertadas y el marco de lectura abierto en la construcción final del plásmido quimérico se examinaron y confirmaron mediante secuenciación de ADN de Sanger.
BWZ transfectante.Se sembraron 36 Células con plásmido pMX-CD107a
293 células T en una placa de cultivo celular de 6 pocillos con medio RPMI 1640 de 4 ml, se transfectaron con reactivo FuGENE6 de 7,5 µl (protocolo del fabricante Roche) y se incubaron a 37°C con 5% de CO2. El reactivo FuGENE6 se diluyó previamente con Opti-MEM (Gibco) y se mezcló con 1,5 µg de plásmido pMX-CD107a y 1 µg de plásmido retroviral específico para roedores pCL-ECO (Addgeno #12371). Veinticuatro horas después de la transfección, el sobrenadante se descantó y se reemplazó con medio RPMI1640 con 2% de FBS y se transfirió a 32°C para la producción retroviral. Cuarenta y ocho horas más tarde, el sobrenadante se recolectó y filtró con un filtro Filtropur S de 0,2 µm (Sarstedt) y se guardó a -80°C para la transducción retroviral.
El 105 BWZ.se sembraron 36 células por pocillo en una placa de cultivo celular de 24 pocillos (Corning) y se cultivaron con medio RPMI1640 fresco con 10% de FBS, durante la noche. Se eliminó el sobrenadante y se añadió RPMI1640 que contenía 10% de FBS, 16 µg de polibreno (hasta una concentración final de 8 µg/ml) y 1,5 ml de sobrenadante retroviral y se centrifugó a 32°C a 2400 rpm durante 2 h. Las células se incubaron a 32 ° C durante 1 h, después de lo cual se retiró el sobrenadante y se reemplazó con un medio RPMI1640 fresco con 10% de FBS y se cultivó durante 3 días, a 37°C con 5% de CO2 (en el día 2, se pudo usar un medio completo con 1 ng/ml de puromicina). Los transfectantes BWZ. CD107a-FLAG expandidos se examinaron para determinar la expresión superficial de la etiqueta-FLAG y luego se utilizaron para inmunizaciones de anticuerpos o pruebas de detección de anticuerpos.
Generadores de CD107A Que expresan Transfectantes
El plásmido CD107A de rata quimérica se transfectó a células CHO. Brevemente, las células CHO se cultivaron en medio RPMI1640 completo (cRPMI; medio RPMI1640 con 10% de FBS, Piruvato Na de 1 mm, 2-mercaptoetanol de 50 µm) hasta que alcanzaron una confluencia del 30%. El plásmido de 2,5 µg se mezcló con 7,5 µl de reactivo Fugene 6 (Roche) y se añadió a las células de forma gota a gota. Dos días después, las células CHO se separaron con medio RPMI1640 suplementado con EDTA de 2 mm y se sembraron en placas de cultivo celular de fondo plano de 96 pocillos (25 células / pocillo) con medio de selección (cRPMI suplementado con puromicina de 20 µg/ml) para la clonación de transfectantes estables. Después de 10-12 días de cultivo, los clones adultos se examinaron con anticuerpos anti-BANDERA (M2). Uno de los clones que expresaba el nivel de superficie más alto de FLAG y CD107a se utilizó para inmunizaciones.
Inmunización y fusión celular
Los hámsteres consanguíneos armenios de 3 a 10 semanas de edad fueron inmunizados mediante inyecciones intraperitoneales (i.p.) con 2 × 106 células CHO.CD107a una vez a la semana durante 3 semanas. Se administró un refuerzo con células BWZ.CD107a-FLAG 4 × 106 transfectadas de forma estable 32 días después de la primera vacunación y se analizaron los sueros para determinar la tinción de superficie de las células CHO.CD107a-FLAG y BWZ. Transfectantes DE LA BANDERA CD107a. Dos de los tres animales dieron positivo, y 3 días después de la estimulación, se recolectaron y agruparon células del bazo de los dos animales, uno de los cuales tenía esplenomegalia. Alrededor de 2,0 × 108 células de bazo y 1,4 × 108 células de mieloma NS0 se lavaron tres veces en DMEM con aditivos (piruvato de sodio de 1 mm, 2-mercaptoetanol de 0,05 mm y antibiótico/antimicótico) y se centrifugaron a 90 g durante 10 min. Manteniendo todo a 37°C desde este punto en adelante, el gránulo se disolvió golpeando el tubo y se añadió glicol de polietileno precalentado 1500 (Roche) gota a gota mientras se agitaba suavemente durante 1 minuto. Se agregaron gradualmente tres mililitros de DMEM con aditivos durante los siguientes 3 minutos de acabado con 7 ml adicionales antes de centrifugar a 500 g. El pellet se lavó con lavado cuidadoso (sin resuspensión) con DMEM con aditivos y 20% de FBS (DMEM-20) y se cultivó durante la noche. Se recolectaron células al día siguiente y se agregaron 100 ml de DMEM-20 con 2× hipoxantina–aminopterina–timidina (SIGMA) y suplemento de clonación de hibridoma (HCS) (PAA) al 10%. La suspensión de la celda se transfirió a placas de 96 pocillos. Después de 12 días, los sobrenadantes de clones en crecimiento se probaron mediante citometría de flujo para la tinción de antígenos de superficie presentes en BWZ.CD107a-FLAG y CHO.CD107a-FLAG, pero no en BWZ.36 células transfectadas con antígenos irrelevantes marcados como controles negativos. Los 9 de 12 clones positivos que producen anticuerpos específicos se subclonaron con DMEM-20 suplementado con hipoxantina-timidina y HCS. Solo un clon (SIM1) todavía producía anticuerpos después de la subclonación y esto fue subclonado una vez más. Se detectaron anticuerpos IgG específicos de hámster CD107a mediante IgG antiarmenias de hámster FITC (Jackson Immunoresearch). El anti-CD107a del hibridoma SIM1 se purificó con la proteína HiTrap G HP (GE Healthcare, Life Sciences) y se conjugó con FITC de acuerdo con procedimientos estándar o con Alexa488 de acuerdo con el protocolo del fabricante.
Generación de Células Efectoras
Se prepararon suspensiones unicelulares a partir del bazo. Los linfocitos se aislaron utilizando un gradiente de Linfoprep y luego se corrieron sobre una columna de lana de nylon para eliminar las células B y los macrófagos. Para la generación de células NK activadas por IL-2 (LAK), las células restantes se cultivaron durante la noche en IL-2. Al día siguiente, las células no adherentes se eliminaron lavando con PBS y las células NK adherentes se mantuvieron en RPMI suplementado con IL-2, 10% de FBS inactivado por calor, 1% de estreptomicina/Penicilina, 1 mm de piruvato de sodio y 50 µM de 2-mercaptoetanol. Las células se cultivaron durante 8-10 días. Para la generación de células NK enriquecidas o células T y NK clasificadas, las células se enriquecieron mediante selección negativa después del paso de lana de nylon. Para el enriquecimiento de las células NK, se recubrieron con anticuerpos anti macrófagos (OX41), células T (R73 y OX19) y células B (OX12 y OX33) los dinabeads de IgG pan-mouse (Invitrogen Dynal). Para el enriquecimiento de las células T, se tiñeron con anticuerpos anti macrófagos (OX41) y células B (OX12 y OX33) los dinabases de IgG pan-mouse. Las células se enriquecieron con dos pasos de selección negativa con cuentas teñidas durante 30 minutos a 4°C. Las células NK enriquecidas tenían una pureza de aproximadamente el 50-60% y se utilizaron para estudios de degranulación. Las células T enriquecidas (79-85% de pureza) se clasificaron para células TCR+ utilizando un Aria FACS (BD Biosciences).
Ensayos de degranulación
Para medir la respuesta de degranulación mediante tinción con anti-CD107a de rata (SIM1) durante la estimulación de las células diana, se incubaron efectores NK y células diana YAC, a una proporción de 1 a 1 de 3 × 105 células / pocillo (a menos que se indique lo contrario) en medios que contienen el SIM1 mAb, los otros anticuerpos anti-CD107a disponibles comercialmente o control de isotipos. Para medir la respuesta de degranulación a la estimulación de anticuerpos de células NK, utilizamos placas de fondo plano de 96 pocillos recubiertas con concentraciones variables de anti-NKp46 (Wen23), anti-NKR-P1A (3.2.3) y un control de isotipo IgG1 en ratón (TIB96). Al día siguiente, las placas se lavaron con PBS y se bloquearon con cRPMI antes de agregar por pocillo células NK enriquecidas de 3 × 105 suspendidas en cRPMI que contenían SIM1. Para medir la degranulación de las células T, se clasificaron y cultivaron en IMRC con IL-2 durante 2-3 días. Las placas de fondo plano de 96 pocillos se recubrieron durante la noche con anticuerpos contra CD3 (IF4), CD2 (OX34) o un control de isotipo IgM (MM-30). Se agregaron aproximadamente 3 × 105 células T por pocillo en cRPMI que contenía SIM1. Todos los ensayos se incubaron durante 4 h. Se añadió Golgistop durante las últimas 3 h de incubación para evitar la degradación de CD107a internalizado. Las células se lavaron y teñieron con anticuerpos hacia los receptores de superficie apropiados y se analizaron utilizando el FACS Canto o LSR II (BD Biosciences).
Ensayo de liberación de cromo
Células diana YAC-1 (5 × 106 células/ml cRPMI) con 3 añadidos.Se incubaron 7 MBq51Cr a 37°C durante 1 h, revolviendo cada 15 min. Las células se lavaron tres veces con PBS con 2% de FBS y se resuspendieron a 1 × 105 células / ml en cRPMI. Las células efectoras de LAK y las células diana se platearon en las proporciones especificadas en un volumen final de 200 µl. Las células se centrifugaron y se incubaron durante 4 h a 37 ° C. La liberación específica de 51Cr se midió utilizando el Cobra auto-gamma (Packard).
Resultados
Para crear un anticuerpo contra CD107a, creamos un vector de expresión que contiene la región de la membrana extracelular de CD107A de rata, la región transmembrana de CD8 de rata, y una etiqueta de BANDERA terminal de 3’para detectar la expresión de la superficie (Figura 1A). El vector fue transfectado a células CHO y a la BWZ.Línea de células T 36 y cribado para la expresión de CD107a utilizando un anticuerpo anti-BANDERA (M2) (Figura 1B). Las células CHO transfectadas de forma estable CD107a se inyectaron en hámsteres consanguíneos armenios una vez a la semana durante 3 semanas con un refuerzo final de células BWZ transfectadas de forma estable CD107a 3 días antes de la fusión con la línea celular de mieloma NS0. Los sobrenadantes de los diferentes clones se probaron para determinar su especificidad hacia BWZ. CD107a-FLAG, pero no hacia BWZ con etiqueta de BANDERA irrelevante.36 transfectantes. Se encontró que un clon, SIM1, se unía específicamente al transfectante que expresaba CD107a, pero no al control transfectado de FLAG (Figura 1C).

la Figura 1. Generación de un anticuerpo monoclonal CD107a anti rata (SIM1). A) Mapa vectorial esquemático del vector de expresión pMX con péptido líder, etiqueta DE BANDERA, inserto CD107a y el dominio transmembrana de CD8. B) Ovario de hámster chino y ZBW transfectados de forma estable.se analizaron 36 células para determinar la expresión de la superficie celular de CD107a marcado con BANDERA utilizando un anticuerpo anti-BANDERA (M2) (histogramas sombreados). El control negativo es un anticuerpo secundario solo (histograma transparente). C) Las células BWZ transfectadas con CD107A-FLAG o antígeno irrelevante (NKR-P1F-FLAG) se teñieron con suero de control de hámster, sobrenadante SIM1 o un anticuerpo anti-FLAG (M2).
El clon SIM1 se probó posteriormente en ensayos funcionales en paralelo con dos anticuerpos CD107a disponibles comercialmente, que podrían reaccionar de forma cruzada con CD107a de rata en citometría de flujo. Los clones de anticuerpos analizados fueron H4A3 de AbCam (que reacciona de forma cruzada con humanos, ratas, ratones y primates en citometría de flujo) y el clon de anticuerpos LS-C8580 de LifeSpan BioSciences (que reacciona de forma cruzada con CD107a de ratones, humanos y ratas en inmunohistoquímica y Western blots según el sitio web del fabricante). Nuestro clon de anticuerpos SIM1 identificó células degranuladoras en presencia de células diana y mostró poca tinción de fondo en ausencia de diana (panel superior Figura 2A). El clon H4A3 tiñó el porcentaje más alto de células NK después de la estimulación de la célula diana (panel central). Sin embargo, también hubo un alto nivel de tinción de fondo en ausencia de células diana, lo que indica una unión inespecífica. Se midieron niveles muy bajos de degranulación, si los hubiera, con el clon de mAb LS-C8580 (panel inferior). La especificidad de estos anticuerpos se confirmó mediante tinción positiva del transfectante de BANDERA BWZ. CD107a, pero no de BWZ.Control de bandera NKR-P1F (Figura 2B). El clon de anticuerpos H4A3, que se ha demostrado que se une a CD107a humano (16), no tiñó células BWZ transfectadas con CD107a de rata, lo que indica que no hay reacción cruzada con CD107a de rata. El clon anti-ratón CD107a ID48 tampoco tiñó el transfectante CD107a de rata. LS-C8580 no conjugado, por otro lado, mostró tinción específica de células transfectadas CD107a (datos no mostrados). Sin embargo, el clon LS-C8580 solo está disponible como anticuerpo no conjugado que no es adecuado para estudios de degranulación. Lamentablemente, los intentos repetidos en nuestro laboratorio de conjugar LS-C8580 con Alexa488 no han proporcionado conjugados de tinción fuertes, aunque el pequeño tamaño de la muestra y la concentración de LS-C8580 pueden ser la causa de la mala conjugación. La LS-C8580 conjugada muestra una tinción reducida pero específica de las células transfectadas CD107a (Figura 2B), pero como se muestra en la Figura 2A, no pudimos detectar células degranuladoras durante los ensayos funcionales con este conjugado. En conclusión, el SIM1 mAb tiñe específicamente las células NK de rata degranuladoras después de la estimulación con células diana.

la Figura 2. SIM1 mide la degranulación de los linfocitos T citolíticos naturales (NK) y CD8. A) Se midió el porcentaje de células degranulación utilizando anticuerpos anti-CD107a SIM1, H4A3 y LS-C8580, con o sin células diana YAC-1 como estímulo. Se muestra un experimento representativo de cuatro (B). Tinción de la línea celular BWZ. CD107a-FLAG con clones de anticuerpos SIM1, H4A3, LS-C8580 o ID48. BWZ.36 células transfectadas con antígeno marcado con BANDERAS irrelevantes (BWZ.NKR-P1G-FLAG) se incluyó como control negativo, (C) se estimularon células NK enriquecidas con anti-NKp46, anti-NKR-P1A o IgG1 de ratón como control de isotipos, y se utilizó SIM1 para medir el porcentaje de células degranuladoras. Las celdas NKp46+ (Wen23) o NKR-P1Abright (3.2.3) estaban cerradas. D) Se clasificaron las células TCR+ (pureza del 99%) y se cultivaron en IL-2 durante 2-3 días. Las células fueron estimuladas con control de isotipos anti-CD3 y anti-CD2 o IgM de ratón unido a placas para anti-CD3. El panel inferior muestra estimulación con anti-CD3 y anti-CD2 y tinción con un control de isotipo SIM1 (policlonal IgG de hámster FITC). Las células T se clasificaron utilizando anticuerpos R73-Alexa647 y 3.2.3-PB, conectando las células R73+/3.2.3. Los datos mostrados provienen de un experimento representativo de tres experimentos independientes separados.
La estimulación directa de los receptores NK activadores a través de anticuerpos unidos a placas es otro método potente para inducir la degranulación. Para probar el clon SIM1 en este ensayo funcional, incubamos células NK enriquecidas en placas recubiertas con anticuerpos hacia los receptores activadores NKp46 y NKR-P1A (Figura 2C). Como control negativo, las placas se recubrieron con control de isotipo IgG1 de ratón. La tinción con el anticuerpo SIM1 identificó 25,5 o 44% de células degranuladoras después de la estimulación de células NK en placas recubiertas con 5 µg/ml anti-NKp46 o anti-NKR-P1A, respectivamente. El porcentaje de células degranuladoras aumentó aún más cuando las placas se recubrieron con una mayor concentración de anticuerpos estimulantes (10 µg/ml). No se indujo degranulación en pocillos recubiertos con el control del isotipo IgG1 de ratón.
Vimos claramente la degranulación en células NK estimuladas con células diana o con anticuerpos contra receptores de activación mediante el uso de nuestro anticuerpo SIM1. También queríamos confirmar esto en células T citotóxicas. Las células T se clasificaron a partir de células del bazo y se cultivaron en IL-2 durante 2-3 días. A continuación, se estimularon las células T con anti-CD3 y anti-CD2 unidos a placas (Figura 2D). La degranulación se midió a partir de células T CD8+ cultivadas cuando se estimuló con anti-CD3 y anti-CD2 en los días 2 y 3. No se midió degranulación a partir de células T CD4 no citotóxicas, o después de la estimulación con anticuerpos de control de isotipos, lo que demuestra aún más la especificidad de nuestro anticuerpo SIM1.
Las células asesinas activadas por linfoquina (LAK) se crean mediante el cultivo de células NK en IL-2 durante 7-10 días y se usan comúnmente como células efectoras muy potentes en ensayos de liberación de cromo para estudiar la citotoxicidad y, por lo tanto, deben ser capaces de generar altos niveles de degranulación. Para medir la degranulación de células LAK, inicialmente usamos un 1:1 relación del efector con los objetivos, pero se encontraron niveles inesperadamente bajos de degranulación (datos no mostrados). Sin embargo, al hacer una titulación para encontrar proporciones óptimas de efector a objetivo, vimos que se podían lograr niveles crecientes de degranulación cuando las proporciones de efector a objetivo estaban por debajo de 1 (Figura 3A). Por lo tanto, la relación óptima para los ensayos de degranulación contrasta con los ensayos de citotoxicidad, en los que el nivel de citotoxicidad aumenta con mayores relaciones efector: objetivo (Figura 3B).
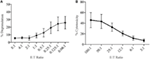
la Figura 3. Efecto bajo:las proporciones objetivo son importantes para garantizar una sensibilidad adecuada en los ensayos de degranulación con células NK de rata. A) Degranulación de células LAK cultivadas de 8 a 10 días en IL-2 contra objetivos YAC-1 a diferentes proporciones de efector:objetivo. (B) Se confirmó la citotoxicidad de LAK cultivada con IL-2 contra células diana YAC-1 con el ensayo de liberación de cromo completado en los días 8-10. Todos los gráficos son acumulativos de tres o más experimentos separados con barras que muestran SD.
Discusión
En la prueba inicial de SIM1 y los diferentes anticuerpos CD107a comerciales en ensayos de degranulación en ratas, elegimos un pequeño rango de relaciones efectores a objetivos con un sesgo hacia más células efectoras que objetivos según la literatura actual (12, 16, 17). La proporción de efectores a células objetivo puede variar de un papel a otro, pero estudios anteriores en los que se valoraron las proporciones de efectores a células objetivo han demostrado que la degranulación óptima de las células NK de ratón alcanzó un máximo de 4,5: 1 con las células objetivo YAC – 1 (18) y las células NK humanas mató mejor a las células K562 en una proporción de 5:1 o 10:1 (12). Sin embargo, cuando se utiliza un rango más amplio de proporciones de efectores a objetivos, se muestra que la degranulación con células LAK de rata se indujo de manera más efectiva cuando se utilizan cuatro o más objetivos por célula efectora. Esta diferencia en la relación efector / objetivo óptima entre la rata y otras especies podría deberse al tipo de células objetivo utilizadas, ya que en las titulaciones de la relación efector / objetivo humano y de ratón en los estudios mencionados anteriormente se utilizaron células objetivo originarias de la misma especie. Las células efectoras pueden ser más sensibles a las células objetivo de la misma especie y, por lo tanto, necesitan menos células objetivo para activarse. La línea celular YAC-1 utilizada en nuestro estudio es un linfoma de células T de ratón, que ha sido el estándar durante muchos años para estimular la citotoxicidad de las células NK de rata. No podemos excluir que el uso de una célula diana de rata resultaría en una estimulación más fuerte de las células NK y, posteriormente, se necesitarían menos células diana para inducir la degranulación.
También se desprende claramente de este estudio que las proporciones de efector a objetivo utilizadas para los ensayos de citotoxicidad no se correlacionan bien con las proporciones necesarias para medir la respuesta óptima de degranulación en las células efectoras. Esto no es sorprendente, ya que la lectura de estos dos ensayos es diferente, con la citotoxicidad midiendo la muerte celular diana y la degranulación midiendo la respuesta NK a los objetivos.
En conclusión, hemos elevado un anticuerpo contra CD107a (SIM1) de rata y caracterizado su capacidad para detectar degranulación en linfocitos citotóxicos en rata. Hemos demostrado que SIM1 es específico para las células degranulación, y a través de la optimización del protocolo de degranulación, hemos determinado que el uso de proporciones de células efectoras:diana inferiores a 1:4 garantiza una estimulación óptima de las células LAK. El desarrollo de CD107a (SIM1) anti rata permite un mejor análisis y caracterización de las respuestas citotóxicas de los linfocitos de rata y será una herramienta valiosa en los muchos modelos de enfermedades de la rata.
Declaración de ética
El estudio está aprobado por la Autoridad Nacional de Investigación Animal (FDU) de Noruega (número de permiso: ID-1698).
Contribuciones de los autores
AS ha sido responsable del análisis de expresiones, ensayos funcionales y redacción del manuscrito. K-ZD ha realizado la clonación de ADNc y la generación de transfectantes. JTV ha participado en la planificación y supervisión del proyecto, y en la redacción del manuscrito. LK ha sido responsable de las vacunas, la tecnología de hibridoma, la redacción del manuscrito y la supervisión del proyecto.
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Los autores agradecen a Ulla Heggelund y Stine Martinsen la asistencia técnica en el laboratorio, y al personal de la instalación para animales del Departamento de Medicina Comparada de Rikshospitalet, Hospital Universitario de Oslo, la ayuda con las vacunas. Gracias a Marit Inngjerdingen por las discusiones científicas.
Financiación
La investigación fue financiada por la Universidad de Oslo, Región de Salud del Sudeste de Noruega (2009104), y Legatet til Henrik Homans Minde.
1. Orange JS. Formación y función de la sinapsis inmunológica de células NK líticas. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038/nri2381
PubMed Abstract | CrossRef Texto Completo | Google Scholar
2. Metkar SS, Marchioretto M, Antonini V, Lunelli L, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. Los poros perforados de la membrana endosomal desencadenan la liberación de granzima B endocitosada en el citosol de las células diana. Nat Immunol (2011) 12(8):770-7. doi:10.1038 / ni.2050
PubMed Abstract | CrossRef Texto Completo | Google Scholar
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforina y granzimas: función, disfunción y patología humana. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens A, Benestad HB, Vaage JT, et al. Un segundo trasplante profiláctico de médula ósea con CMH no coincidente protege contra la leucemia mieloide aguda (LMNB) en ratas sin enfermedad letal de injerto contra huésped. Trasplante (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
PubMed Abstract | CrossRef Texto Completo | Google Scholar
14. Onishi M, Kinoshita S, Morikawa Y, Shibuya A, Phillips J, Lanier LL, et al. Aplicaciones de la clonación de expresión mediada por retrovirus. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Reducción de la degranulación de las células NK en pacientes con herpes recurrente frecuente. Vacuna Inmunol de Clin(2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed Abstract | CrossRef Texto Completo | Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Wood SM, Björkström NK, Long EO, et al. Análisis funcional de células NK humanas por citometría de flujo. Methods Mol Biol (2010) 612: 335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
