

El dióxido de carbono (CO2) es un compuesto químico. Es un gas a temperatura ambiente. Está hecho de un carbono y dos átomos de oxígeno. Las personas y los animales liberan dióxido de carbono cuando exhalan. Además, cada vez que se quema algo orgánico (o se hace un fuego), produce dióxido de carbono. Las plantas usan dióxido de carbono para producir alimentos. Este proceso se denomina fotosíntesis. Las propiedades del dióxido de carbono fueron estudiadas por el científico escocés Joseph Black en la década de 1750.
El dióxido de carbono es un gas de efecto invernadero. Los gases de efecto invernadero atrapan la energía térmica. Los gases de efecto invernadero cambian el clima y el tiempo en nuestro planeta, la Tierra. Esto se llama cambio climático. Los gases de efecto invernadero son una causa del calentamiento global, el aumento de la temperatura de la superficie de la Tierra.
Función biológica
El dióxido de carbono es un producto final en organismos que obtienen energía de la descomposición de azúcares, grasas y aminoácidos con oxígeno como parte de su metabolismo. Este es un proceso conocido como respiración celular. Esto incluye todas las plantas, animales, muchos hongos y algunas bacterias. En los animales más altos, el dióxido de carbono viaja en la sangre desde los tejidos del cuerpo hasta los pulmones, donde se exhala. Las plantas absorben dióxido de carbono de la atmósfera para usarlo en la fotosíntesis.
Hielo seco
El hielo seco, o dióxido de carbono sólido, es el estado sólido del gas de CO2 por debajo de -109,3 ° F (-78,5°C). El hielo seco no se produce de forma natural en la tierra, sino que está hecho por el hombre. Es incoloro. Las personas usan hielo seco para hacer que las cosas se enfríen y para hacer que las bebidas tengan gas, matar las gopers y congelar las verrugas. El vapor de hielo seco causa asfixia y, finalmente, la muerte. Se recomienda precaución y asistencia profesional siempre que se use hielo seco.

A presión habitual, no se derrite de un sólido a un líquido, sino que cambia directamente de un sólido a un gas. Esto se llama sublimación. Cambiará directamente de un sólido a un gas a cualquier temperatura más alta que las temperaturas extremadamente frías. El hielo seco se sublima a temperatura normal del aire. El hielo seco expuesto al aire normal emite dióxido de carbono que no tiene color. El dióxido de carbono se puede licuar a una presión superior a 5,1 atmósferas.
El gas de dióxido de carbono que se desprende del hielo seco es tan frío que, cuando se mezcla con el aire, enfría el vapor de agua en el aire para empañarlo, lo que parece un humo blanco espeso. A menudo se usa en el teatro para crear la apariencia de niebla o humo.
Aislamiento y producción
Los químicos pueden obtener dióxido de carbono del aire de refrigeración. A esto lo llaman destilación del aire. Este método es ineficiente porque se debe refrigerar una gran cantidad de aire para extraer una pequeña cantidad de CO2. Los químicos también pueden usar varias reacciones químicas diferentes para separar el dióxido de carbono. El dióxido de carbono se produce en las reacciones entre la mayoría de los ácidos y la mayoría de los carbonatos metálicos. Por ejemplo, la reacción entre el ácido clorhídrico y el carbonato de calcio (caliza o tiza) produce dióxido de carbono:
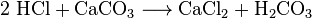
El ácido carbónico (H2CO3) se descompone en agua y CO2. Tales reacciones causan espuma o burbujas, o ambas cosas. En la industria, tales reacciones se utilizan muchas veces para neutralizar las corrientes ácidas residuales.
Cal viva (CaO), una sustancia química de uso generalizado, se puede fabricar calentando piedra caliza a unos 850 °C. Esta reacción también produce CO2:
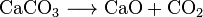
El dióxido de carbono también se produce en la combustión de todos los combustibles que contienen carbono, como metano (gas natural), destilados de petróleo (gasolina, diesel, queroseno, propano), carbón o madera. En la mayoría de los casos, también se libera agua. Como ejemplo, la reacción química entre metano y oxígeno es:
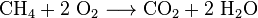
El dióxido de carbono se fabrica en acerías. El hierro se reduce de sus óxidos con coque en un alto horno, produciendo arrabio y dióxido de carbono:

La levadura metaboliza el azúcar para producir dióxido de carbono y etanol, también conocido como alcohol, en la producción de vinos, cervezas y otros licores, pero también en la producción de bioetanol:
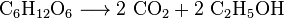
Todos los organismos aeróbicos producen CO2 cuando oxidan carbohidratos, ácidos grasos y proteínas en las mitocondrias de las células. El gran número de reacciones involucradas son extremadamente complejas y no se describen fácilmente. (Incluyen respiración celular, respiración anaeróbica y fotosíntesis). Los fotoautótrofos (es decir, las plantas, las cianobacterias) utilizan otra reacción: Las plantas absorben el CO2 del aire y, junto con el agua, lo reaccionan para formar carbohidratos:
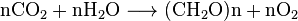
El dióxido de carbono es soluble en agua, en la que se interconvierte espontáneamente entre el CO2 y H2CO3 (ácido carbónico). Las concentraciones relativas de CO2, H2CO3 y las formas desprotonadas HCO−
3 (bicarbonato) y CO2−
3(carbonato) dependen de la acidez (pH). En agua neutra o ligeramente alcalina (pH > 6.5), predomina la forma de bicarbonato (>50%) convirtiéndose en la más prevalente (>95%) al pH del agua de mar, mientras que en agua muy alcalina (pH > 10.4) la forma predominante (>50%) es el carbonato. Las formas de bicarbonato y carbonato son muy solubles. Por lo tanto, el agua oceánica equilibrada con aire (ligeramente alcalina con un pH típico = 8,2-8,5) contiene aproximadamente 120 mg de bicarbonato por litro.
Producción industrial
El dióxido de carbono industrial se produce principalmente a partir de seis procesos:
- Mediante la captura de manantiales naturales de dióxido de carbono donde se produce por la acción del agua acidificada sobre piedra caliza o dolomía.
- Como subproducto de plantas de producción de hidrógeno, donde el metano se convierte en CO2;
- A partir de la combustión de combustibles fósiles o madera;
- Como subproducto de la fermentación del azúcar en la elaboración de cerveza, whisky y otras bebidas alcohólicas;
- A partir de la descomposición térmica de piedra caliza, CaCO3, en la fabricación de cal (óxido de calcio, CaO);
Reacción química
El dióxido de carbono se puede crear con una reacción química simple:
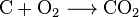 carbon + oxygen → carbon dioxide
carbon + oxygen → carbon dioxide
Images for kids
-

Crystal structure of dry ice
-

Pellets of «dry ice», a common form of solid carbon dioxide
-

Carbon dioxide bubbles in a soft drink.
-

Dry ice used to preserve grapes after harvest.
-

Use of a CO2 fire extinguisher.
-

A carbon dioxide laser.
-

CO2 in Earth’s atmosphere if half of global-warming emissions are not absorbed.(NASA computer simulation).
-

Caparazón de pterápodo disuelto en agua de mar ajustado a una química oceánica proyectada para el año 2100.
-

Resumen de la fotosíntesis y la respiración. El dióxido de carbono (a la derecha), junto con el agua, forma oxígeno y compuestos orgánicos (a la izquierda) por fotosíntesis, que pueden respirarse en agua y (CO2).
-

Los crecientes niveles de CO2 amenazaron a los astronautas del Apolo 13 que tuvieron que adaptar cartuchos del módulo de mando para suministrar el depurador de dióxido de carbono en el módulo lunar, que usaron como bote salvavidas.

CO2 concentration meter using a nondispersive infrared sensor
