¿Cuál es la densidad de las células?
Modo de lectura
La densidad del material biológico es responsable de la sedimentación de las células en el fondo de nuestros tubos de laboratorio y placas de múltiples pocillos y sirve de base para la centrifugación de rutina que forma parte de la vida diaria de tantos biólogos. Estas mismas diferencias de densidad entre las células y su exterior acuoso también son la base del contraste que observamos en las imágenes de microscopía de fase. Estas diferencias también son importantes fuera del entorno de laboratorio. Por ejemplo, el plancton tiene que lidiar con esta diferencia de densidad para permanecer a una profundidad en el océano donde la luz solar es abundante en lugar de hundirse en las profundidades ennegrecidas. Dado que la mayoría de los biólogos y bioquímicos hacen uso de la separación basada en la densidad a diario, parece sorprendente que rara vez se discutan densidades como las recogidas en la Tabla 1.
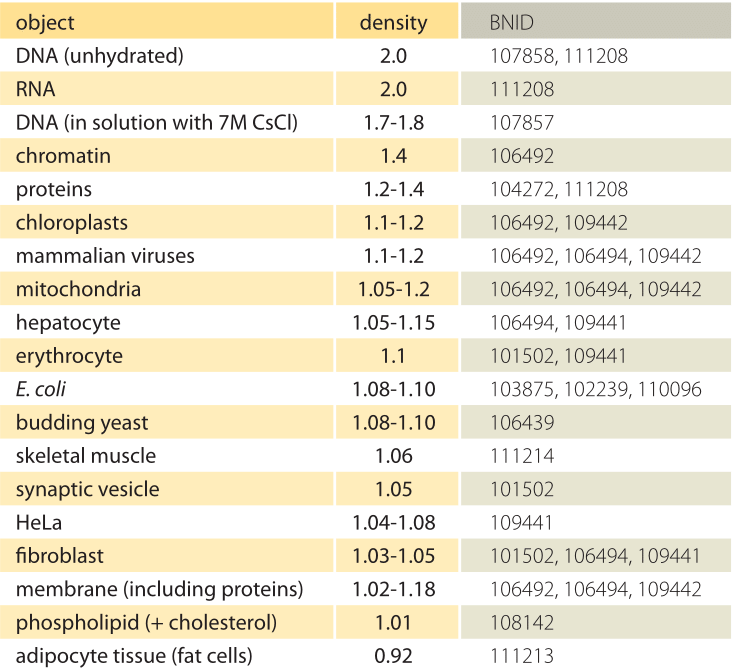
Tabla 1: Densidades de objetos biológicos en relación con el agua. Esto es casi equivalente a darles en unidades de g / ml o 1000 kg / m3. Los valores se ordenan en orden descendente. A menos que se indique lo contrario, los valores se midieron en sacarosa o solución de ficoll.
¿Cuál es la base subyacente para las densidades variables de diferentes orgánulos y tipos de células? En gran medida, estas diferencias pueden atribuirse a la relación entre el contenido de agua y la masa seca. Las proteínas tienen una densidad de ≈1,3 – 1,4 (BNID 104272, 101502) en relación con el agua (o casi de forma equivalente en unidades de g/ml o 1000 kg/m3). Dado el valor de referencia de 1 para la densidad del agua, un espectro de valores intermedios para la densidad celular entre 1 y 1.3 se obtienen en base a la abundancia relativa de proteínas y agua. Los lípidos se encuentran en el extremo inferior junto al agua con una densidad de aproximadamente 1 (BNID 108142). En el otro extremo, los gránulos de almidón con una densidad de ≈1,5 (BNID 103206) y los nucleótidos en ≈1,7 pueden cambiar el balance de masas general en la dirección opuesta.
Conocer la densidad a menudo se basa en la ubicación en la que se asienta un componente biológico dado cuando se gira en una centrífuga que contiene un gradiente de concentraciones a menudo producidas por sacarosa o, en el caso del ADN, cloruro de cesio. La densidad refleja la masa dividida por el volumen, pero para los compuestos cargados en solución, la densidad también se ve afectada por las capas de la llamada agua unida. La densidad en este caso se convierte en una densidad efectiva, reducida por el agua enlazada, y por lo tanto algo dependiente de la concentración de sal (BNID 107858).
La velocidad de sedimentación, como ocurre en una centrífuga, se cuantifica en unidades de Svedberg, que es el origen de los nombres 70S, 23S, etc. para el ribosoma y sus subunidades de ARNr. Un ARNr de 23 S sedimentará a una velocidad de 23×10-12 m/s bajo gravedad normal. En una ultracentrífuga que produce una aceleración de un millón de g, la velocidad se escalará proporcionalmente a 23×10-6 m/s o aproximadamente 1 mm/min. La velocidad de sedimentación depende de la densidad, el tamaño y la forma de la molécula. Para formas y densidades similares, la velocidad de sedimentación escala como la raíz cuadrada de la masa molecular. Para tales casos, la masa molecular va como el cuadrado de la velocidad de sedimentación, de modo que las subunidades 23S y 16S del ribosoma tienen una masa molecular con una relación de aproximadamente (23/16)2 o aproximadamente 2 que está estrechamente alineada con las mediciones de 0,9 y 0.5 MDa respectivamente (BNID 110972, 110967). En la clínica, la velocidad de sedimentación de los eritrocitos (glóbulos rojos) se usa de forma rutinaria para medir la inflamación. Tasas muy superiores a 10 mm/hora suelen indicar la presencia del factor de pro sedimentación fibrinógeno, que es un indicador general de una afección inflamatoria.
Es bien sabido que el agua es la fracción molecular más abundante de las células, pero ¿qué tan abundante es exactamente? Si examinamos tejidos de organismos multicelulares, encontrar el contenido de agua es una tarea simple de medir la masa del tejido antes y después del secado. Pero, ¿cómo se pueden realizar tales mediciones para las células? Cuando pesamos una masa de células antes y después del secado, ¿cómo medimos solo las células sin agua a su alrededor? Incluso después de la centrifugación, queda agua en el pellet de la celda, lo que resulta en ambigüedad sobre la masa seca en sí.
Una vez más, el etiquetado radioisotópico viene al rescate (Cayley et al 1991). Primero, el agua etiquetada (usando tritio, 3H) se mide en un pellet celular. Esto indica la suma de agua dentro y fuera de las celdas. Luego, otro compuesto soluble que está etiquetado pero que no puede ingresar a la célula, como la inulina 14C o la 3H-PEG, mide el volumen de agua fuera de las células en un pellet centrifugado (por ejemplo, en E. coli aproximadamente el 25-35% del volumen del pellet (BNID)). La diferencia indica el contenido de agua dentro de las celdas. Tales métodos conducen a valores típicos que van desde ≈60-65% en masa para la levadura en ciernes y los glóbulos rojos hasta ≈70% para E. coli y la ameba D. discoideum y hasta ≈80% para el músculo de rata y los tejidos cardíacos de cerdo (BNID 105938, 103689). Dado que la contribución de la materia seca está dominada por constituyentes de densidad ≈1.3 (es decir, proteínas), esto conduce a la densidad general característica de ≈1.1 (BNID 103875, 106439, 101502). A partir de estas fracciones características, se puede inferir que la masa seca por volumen es de aproximadamente 300-500 mg/ml (BNID 108131, 108135, 108136), pero durante el crecimiento lento los valores pueden ser más altos. Las densidades bajas son comunes en semillas secas y plantas submarinas que tienen partes flotantes con densidades inferiores a las del agua circundante, lo que les permite flotar. Se pueden lograr densidades inferiores a las del agua, ya sea por gas, como en algas marinas y algunas bacterias, o utilizando solutos de peso molecular (MW) inferiores a los medios circundantes (por ejemplo, reemplazando sodio por MW≈23 por amonio con MW≈18), como en los pequeños crustáceos, copépodos antárticos.
Los seres humanos están hechos de aproximadamente un 60% de agua (40% en las células, 15% en el líquido intersticial y 5% en el plasma sanguíneo, BNID 110743) y la mayoría de nosotros hemos experimentado los fuertes efectos de la deshidratación después de olvidarnos de beber incluso unos pocos vasos. Sin embargo, algunas células pueden ser sorprendentemente robustas a una disminución en su contenido de agua. Por ejemplo, la tasa de metabolismo de la glucosa en las células hepáticas de rata no se vio afectada por la pérdida del 25% de agua intracelular. Dicha disminución se puede lograr por ósmosis, cambiando la tonicidad (concentración de solutos) del fluido extracelular. Un ejemplo extremo es el de los extraordinarios camarones en salmuera. Viviendo en ambientes donde la concentración de sal externa puede fluctuar y ser muy alta, se demostró que tiene quistes que se pueden desecar a solo un 2% de agua sin daño irreversible y a niveles de hidratación superiores al 37% (solo aproximadamente la mitad de su estado totalmente hidratado), su fisiología se comporta de forma normal. Esta robustez frente a la pérdida de agua podría estar relacionada con una distinción que a veces se hace entre dos formas de agua en el interior de la celda. «Agua a granel» normal que es más prescindible y «agua ligada» que se asocia con los componentes celulares y sirve como un solvente que es esencial para el funcionamiento adecuado.





