Electronegatividad y Polaridad de Enlace
Aunque definimos el enlace covalente como el intercambio de electrones, los electrones en un enlace covalente no siempre son compartidos por igual por los dos átomos enlazados. A menos que el enlace conecte dos átomos del mismo elemento, siempre habrá un átomo que atraiga los electrones en el enlace más fuertemente que el otro átomo, como se muestra en la Figura 4.3 «Enlaces Covalentes Polares versus No Polares». Cuando se produce tal desequilibrio, se produce una acumulación resultante de una carga negativa (llamada carga negativa parcial y designada δ−) en un lado del enlace y una carga positiva (designada δ+) en el otro lado del enlace. Un enlace covalente que tiene un intercambio desigual de electrones, como en la parte (b) de la Figura 4.3 «Enlaces Covalentes Polares versus No Polares», se denomina enlace covalente bondA covalente polar con una distribución de electrones desequilibrada a través del enlace.. Enlace covalente que tiene un reparto igual de electrones (parte (a) de la Figura 4.3 «Enlaces covalentes Polares versus No Polares») se denomina enlace covalente bondA covalente no polar con una distribución de electrones equilibrada a través del enlace..
Figura 4.3 Enlaces Covalentes Polares versus No Polares
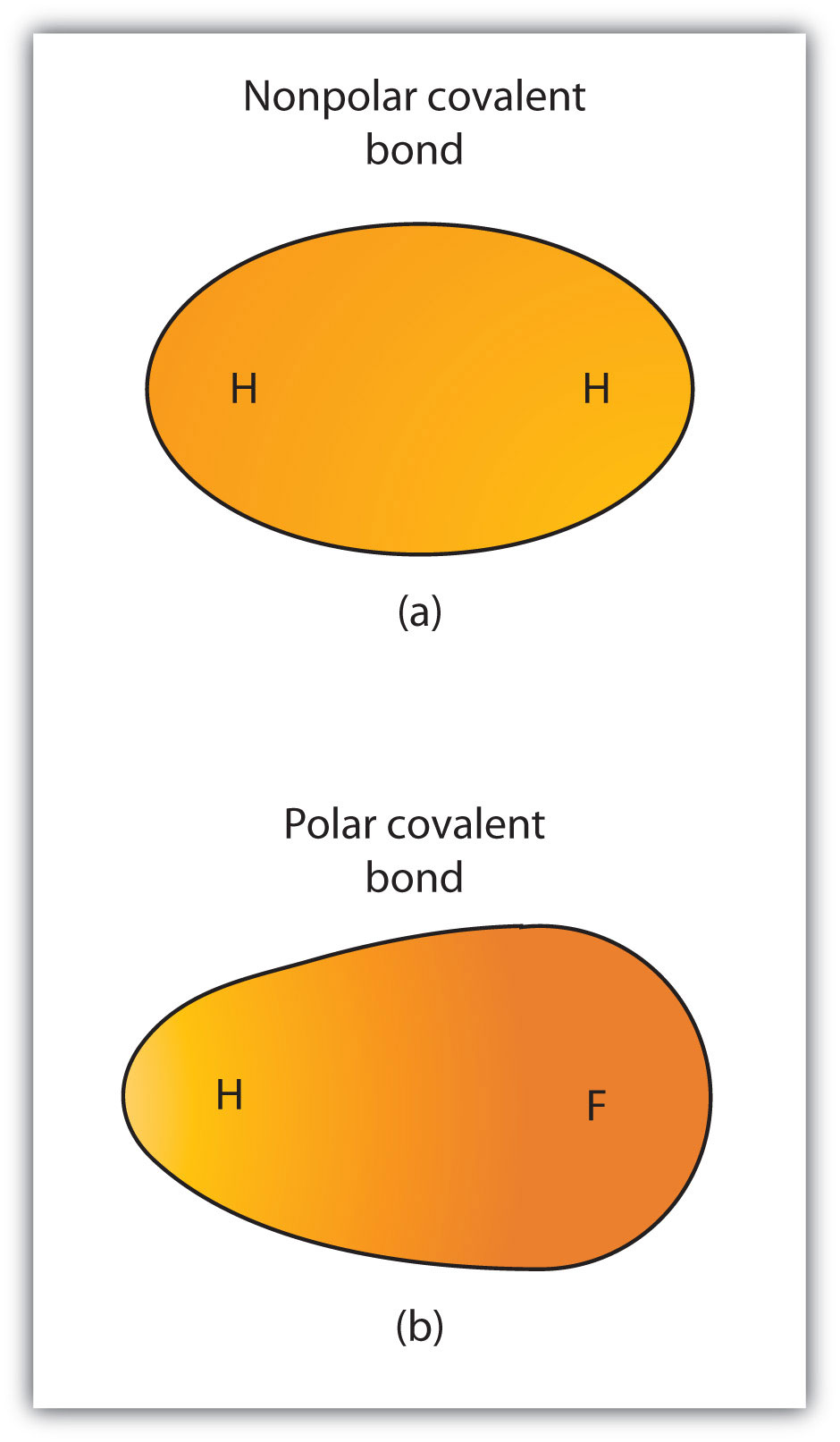
(a) Los electrones en el enlace covalente son compartidos por igual por ambos átomos de hidrógeno. Este es un enlace covalente no polar. (b) El átomo de flúor atrae a los electrones en el enlace más que el átomo de hidrógeno, lo que conduce a un desequilibrio en la distribución de electrones. Este es un enlace covalente polar.
Cualquier enlace covalente entre átomos de diferentes elementos es un enlace polar, pero el grado de polaridad varía ampliamente. Algunos enlaces entre diferentes elementos son mínimamente polares, mientras que otros son fuertemente polares. Los enlaces iónicos pueden considerarse lo último en polaridad, con electrones que se transfieren en lugar de compartirse. Para juzgar la polaridad relativa de un enlace covalente, los químicos usan electronegatividaduna medida relativa de la fuerza con la que un átomo atrae electrones cuando forma un enlace covalente., que es una medida relativa de la fuerza con la que un átomo atrae electrones cuando forma un enlace covalente. Hay varias escalas numéricas para calificar la electronegatividad. La Figura 4.4 «Electronegatividades de Varios Elementos» muestra una de las más populares: la escala de Pauling. La polaridad de un enlace covalente se puede juzgar determinando la diferencia en las electronegatividades de los dos átomos que forman el enlace. Cuanto mayor es la diferencia en electronegatividades, mayor es el desequilibrio de la distribución de electrones en el enlace. Aunque no hay reglas duras y rápidas, la regla general es que si la diferencia en electronegatividades es menor que aproximadamente 0.4, el enlace se considera no polar; si la diferencia es mayor que 0.4, el enlace se considera polar. Si la diferencia en electronegatividades es lo suficientemente grande (generalmente mayor que aproximadamente 1,8), el compuesto resultante se considera iónico en lugar de covalente. Una diferencia de electronegatividad de cero, por supuesto, indica un enlace covalente no polar.
Figura 4.4 Electronegatividades de Varios Elementos
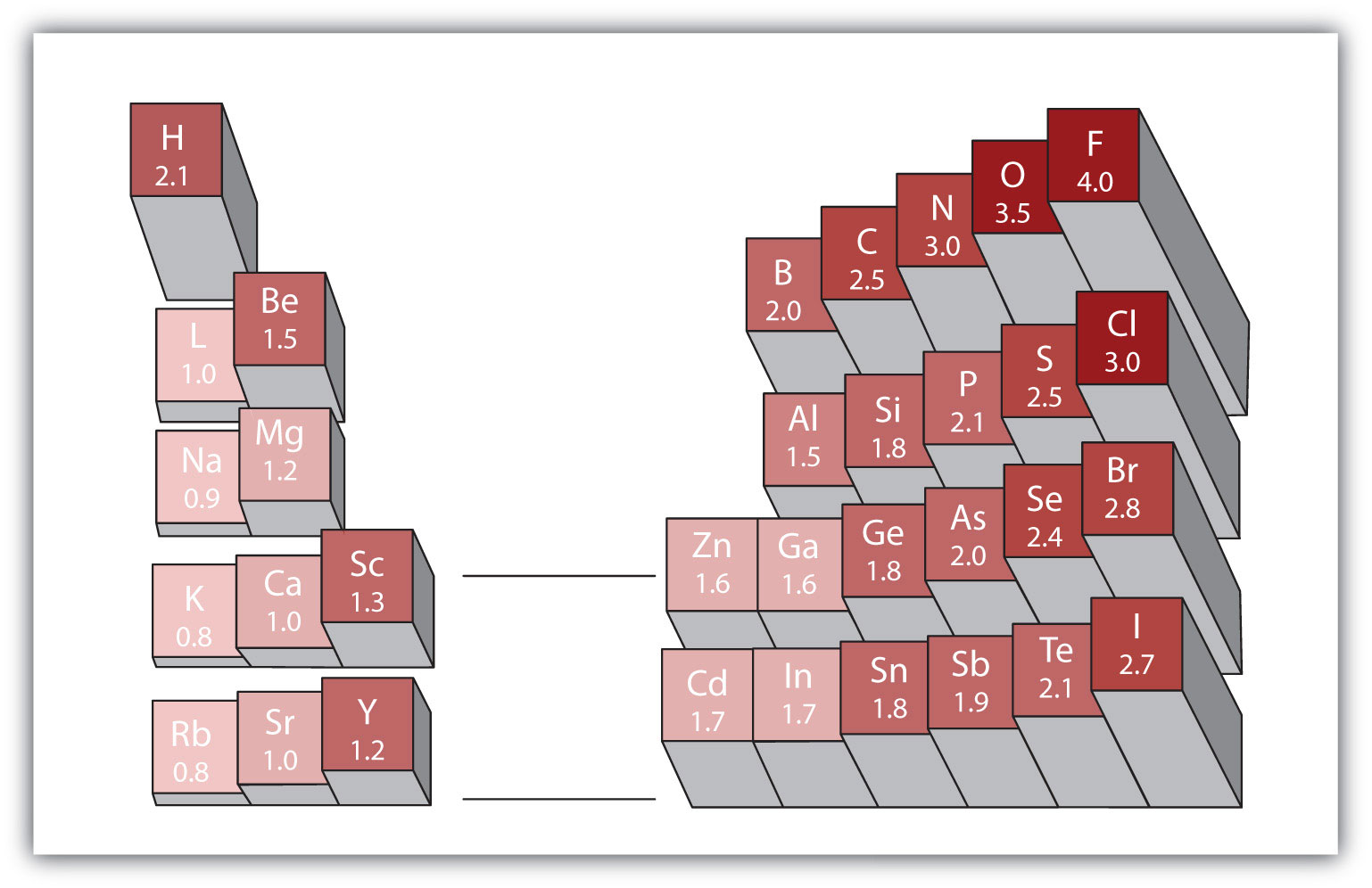
Una escala popular para electronegatividades tiene el valor para átomos de flúor establecido en 4.0, el valor más alto.
Mirando más de cerca: Linus Pauling
Posiblemente el químico más influyente del siglo XX, Linus Pauling (1901-94) es la única persona que ha ganado dos Premios Nobel individuales (es decir, no compartidos). En la década de 1930, Pauling utilizó nuevas teorías matemáticas para enunciar algunos principios fundamentales del enlace químico. Su libro de 1939 The Nature of the Chemical Bond es uno de los libros más importantes publicados en química.
En 1935, el interés de Pauling se volvió hacia las moléculas biológicas, y fue galardonado con el Premio Nobel de Química en 1954 por su trabajo sobre la estructura de las proteínas. (Estaba muy cerca de descubrir la estructura de doble hélice del ADN cuando James Watson y James Crick anunciaron su propio descubrimiento de su estructura en 1953. Más tarde fue galardonado con el Premio Nobel de la Paz de 1962 por sus esfuerzos para prohibir los ensayos de armas nucleares.
En sus últimos años, Pauling se convenció de que grandes dosis de vitamina C prevenían enfermedades, incluido el resfriado común. La mayoría de las investigaciones clínicas no mostraron una conexión, pero Pauling continuó tomando grandes dosis diarias. Murió en 1994, después de haber pasado toda una vida estableciendo un legado científico que pocos podrán igualar.

Linus Pauling fue uno de los químicos más influyentes del siglo XX.
Ejemplo 6
Describe la diferencia de electronegatividad entre cada par de átomos y la polaridad resultante (o tipo de enlace).
- C y H
- H y H
- Na y Cl
- O y H
Solución
- el Carbono tiene una electronegatividad de 2.5, mientras que el valor de hidrógeno es de 2.1. La diferencia es de 0,3, que es bastante pequeña. Por lo tanto, el enlace C–H se considera no polar.
- Ambos átomos de hidrógeno tienen el mismo valor de electronegatividad-2.1. La diferencia es cero, por lo que el enlace no es polar.
- La electronegatividad del sodio es de 0,9, mientras que la del cloro es de 3,0. La diferencia es 2,1, que es bastante alta, por lo que el sodio y el cloro forman un compuesto iónico.
- Con 2,1 para el hidrógeno y 3,5 para el oxígeno, la diferencia de electronegatividad es de 1,4. Esperaríamos un enlace muy polar, pero no tan polar que el enlace O–H se considere iónico.
Ejercicio de desarrollo de habilidades
-
C y S
-
K y Br
-
N y N
-
Cs y F
Describir la diferencia de electronegatividad entre cada par de átomos y la polaridad resultante (o tipo de enlace).
Cuando una molécula de enlaces son polares, la molécula como un todo puede mostrar una distribución desigual de la carga, en función de cómo el individuo bonos están orientados. Por ejemplo, la orientación de los dos enlaces O–H en una molécula de agua (Figura 4.5 «Propiedades físicas y polaridad») está doblada: un extremo de la molécula tiene una carga positiva parcial, y el otro extremo tiene una carga negativa parcial. En resumen, la molécula en sí es polar. La polaridad del agua tiene un enorme impacto en sus propiedades físicas y químicas. (Por ejemplo, el punto de ebullición del agua es alto para una molécula tan pequeña y se debe al hecho de que las moléculas polares se atraen fuertemente entre sí. En contraste, mientras que los dos enlaces C = O en dióxido de carbono son polares, se encuentran directamente opuestos entre sí y, por lo tanto, cancelan los efectos del otro. Por lo tanto, las moléculas de dióxido de carbono son en general no polares. Esta falta de polaridad influye en algunas de las propiedades del dióxido de carbono. (Por ejemplo, el dióxido de carbono se convierte en un gas a -77 ° C, casi 200° menos que la temperatura a la que hierve el agua.)
Figura 4.5 Propiedades físicas y Polaridad

Las propiedades físicas del agua y el dióxido de carbono se ven afectadas por sus polaridades.
Concepto de Revisión de Ejercicios
-
¿Cuál es el nombre para la distancia entre dos átomos en un enlace covalente?
-
¿Qué la electronegatividad de un átomo de indicar?
-
¿Qué tipo de enlace se forma entre dos átomos si la diferencia en electronegatividades es pequeña? ¿Mediana? Grande?
Respuestas
-
de bonos de longitud
-
la Electronegatividad es una medida cualitativa de lo mucho que un átomo atrae a los electrones en un enlace covalente.
-
no polares; polar; iónicos
Puntos Clave
- enlaces Covalentes entre átomos diferentes que tienen diferentes longitudes de enlace.Los enlaces covalentes pueden ser polares o no polares, dependiendo de la diferencia de electronegatividad entre los átomos involucrados.
Ejercicios
-
Que es más que un enlace C–H o C–O bonos? (Consulte la Tabla 4.2 «Longitudes aproximadas de los Enlaces de algunos Enlaces Simples».)
-
Que es más corto—N–H de bonos o un enlace C–H? (Consulte la Tabla 4.2 «Longitudes aproximadas de los Enlaces de algunos Enlaces Simples».)
-
Un nanómetro es de 10-9 m. Utilizando los datos de la Tabla 4.2″ Longitudes aproximadas de Enlace de algunos Enlaces Simples » y la Tabla 4.3 «Comparación de Longitudes de Enlace para Enlaces Simples y Múltiples», determine la longitud de cada enlace en nanómetros.
- un enlace C–O
- un enlace C=O
- un enlace H–N
- un enlace C N N
-
Un angstrom (Å) se define como 10-10 m. Utilizando la Tabla 4.2 «Longitudes de enlace aproximadas de algunos Enlaces Simples» y la Tabla 4.3 «Comparación de longitudes de enlace para Enlaces Simples y Múltiples», determine la longitud de cada enlace en angstroms.
- un enlace C–C
- C=C de bonos
- N≡N de bonos
- un H–O bonos
-
Consulte el Ejercicio 3. ¿Por qué es útil la unidad nanométrica como unidad para expresar longitudes de enlace?
-
Consulte el Ejercicio 4. ¿Por qué es útil la unidad angstrom como unidad para expresar longitudes de enlace?
-
Usando la Figura 4.4 «Electronegatividades de Varios Elementos», determine qué átomo de cada par tiene la electronegatividad más alta.
- H o C
- O o Br
- Na o Rb
- I o Cl
-
Utilizando la Figura 4.4 «Electronegatividades de varios Elementos», determine qué átomo de cada par tiene la electronegatividad más baja.
- Mg o O
- S o F
- Al o Ga
- O o I
-
Se los electrones ser compartida por igual o desigualmente a través de cada enlace covalente? Si es desigual, ¿a qué átomo son los electrones más fuertemente atraídos?
- un enlace C–O
- un F–F bond
- un S–N bond
- un I–Cl bond
-
Se los electrones ser compartida por igual o desigualmente a través de cada enlace covalente? Si es desigual, ¿a qué átomo son los electrones más fuertemente atraídos?
- un enlace C–C
- un S–Cl bond
- un enlace O–H
- H–H enlace
Respuestas
-
Un enlace C–O es más largo.
-
- 0.143 nm
- 0.120 nm
- 0.100 nm
- 0.116 nm
-
Las longitudes de enlace reales son muy pequeñas, por lo que la unidad nanométrica facilita la expresión de la longitud.
-
- C
- O
- Na
- Cl
-
- desigualmente hacia el O
- igual
- desigualmente hacia el N
- desigualmente hacia la Cl
