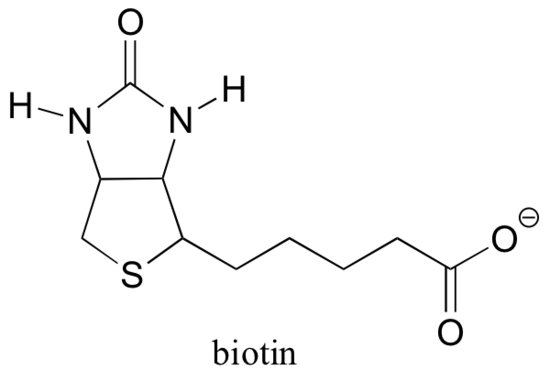
13.5 D: La biotina es una coenzima portadora de CO2
Recordemos de la sección 6.5 B que muchas enzimas dependen de la ayuda de coenzimas, que son moléculas orgánicas pequeñas (en relación con las proteínas) que se unen covalentemente o no-covalentemente – en el sitio activo de una enzima y la ayuda a catalizar su reacción. S-adenosilmetionina (SAM, sección 9.1 A) y ATP (sección 10.2) son dos ejemplos que hemos encontrado hasta ahora, y veremos varios más en los capítulos siguientes. Aunque Rubisco (descrito en la parte B de esta sección) es una excepción, la mayoría de las enzimas que catalizan las reacciones de carboxilación dependen de una coenzima llamada biotina, que sirve como un portador temporal de dióxido de carbono.
la piruvato carboxilasa, la enzima que cataliza el primer paso de la vía de la gluconeogénesis, es un buen ejemplo de reacción de carboxilación dependiente de biotina. Observe que el CO2 en esta reacción se deriva del bicarbonato, a diferencia de la reacción de Rubisco en la que el CO2 se ‘fija’ directamente de la atmósfera.

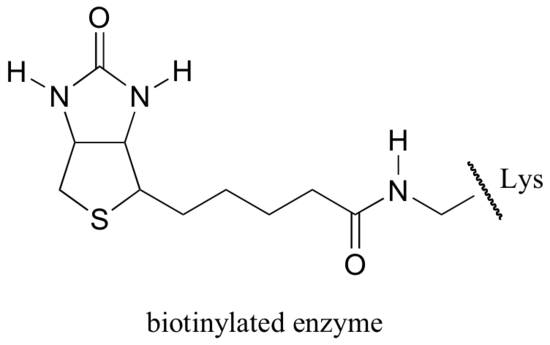
La biotina se une covalentemente a la enzima a través de un enlace de amida a una lisina de sitio activo.
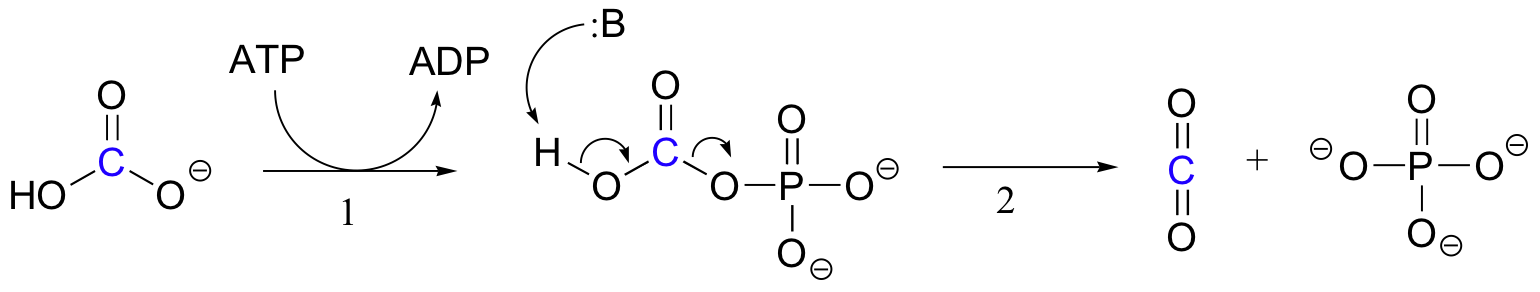
El mecanismo exacto por el que operan las reacciones de carboxilación dependientes de biotina aún no se comprende completamente, sin embargo, lo siguiente es una imagen probable. En primer lugar, el ion bicarbonato es fosforilado por ATP (paso 1, ver sección 10.2), y por lo tanto se activa para la descarboxilación, que genera CO2 libre (paso 2).
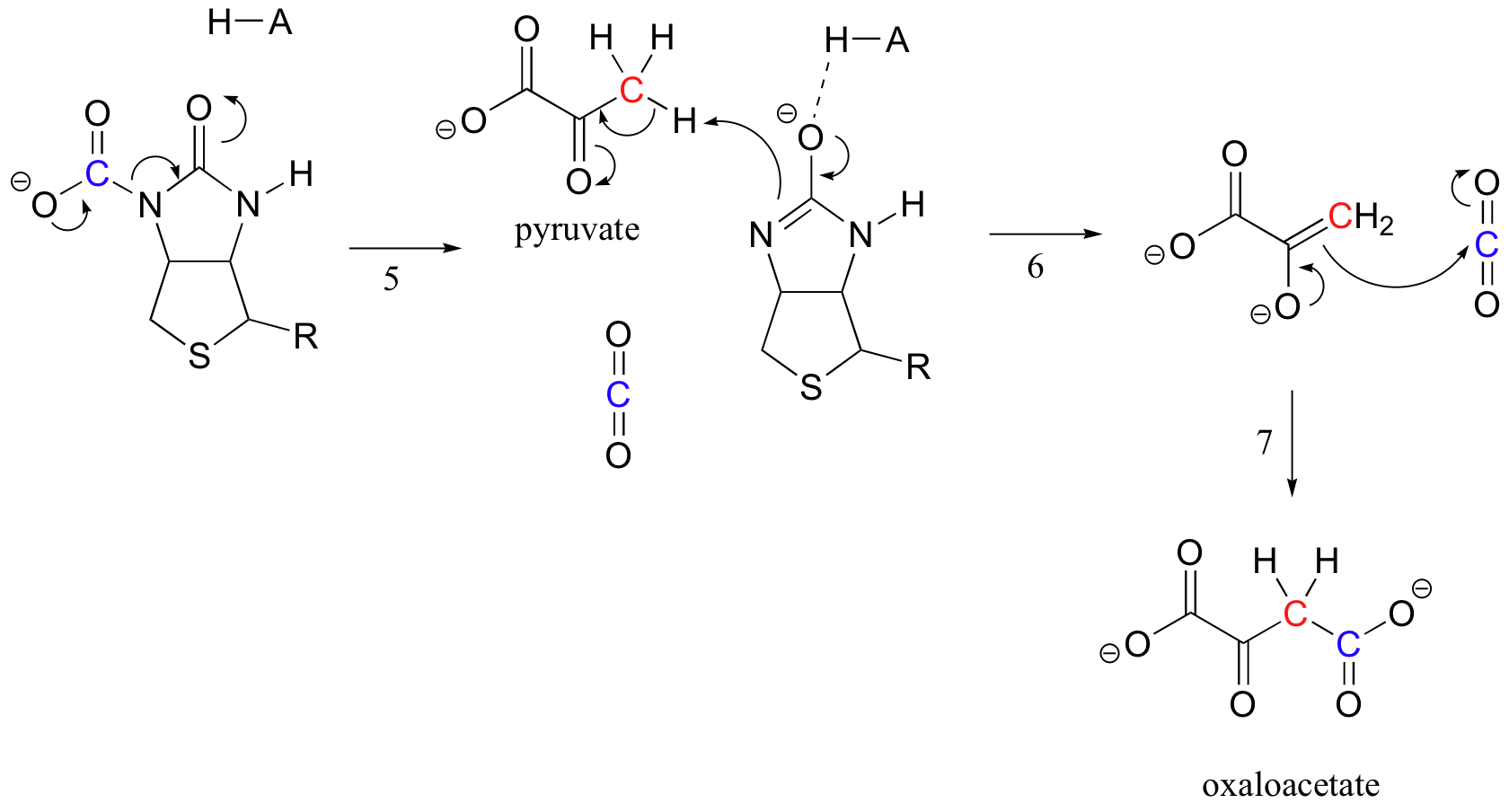
Biotina del trabajo es mantener a la molécula de dióxido de carbono hasta el piruvato entra en el sitio activo. La carboxilación de la biotina implica la desprotonación del nitrógeno de la amida para formar un intermediario similar al enolato (las amidas del paso 3 tienen un pKa de aproximadamente 17, y esto se reduce por la presencia de un ácido de sitio activo cerca del oxígeno). Este paso es seguido por el ataque del nitrógeno nucleofílico sobre el dióxido de carbono para formar la enzima carboxibiotinilada (paso 4).
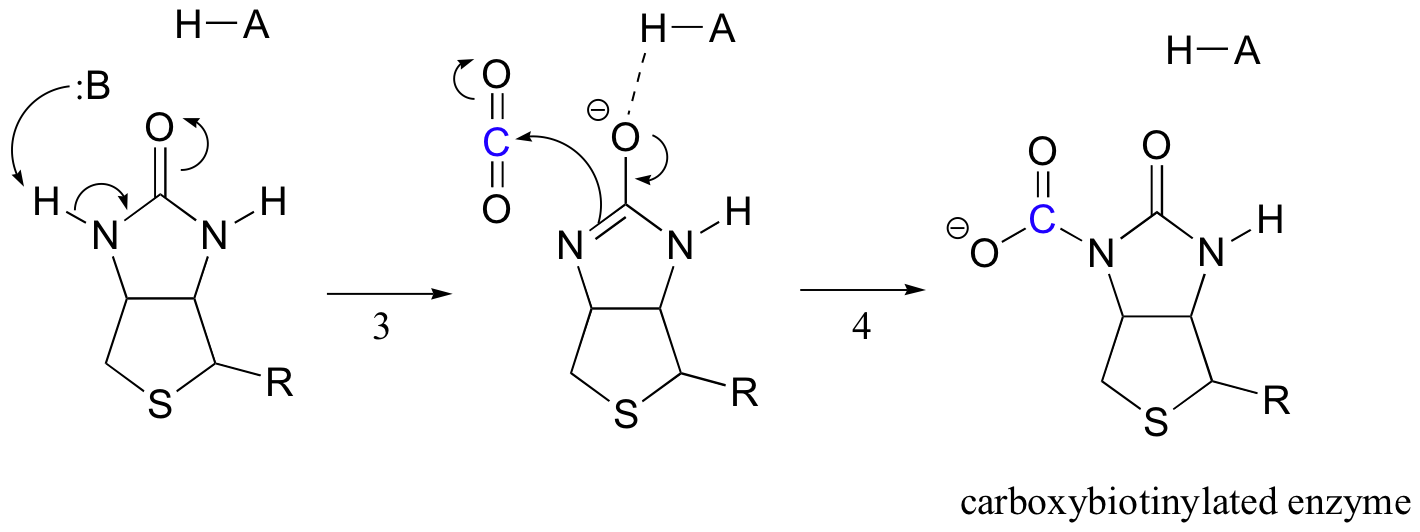
Cuando una molécula de piruvato se une, el reordenamiento de la arquitectura del sitio activo hace que el paso anterior se invierta (paso 5), liberando el CO2 y generando una base de biotina para desprotonar el carbono alfa de piruvato para que pueda condensarse, de forma aldólica, con CO2 para formar oxaloacetato (pasos 6-7).
Si ha estudiado algo de bioquímica, es posible que haya oído hablar de la biotina en un contexto algo diferente de lo que se discute en esta sección. Una proteína llamada avidina, que se encuentra en abundancia en la clara de huevo, se une de forma no covalente y extremadamente ajustada a la biotina (de hecho, avidina-biotina es el par de unión de proteínas y ligandos más apretado conocido por la ciencia). Los bioquímicos a menudo hacen uso de esta propiedad al vincular covalentemente una biomolécula de interés a la biotina. Las especies «biotiniladas» pueden aislarse fácilmente de una mezcla compleja al pasar la mezcla a través de una «columna de afinidad» recubierta de avidina.
