Hay varias formas en que una célula puede moverse de un punto en el espacio a otro. En un medio líquido, ese método puede ser algún tipo de natación, utilizando el movimiento ciliar o flagelar para impulsar la célula. En superficies sólidas, esos mecanismos claramente no funcionarán de manera eficiente, y la célula se somete a un proceso de rastreo. En esta sección, comenzamos con una discusión del movimiento ciliar/flagelar, y luego consideramos los requisitos más complicados del rastreo celular.
Cilios y flagelos, que difieren principalmente en longitud en lugar de construcción, son orgánulos a base de microtúbulos que se mueven con un movimiento de ida y vuelta. Esto se traduce en «remar» por los cilios relativamente cortos, pero en los flagelos más largos, la flexibilidad de la estructura hace que el movimiento de ida y vuelta se propague como una ola, por lo que el movimiento flagelar es más ondulado o como un latiguillo (considere lo que sucede cuando mueve una manguera de jardín rápidamente de un lado a otro en comparación con una pieza corta de la misma manguera). El núcleo de cualquiera de las estructuras se llama axonema, que está compuesto por 9 dobletes de microtúbulos conectados entre sí por proteínas motoras de dineína ciliar, y que rodean un núcleo central de dos microtúbulos separados.
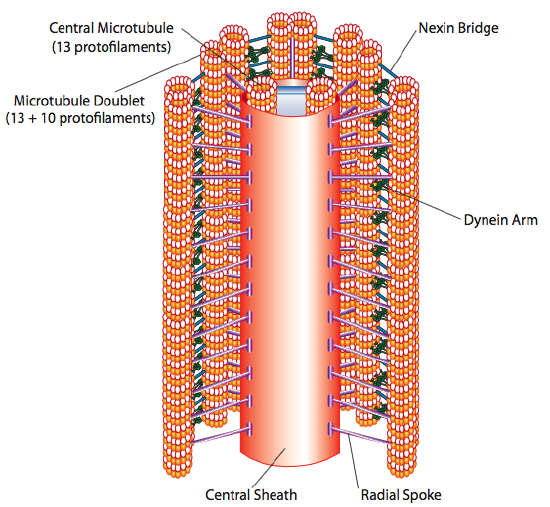
Esto se conoce como la formación» 9+2″, aunque los nueve dobletes no son los mismos que los dos microtúbulos centrales. El túbulo A es un protofilamento completo de 13, pero el túbulo B fusionado contiene solo 10 protofilamentos. Cada uno de los microtúbulos centrales es un total de 13 protofilamentos. El axonema 9 + 2 extiende la longitud del cilio o flagelo desde la punta hasta llegar a la base, y se conecta al cuerpo celular a través de un cuerpo basal, que está compuesto por 9 trillizos de microtúbulos dispuestos en un barril corto, al igual que los centriolos de los que se derivan.
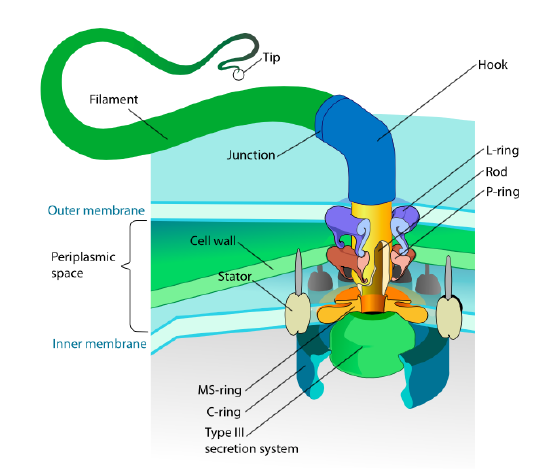
Esta sección se refiere solo a los eucariotas. Algunos procariotas también tienen apéndices móviles llamados flagelos, pero son completamente diferentes en estructura y mecanismo. Los flagelos en sí son polímeros helicoidales largos de la proteína flagelina, y la base de las fibras de flagelina está conectada a una proteína motora de rotación, no a un motor traslacional. Este motor (Figura \(\pageIndex{18}\)) utiliza iones (H+ o Na+ dependiendo de la especie) por un gradiente electroquímico para proporcionar la energía para girar hasta 100000 revoluciones por minuto. Se cree que la rotación es impulsada por cambios conformacionales en el anillo del estator, ubicado en la membrana celular.
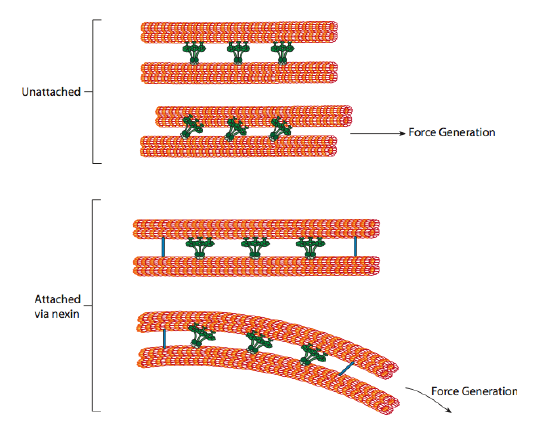
Las dineínas ciliar proporcionan la capacidad motora, pero también hay otras dos proteínas de enlace en el axonema. Hay nexinas que unen el túbulo A de un doblete con el túbulo B de su doblete adyacente, conectando así el anillo exterior. Y hay radios radiales que se extienden desde el túbulo A de cada doblete hasta el par central de microtúbulos en el núcleo del axonema. Ninguno de estos tiene actividad motora. Sin embargo, son cruciales para el movimiento de los cilios y flagelos porque ayudan a transformar un movimiento de deslizamiento en un movimiento de flexión. Cuando la dineína ciliar (muy similar a las dineínas citoplasmáticas, pero tiene tres cabezas en lugar de dos) está comprometida, se une a un microtúbulo A en un lado, a un microtúbulo B del doblete adyacente, y se mueve uno en relación con el otro. Una línea de estas dineínas moviéndose en concierto deslizaría un doblete en relación con el otro, si (y es un gran «si») los dos dobletes tuvieran completa libertad de movimiento. Sin embargo, dado que los dobletes están interconectados por las proteínas nexin, lo que sucede cuando un doblete intenta deslizarse es que dobla la estructura conectada en su lugar (Figura \(\pageIndex{17}\)). Esta curva explica el movimiento de remo de los cilios, que son relativamente cortos, así como el movimiento de azotes de los flagelos largos, que propagan el movimiento de flexión por el axonema.
Aunque pensamos en el movimiento ciliar y flagelar como métodos para la propulsión de una célula, como la natación flagelar de espermatozoides hacia un óvulo, también hay una serie de lugares importantes en los que la célula está estacionaria, y los cilios se utilizan para mover el líquido más allá de la célula. De hecho, hay células con cilios en la mayoría de los órganos principales del cuerpo. Se han notificado varias discinesias ciliar, de las cuales la discinesia ciliar primaria (CPD) más prominente, que incluye el síndrome de Kartagener (SK), se debe a la mutación del gen DNAI1, que codifica una subunidad (cadena intermedia 1) de dineína axonémica (ciliar). La ECP se caracteriza por dificultad respiratoria debido a una infección recurrente, y el diagnóstico de SK se hace si también hay situs inversus, una condición en la que se invierte la asimetría normal izquierda-derecha del cuerpo (por ejemplo, estómago a la izquierda, hígado a la derecha). El primer síntoma se debe a la inactividad de los numerosos cilios de las células epiteliales en los pulmones. Su función normal es mantener el moco en la vía respiratoria en constante movimiento. Normalmente, el moco ayuda a mantener los pulmones húmedos para facilitar la función, pero si el moco se vuelve estacionario, se convierte en un caldo de cultivo para bacterias, además de convertirse en un irritante y un obstáculo para el intercambio adecuado de gases.
Situs inversus es una malformación interesante porque surge en el desarrollo embrionario, y afecta solo al 50% de los pacientes con ECP porque la función ciliar deteriorada causa la aleatorización de la asimetría izquierda-derecha, no la reversión. En términos muy simples, durante el desarrollo embrionario temprano, la asimetría izquierda-derecha se debe en parte al movimiento de señales moleculares hacia la izquierda a través del nodo embrionario. Este flujo es causado por el latido coordinado de los cilios, por lo que cuando no funcionan, el flujo se interrumpe y se produce la aleatorización.
Otros síntomas de los pacientes con ECP también señalan el trabajo de los cilios y flagelos en el cuerpo. La infertilidad masculina es común debido al esperma inmóvil. La infertilidad femenina, aunque menos común, también puede ocurrir, debido a la disfunción de los cilios del oviducto y las trompas de falopio que normalmente mueven el óvulo desde el ovario hasta el útero. Curiosamente, también hay una baja asociación de hidrocefalia interna (llenado excesivo de los ventrículos del cerebro con líquido cefalorraquídeo, causando su agrandamiento que comprime el tejido cerebral que los rodea) con PCD. Esto es probablemente debido a la disfunción de los cilios en las células ependimarias que recubren los ventrículos, y que ayudan a circular el LCR, pero aparentemente no son completamente necesarios. Dado que se cree que el flujo de LCR a granel es impulsado principalmente por el cambio sístole/ diástole en la presión arterial en el cerebro, algunos hipotetizan que los cilios pueden estar involucrados principalmente en la ow a través de algunos de los canales más estrechos en el cerebro.
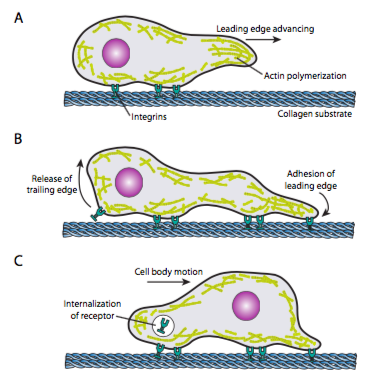
El rastreo de celdas (Figura \(\pageIndex{19}\)) requiere el reordenamiento coordinado de la red de microfilamentos del borde de ataque, extendiéndose (tanto por polimerización como por filamentos deslizantes) y luego formando adherencias en el nuevo punto más adelantado. Esto puede tomar la forma de filopodia o lamelipodia,y a menudo ambos simultáneamente. Los filopodios son proyecciones largas y muy delgadas con haces de núcleos de microfilamentos paralelos y altas concentraciones de receptores de superficie celular. Su propósito es principalmente sentir el medio ambiente. Los lamelipodia a menudo se extienden entre dos lopodia y son más de un volante ancho que un dedo. Internamente, la actina se forma más en mallas que en haces, y el borde más ancho permite que se hagan más adherencias al sustrato. La red de microfilamentos se reorganiza de nuevo, esta vez abriendo un espacio en el citoplasma que actúa como un canal para el movimiento de los microtúbulos hacia la parte frontal de la célula. Esto coloca la red de transporte en su lugar para ayudar a mover el material a granel intracelular hacia adelante. A medida que esto ocurre, se liberan las antiguas adherencias en el extremo posterior de la célula. Esta liberación puede ocurrir a través de dos mecanismos principales: endocitosis del receptor o desactivación del receptor mediante cambio de señalización/conformación. Por supuesto, esta simplificación excesiva desmiente las complejidades de coordinar y controlar todas estas acciones para lograr el movimiento dirigido de una célula.
Un modelo de generación de fuerza de microfilamento, el Modelo de Trinquete Browniano Elástico (Mogilner y Oster, 1996), propone que debido al movimiento browniano de la membrana celular resultante de la fluctuación térmica continua de minutos, los filamentos de actina que empujan hacia los bordes de la membrana se flexionan en diversos grados. Si la flexión es lo suficientemente grande, un nuevo monómero de actina puede caber entre la membrana y la punta del filamento, y cuando el filamento ahora más largo se flexiona hacia atrás, puede ejercer un mayor empuje sobre la membrana. Obviamente, un solo filamento no genera mucha fuerza, pero la extensión coordinada de muchos filamentos puede empujar la membrana hacia adelante.
Una vez que una célula recibe una señal de movimiento, la respuesta citoesquelética inicial es polimerizar actina, construyendo más microfilamentos para incorporarlos al borde de ataque. Dependiendo de la señal (atractiva o repulsiva), la polimerización puede ocurrir en el mismo o en el lado opuesto de la célula desde el punto de activación del receptor de señal. Significativamente, la polimerización de la nueva actina f sola puede generar suficiente fuerza para mover la membrana hacia adelante, incluso sin la participación de motores de miosina. Los modelos de generación de fuerza se están debatiendo, pero generalmente comienzan con la incorporación de nueva actina g en un filamento en su punta; es decir, en la interfaz filamento-membrana. Incluso si eso técnicamente fuera suficiente, en una célula viva, las miosina están involucradas, y ayudan a empujar y organizar los filamentos direccionalmente para establecer el nuevo borde de ataque. Además, algunos filamentos y redes deben cortarse rápidamente, y se deben hacer nuevas conexiones, tanto entre filamentos como entre filamentos y otras proteínas, como moléculas de adhesión o microtúbulos.
¿Cómo se controla la polimerización y el reordenamiento de actina? Los receptores que señalan la locomoción celular pueden iniciar vías algo diferentes, pero muchos comparten algunas similitudes en la activación de uno o más miembros de la familia Ras de GTPasas pequeñas. Estas moléculas de señalización, como Rac, Rho y cdc42, pueden ser activadas por las tirosinas cinasas receptoras(ver Vías de activación RTK-Ras, cap. 14). Cada uno de ellos tiene un papel ligeramente diferente en la motilidad celular: la activación de cdc42 conduce a la formación de filopodia, el Rac activa una vía que incluye Arp2/3 y la cofilina a la formación de lamelipodia, y el Rho activa la miosina II para controlar la adhesión focal y la formación de fibras de tensión. Un tipo diferente de cascada de receptores, la cascada de señalización de proteína G (también Capítulo 14), puede conducir a la activación de PLC y posterior escisión de PIP2 y aumento de Ca2+citosólico. Estos cambios, como se señaló anteriormente, también pueden activar la miosina II, así como las enzimas remodeladoras gelsolina, cofilina y profilina. Esto descompone las estructuras de actina existentes para hacer que la célula sea más fluida, al tiempo que contribuye con más actina g para formar el nuevo citoesqueleto de borde de ataque.
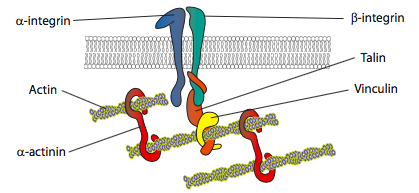
Los experimentos in vitro muestran que a medida que la membrana avanza, se hacen nuevos contactos adhesivos a través de moléculas de adhesión o receptores que se unen al sustrato (a menudo, los portaobjetos o platos de cultivo celular están recubiertos con colágeno, filaminina u otras proteínas de matriz extracelular). Los contactos luego reclutan elementos citoesqueléticos para una mayor estabilidad para formar una adhesión focal (Figura \(\pageIndex{20}\)). Sin embargo, la formación de adherencias focales parece ser un artefacto de cultivo celular, y no está claro si los tipos de adherencias que se forman in vivo reclutan los mismos tipos de componentes citoesqueléticos.
El tercer paso para la locomoción celular es el movimiento masivo del contenido celular hacia adelante. Los mecanismos para esta fase no están claros, pero hay algunas pruebas de que mediante el uso de enlaces entre el citoesqueleto de actina en el borde de ataque y las partes delanteras del citoesqueleto de microtúbulos, los microtúbulos se reorganizan para formar una ruta de transporte eficiente para el movimiento a granel. Otro aspecto de esto puede ser un efecto de «acorralado» por las redes de actinas, que abren direccionalmente el espacio hacia el borde de ataque. Los microtúbulos entran en ese espacio más fácilmente que trabajando a través de una malla de actina apretada, forzando el flujo en la dirección adecuada.
Gran parte del trabajo sobre las interacciones entre microtúbulos y actina en la motilidad celular se ha realizado a través de la investigación del cono de crecimiento neuronal, que a veces se conoce como una célula con correa, porque actúa casi independientemente como una célula que se arrastra, buscando la vía adecuada para conducir su axón desde el cuerpo celular a su conexión sináptica adecuada (A. W. Schaefer et al, Dev. Cell 15: 146-62, 2008).
Finalmente, la celda debe deshacer sus antiguas adherencias en el borde de salida. Esto puede suceder de varias maneras diferentes. In vitro, se ha observado que las células que se arrastran se desprenden del sustrato, dejando pequeños trozos de membrana y proteínas de adhesión asociadas en el proceso. Se presume que la fuerza generada proviene de fibras de estrés de actina-miosina que conducen desde las adherencias focales más avanzadas. Sin embargo, hay mecanismos menos destructivos disponibles para las células. En algunos casos, la adhesividad del receptor celular para el sustrato extracelular puede regularse internamente, tal vez por fosforilación o desfosforilación de un receptor. Otra posibilidad es la endocitosis del receptor, retirándolo de la superficie celular. Simplemente podría reciclarse hasta el borde de ataque donde se necesita (es decir, transcitosis), o si ya no se necesita o se daña, puede descomponerse en un lisosoma.
