Introducción del inhibidor del ciclo celular
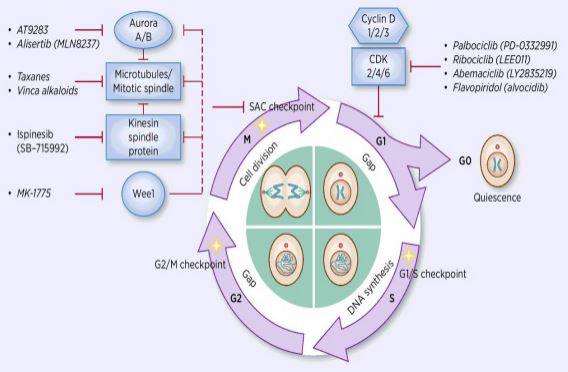
El proceso de regulación del ciclo celular es la activación o inactivación de varios factores reguladores bajo la vigilancia de puntos de control, iniciando así el proceso de replicación y división del ADN celular en dos células hijas. Entre muchos reguladores del ciclo celular, la quinasa dependiente de ciclina (CDK) está en el núcleo, y es un sistema de red que regula el ciclo celular con ciclina e inhibidores de la cinasa dependiente de ciclina (CKI). Las CDK son una clase de serina / treonina quinasas, y actualmente se encuentran 13 especies, incluidas las CDK1~13, que desempeñan un papel en la regulación del ciclo celular de las CDK y la regulación transcripcional de las CDK. La regulación del ciclo celular es, de hecho, la regulación de los puntos de control, siendo los puntos reguladores G1/S los más importantes. Cuando el ciclo celular es estimulado por señales externas tales como factores de crecimiento, la subunidad catalítica CDK4/CDK6 se une a la subunidad reguladora CyclinD, y los residuos CDKs son activados por fosforilación/desfosforilación. Después de la activación de CDKs, la proteína Rb es fosforilada. El gen rb, también conocido como el gen del retinoblastoma, es el primer gen supresor de tumores clonado, y su capacidad de formar un complejo con factores de transcripción (como E2F) después de que se pierde la fosforilación de la proteína. E2F juega un papel importante en la regulación del ciclo celular e induce la expresión de la CiclinA y CDK2 y forma un complejo de CiclinA/CDK2, que fosforila aún más la proteína Rb y libera completamente E2F. Posteriormente, E2F entra en el núcleo para activar una serie de ciclos celulares en la fase S. En la fase tardía de la replicación del ADN durante la fase S, la CDK2 es activada por la ciclina, que inactiva el factor de transcripción E2F a tiempo, previniendo la apoptosis causada por la E2F activada persistentemente. Las estadísticas de investigación muestran que más del 90% de los cánceres humanos tienen mutaciones en genes relacionados en las vías CDK, Ciclina, CKI y Rb, siendo la CDK y su subunidad reguladora correspondiente la ciclina la disfuncional más frecuente. Además, las fluctuaciones en el ciclo celular promueven la resistencia a la quimioterapia y reducen los efectos de la quimioterapia. Por lo tanto, la regulación de la actividad de CDK/ciclina, que restaura el ciclo celular normal, es una de las estrategias para tratar tumores.
Los inhibidores del ciclo celular ahora se usan clínicamente
Los investigadores se han centrado en encontrar diferentes tipos de inhibidores de CDK y ciclina como medicamentos anticancerígenos de vanguardia. Actualmente, los inhibidores de CDK se dividen principalmente en endógenos y exógenos. La clase más grande de inhibidores de moléculas pequeñas endógenas son las proteínas de bajo peso molecular, que se clasifican en dos grandes categorías de acuerdo con las diferencias en las funciones estructurales, y una clase se llama la familia específica dual INK4, que incluye p15, p16, p18, p19, que inhibe la familia de proteínas. La proteína inhibitoria dependiente de la quinasa asociada a ciclindia se une a la CDK4 libre correspondiente, bloqueando así la unión de CDK4 a la ciclindia correspondiente para formar un complejo de dímeros catalíticos. La otra clase se llama la familia Kip, incluyendo P21, P27, P57. Esta familia de proteínas puede formar un trímero con un complejo dimérico compuesto de ciclina E / CDK2 y ciclinA / CDK1, bloqueando el centro catalíticamente activo del dímero. La inhibición de estos inhibidores endógenos, cuando se combina con el complejo quinasa, regula específicamente su actividad, regulando así con precisión la transformación de la célula de la fase G1 a la fase S. Los estudios han demostrado que la aparición y el desarrollo de múltiples tumores se relacionan con una disminución de la expresión de CDKs/ciclinas o una disminución de la expresión de inhibidores endógenos, como la deleción de P16, que tiene relación con el desarrollo de melanoma, cáncer de pulmón, cáncer de mama y cáncer colorrectal. La eliminación de la proteína P27 es común en el cáncer de mama, el cáncer de próstata, el cáncer de colon y el cáncer gastrointestinal. Por lo tanto, la deleción de un inhibidor endógeno de CDKs o de una mutación genética es una referencia importante para el diagnóstico de tumores. Los inhibidores de moléculas pequeñas endógenas también son una clase de ARN no codificantes importantes descubiertos en los últimos años. Las regiones del sitio objetivo se unen entre sí para degradar rápida y eficientemente el ARNm o inhibir la traducción de la proteína, controlando la proteína a un nivel más bajo u óptimo y requiriendo actividades de la vida. Se han descubierto más de 10 microRNAs implicados en la regulación del ciclo celular. Entre ellos, miR1-2 y miR3-4 se dirigen a CDK4, respectivamente, y el ciclo celular se detiene en la fase G1, que inhibe la proliferación de células tumorales; miR-22 se dirige a las células CDK6. El ciclo está estancado en la fase G1, lo que induce la senescencia en las células cancerosas de mama. En diferentes procesos biológicos, estos MIRNAS regulan la progresión del ciclo celular al dirigirse a E2F, CDK,Ciclina, P21, P27, ADN polimerasa alfa, etc. promover o bloquear reguladores clave del ciclo celular. Los inhibidores exógenos incluyen ácidos nucleicos antisentidos, anticuerpos, ARN de interferencia pequeña (siRNA) y compuestos de moléculas pequeñas. Los compuestos de moléculas pequeñas son la clase más importante de inhibidores exógenos de CDK. En los últimos años, como la comprensión de la estructura cristalina permite a las personas realizar estudios de simulación molecular, se han hecho avances en el diseño y desarrollo de estudios selectivos y altamente eficientes sobre inhibidores químicos de CDK. Se puede decir que estos compuestos tienen nuevos miembros todos los días. En la actualidad, los inhibidores de CDK de moléculas pequeñas se pueden dividir en las siguientes 13 categorías, Roscovitina y Olomouc, Pirimidinas (PD-033299), Flavonoides (Flavopiridoles), Tiazoles (SNS03), antraceno y sus derivados (SU951), piperidona (Paullonas), imidazopiridina, pirazolopiridina (AZ703), pirazinas ( AT751), butirolactona-1 (butirolactona-1), escorpionina (UCN-01) y otras dos especies. Trece inhibidores de moléculas pequeñas han entrado en ensayos clínicos. Todos son productos químicos de moléculas pequeñas de heterociclos planos que compiten con el ATP por unirse al sitio de unión al ATP de la quinasa CDK. Los experimentos in vivo mostraron que CYC202 tiene buena resistencia a los medicamentos y buena actividad fisiológica oral y tiene efectos inhibitorios obvios en tumores sólidos en ratones desnudos inoculados por células de cáncer de colon humano y cáncer de útero. En los estudios de fase Ib, 10 pacientes de cáncer de ovario tomaron CYC durante más de 20 meses, sin aumento de tumores ni efectos secundarios graves relacionados con el tratamiento, entre los cuales el tumor de una paciente se redujo en más de 30%, y algunas pacientes que recibieron tratamiento durante más de un año tienen una afección estable. Los estudios clínicos de fase II han encontrado que CYC202 solo tiene un efecto ligeramente más pobre y es eficaz en combinación con otros medicamentos quimioterapéuticos. También se están realizando ensayos clínicos de fase IIb de CYC202 en combinación con capecitabina para el tratamiento del cáncer de mama, en combinación con 2,2-difluorodeoxicitidina o cisplatino para el tratamiento del cáncer de pulmón y el carcinoma nasofaríngeo. El desarrollo y la aplicación de la tecnología de interferencia de ARN de moléculas pequeñas han hecho posible estudiar la expresión génica de moléculas diana de intervención específicas, y muchos científicos han comenzado a intervenir en la síntesis de CDK/ciclina a nivel genético. Limaet al. transfectadas Tetraciclina-orientación de siRNA en Hep3B, HepG2, SNU449 (Tetraciclina sobreexpresión) y HuH7 (Tetraciclina sobreexpresa) y encontraron que la Tetraciclina expresión se redujo en un 90% en las células. La síntesis de ADN se reduce significativamente y las células sufren apoptosis. Galimberti et al. siRNA transfectado dirigido a CiclinA, CDK2 y CDK1 en células de cáncer de pulmón de ratón HOP-62, H-522 y H-23, respectivamente, y encontró que la CiclinA/CDK2 puede inducir apoptosis e inhibir la proliferación de células de cáncer de pulmón. La disminución de la expresión de CDK1 causada por la interferencia de siRNA CDK1 solo causa detención de fase celular y ralentiza la proliferación celular; mientras que la cointerferencia de siRNA CDK1 y CDK2 conduce a una disminución simultánea de la expresión de CDK1 y CDK2, causando resistencia en las fases del ciclo celular S y G2/M. El estancamiento también indujo apoptosis de las células. Cao Yinfang y otras transfecciones exitosas del vector de expresión recombinante de ARNr CDK2/CiclinA en células HepG2 mostraron que la expresión de ARNm CDK2 y CiclinA disminuyó significativamente, el ciclo celular se detuvo en la fase S, las células de la fase G1 aumentaron significativamente, la actividad de caspasa-3 aumentó, las células HepG2 se sometieron a apoptosis y los cambios en el ciclo celular fueron consistentes con una disminución de la proliferación de células HepG2 en vitro después de la transfección.
Función del inhibidor del ciclo celular
Con la profundización de la comprensión de la importante función de la regulación del ciclo celular en la formación y apoptosis tumorales, la regulación del ciclo celular se ha estudiado más a fondo en la resistencia a la quimioterapia tumoral. Las quinasas dependientes de ciclinas (Cdk), que desempeñan un papel en la conducción del motor celular durante el ciclo celular, son objetivos ideales para la terapia tumoral. La mayoría de las células cancerosas tienen activación, sobreexpresión del gen del ciclo de división celular (cdk) y defectos en la función del CDKIs. El inhibidor de CDK ejerce una acción de ruptura que inhibe el ciclo celular. En los últimos años, los CDKIS se han convertido en un punto destacado de la terapia del cáncer, que inhibe la actividad de los CDK en el ciclo celular. Una serie de estudios clínicos también han demostrado que una sola aplicación puede tener efectos moderados. Sin embargo, en combinación con medicamentos quimioterapéuticos citotóxicos tradicionales, los CDKIs pueden mejorar significativamente el efecto antitumoral de los medicamentos quimioterapéuticos tradicionales. Por lo tanto, la investigación sobre los efectos anticancerígenos de los fármacos CDKIs y otros fármacos quimioterapéuticos se ha convertido en un punto caliente en el tratamiento actual de la resistencia tumoral.
Referencia
- Bendris N, Lemmers B, Blanchard J M. Ciclo celular, dinámica del citoesqueleto y más allá: las muchas funciones de las ciclinas y los inhibidores de CDK. Ciclo Celular. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt S G, et al. Targeting nuclear kinases in cancer: development of cell cycle kinase inhibitors (en inglés). Farmacología & Terapéutica. 2014, 142(2):258-269.
- Stone A, Sutherland R L, Musgrove E A. Inhibidores de las cinasas del ciclo celular: avances recientes y perspectivas futuras como terapias contra el cáncer. Hematocrito Oncog. 2012, 17(2):175-198.
- Xu W, Mcarthur G. Regulación del Ciclo Celular y Melanoma. Informes Oncológicos Actuales. 2016, 18(6):34.
- Malumbres M, Barbacid M. Ciclo celular, CDKs y cáncer: un paradigma cambiante. La Naturaleza Revisa el Cáncer. 2009, 9(3):153-166.
