Kort beskrivelse af to typer programmeret celledød: apoptose og autofagi
apoptose, eller type i programmeret celledød, er den mest undersøgte form for celledød. Dens morfologiske egenskaber kan identificeres under lysmikroskopi og omfatter cellekrympning, komprimering af kromatinet, blebbing af den cytoplasmatiske membran og endelig dannelsen af apoptotiske legemer (Figur 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
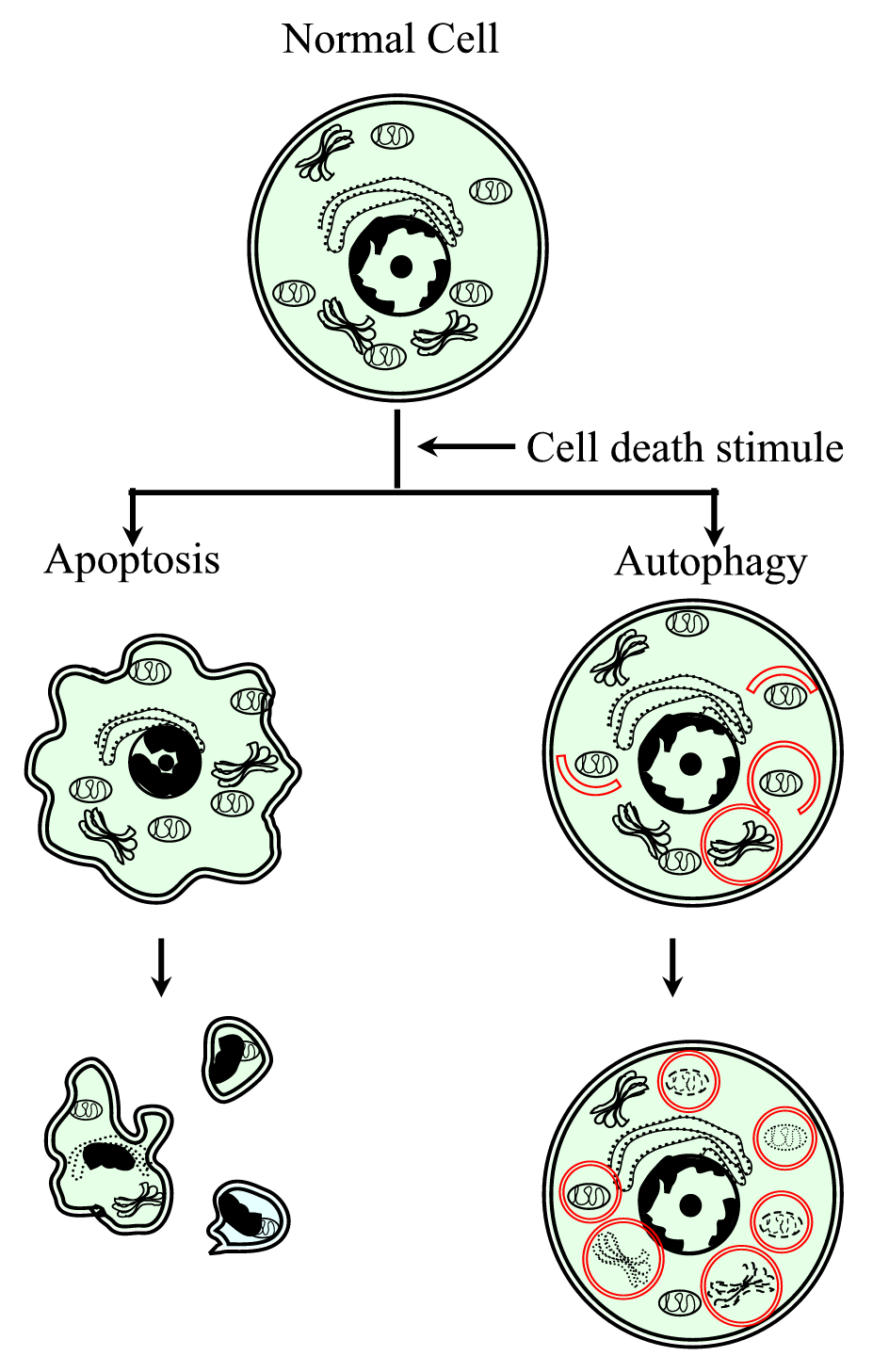
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:4386677503″> ” > skematisk repræsentation af den programmerede celledødsproces type i (apoptose) og type II (autofagi). Apoptose er kendetegnet ved en cellulær sammentrækning, kromatinkomprimering, membranøse blebs og dannelsen af apoptotiske legemer. Autophagy er karakteriseret ved tilstedeværelsen af et stort antal autophagosomer med cytoplasmatisk indhold. Begge typer celledød genererer ikke en inflammatorisk respons, da den cytoplasmatiske membran bevares, indtil det cellulære affald elimineres af nabolaget eller af specialiserede.
caspaser er cysteinyl-aspartatspecifikke proteaser, der syntetiseres i en inaktiv form som pro-caspaser (figur 2). Det er denne inaktive form, der tillader den kontrollerede udførelse af celledødsprocessen. Caspaser blev først identificeret i nematoden Ceanorhabditis elegans, men homologe former er til stede hos pattedyr .
kendetegnene for apoptose, såsom DNA-fragmentering og komprimeret kromatin, skyldes caspaseaktivitet. Under apoptose fragmenteres DNA i nukleosomstørrelse (200 bp) . Faktoren, der er ansvarlig for DNA-fragmentering under apoptose, er en specifik DNase (CAD, caspase-aktiveret DNase), der aktiveres af aktiv caspase-3 . Aktiv caspase-3 er igen involveret i morfologiske celleændringer under apoptose, hvor den spalter rho-associeret kinase-1 (ROCK-1) for at aktivere den, og dette påvirker endelig det cytoskeletale arrangement, der forårsager den apoptotiske krympemorfologi .

figur 2.
smlns: slink=”http://www.w3.org/1999/xlink ” smlns:mml=”http://www.w3.org/1998/Math/MathML”Hsmlns:HSI=”http://www.w3.org/2001/XMLSchema-instancecaspaser involveret i den apoptotiske proces syntetiseres i en inaktiv form som symogener, udgøres af et pro-domæne, en stor underenhed og en lille underenhed. De aktiveres og danner tetramerer.
apoptotisk celledød er stærkt reguleret af medlemmer af B-celle lymfom 2 (Bcl-2) familien . Bcl – 2 familiemedlemmer er blevet klassificeret som anti-apoptotiske og pro-apoptotiske proteiner i henhold til deres Bcl-2 homologi (BH) og domæneorganisation (figur 3). Tilstedeværelsen af domæner BH1, BH2, BH3 og BH4 svarer til den gruppe, der hæmmer apoptose. Den pro-apoptotiske gruppe er derimod opdelt i to grupper: dem med domæner BH1, BH2 og BH3 og dem med kun BH3-domænerne (kun defineret som BH3; se gennemgangen i ). Denne familie af proteiner udfører sine funktioner på det intracellulære niveau inde i mitokondrierne, et nøgleelement i apoptose.

figur 3.
http://www.w3.org/1999/xlink “mmlns: mml=” http://www.w3.org/1998/Math/MathML”>B-celle lymfom 2 (Bcl-2) familieproteiner. A) generel skematisering af strukturen af Bcl-2 proteiner. B) de anti-apoptotiske medlemmer – de besidder alle de fire BH-domæner. C) de pro-apoptotiske medlemmer, som igen er opdelt i to grupper: multidomain og BH3 kun.
apoptose kan initieres af to velbeskrevne ruter: de ydre og indre veje (figur 4). Ekstrinsisk aktivering udføres gennem deltagelse af dødsligander (såsom tumornekrosefaktor – TNF – superfamilieog TNF-relaterede apoptose-inducerede ligander eller TRAIL) med deres beslægtede celleoverfladedødsreceptorer (såsom TNF-receptor 1, Fas, TRAILRECEPTOR 1 eller TRAILRECEPTOR 2) (gennemgået i ). Når liganden genkender og binder sig til dens receptor, dannes en række intracellulære komplekser for at aktivere initiator caspaser (såsom -8 og -10), som derefter aktiverer bøddel caspaser (såsom -3, -6 og -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. Ligand-receptor-interaktionen inducerer samlingen af det dødsinducerende signalkompleks (disk) for at fremme aktiveringen af caspase-8, som igen er i stand til at aktivere til eksekutor caspase -3, -6 eller -7, der fører til de morfologiske ændringer af apoptosen. Den iboende rute styres af den mitokondrie ydre membranpermeabilisering, som tillader frigivelse af pro-apoptotiske elementer som cytochrom-C. cytochrom-C inducerer apoptose protease-aktiverende faktor 1 (Apaf-1) for at fremme aktiveringen af caspase-9 for at samle apoptosomet. Apoptosomet er i stand til at aktivere til eksekutor caspaser.
den iboende apoptotiske vej kan derimod aktiveres af forskellige stimuli, herunder DNA-skade, vækstfaktor sult og oksidativ stress . Under eksponering af celler for disse stimuli påvirkes mitokondrierne, da flere medlemmer af Bcl-2-familien aktiveres og fremmer mitokondrier ydre membranpermeabilisering (MOMP). Den gennemsyrede eksterne mitokondriermembran tillader frigivelse af cytokrom c (cyt c), som er forbundet med Apaf-1-proteinet. Cyt c og Apaf-1-foreningen binder derefter til initiator caspase-9 for at danne det kompleks, der udgør apoptosomet, som har evnen til at aktivere initiator caspaser, der udfører deres funktioner ved at spalte specifikke cellulære substrater.
den anden proces med celledød, autofagi, er en genetisk programmeret og evolutionært konserveret proces, der producerer nedbrydning af forældede organeller og proteiner. Det aktiveres af sådanne ekstracellulære stimuli som næringsstof sult, hypoksi, høj temperatur og ændrede intracellulære tilstande, herunder akkumulering af beskadigede eller overflødige organeller (gennemgået i ).
i eukaryote organismer er tre typer autofagi blevet beskrevet: mikroautofagi, makroautofagi (almindeligvis kaldet simpelthen autofagi) og chaperonmedieret autofagi (figur 5). Mikroautofagi involverer opsugning af cytoplasmatiske komponenter direkte på lysosomets niveau ved hjælp af en invagineringsproces, mens makroautofagi indebærer dannelse af dobbeltmembranvesikler, der indeholder cellulære komponenter, der smelter sammen med lysosomer for at danne et autophagolysosom. Det er inde i autophagolysosomet, at de intra-vesikulære komponenter nedbrydes og om muligt genanvendes af cellen (gennemgået i ). Chaperone-medieret autofagi indebærer endelig deltagelse af chaperoner i genkendelse af de proteiner, der er udpeget til eliminering af lysosomerne .

figur 5.
iv id=”http://www.w3.org/1999/xlink” Hmlns:mml=”http://www.w3.org/1998/Math/MathML” Hmlns:SSI=”http://www.w3.org/2001/XMLSchema-instance skematiske repræsentationer af de forskellige mekanismer for autofagi. Makroautofagi-autofagi-indebærer dannelse af en dobbeltmembran vesikel, der opsluger cytoplasmatisk indhold, der vil blive ført til lysosomet, der skal nedbrydes. Mikroautofagi er kendetegnet ved direkte opsugning af cytoplasmatiske komponenter af lysosomet. Denne proces involverer ombygning af organellens membran ved dannelse af en lysosomal membraninvagination. Under chaperonmedieret autofagi er proteinerne, der skal nedbrydes, målrettet mod en Hsp70, som igen transporterer mållasten til lysosomet.
Autophagy er rettet af ATG(AuTophaGy-relaterede) gener, som er nødvendige for at aktivere signalkomplekset, der udløser dannelsen af autophagosomer . Atggener blev opdaget i gær, men mange har ortologer i højere eukaryoter (figur 6). Autophagosomdannelse indebærer deltagelse af det cytoplasmatiske protein LC3 (atg8), som gennemgår lipidering af phosphatidylethanolamin og rekrutteres derefter til den spirende autophagosommembran (Figur 7). Akkumulering af lipideret LC3-protein (kendt som LC3-II) anvendes som en markør for autofagi .

figur 6.
http://www.w3.org/1999/xlink “mmlns: mml=” http://www.w3.org/1998/Math/MathML “:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. LC3-protein er lipideret af phosphatidylethanolamin.
Autofagisk celledød eller type II programmeret celledød er kendetegnet ved en massiv opslukning af cytoplasmaet ved autofagiske vesikler. Denne intense autofagiske aktivitet adskiller sig væsentligt fra autofagi, der forekommer kontinuerligt på basale niveauer. Ultrastrukturelle undersøgelser i Drosophila har afsløret akkumulering af autofagiske vakuoler i de fleste larvevæv. Denne type programmeret celledød begynder med nedbrydning af cytoplasmatiske organeller ved autofagi, selvom de cytoskeletale elementer bevares indtil de sene stadier af processen (gennemgået i ).
