læringsmål
- Beskriv den grundlæggende struktur af en aminosyre
- Beskriv de kemiske strukturer af proteiner
- Opsummer de unikke egenskaber ved proteiner
i begyndelsen af dette kapitel blev der beskrevet et berømt eksperiment, hvor forskere syntetiserede aminosyrer under betingelser, der simulerer dem, der er til stede på jorden længe før livets udvikling, som vi kender det. Disse forbindelser er i stand til at binde sammen i stort set ethvert antal, hvilket giver molekyler af stort set enhver størrelse, der har en bred vifte af fysiske og kemiske egenskaber og udfører adskillige funktioner, der er vigtige for alle organismer. Molekylerne afledt af aminosyrer kan fungere som strukturelle komponenter i celler og subcellulære enheder, som kilder til næringsstoffer, som Atom – og energilagringsreservoirer og som funktionelle arter såsom hormoner, receptorer og transportmolekyler.
aminosyrer og peptidbindinger

Figur 1.
en aminosyre er et organisk molekyle, hvori et hydrogenatom, en carboksyl gruppe (–COOH) og en aminogruppe (–NH2) alle er bundet til det samme carbonatom, det såkaldte purpurcarbon. Den fjerde gruppe, der er bundet til karbonet, varierer mellem de forskellige aminosyrer og kaldes en rest eller en sidekæde, repræsenteret i strukturelle formler med bogstavet R. En Rest er en monomer, der resulterer, når to eller flere aminosyrer kombinerer og fjerner vandmolekyler. Den primære struktur af et protein, en peptidkæde, er lavet af aminosyrerester. De unikke egenskaber ved de funktionelle grupper og R-grupper tillader disse komponenter i aminosyrerne at danne hydrogen -, ion-og disulfidbindinger sammen med polære/ikke-polære interaktioner, der er nødvendige for at danne sekundære, tertiære og kvaternære proteinstrukturer. Disse grupper består primært af kulstof, brint, ilt, nitrogen og svovl i form af carbonhydrider, syrer, amider, alkoholer og aminer. Et par eksempler, der illustrerer disse muligheder, findes i Figur 1.
aminosyrer kan kemisk binde sammen ved reaktion af carboksilsyregruppen af et molekyle med amingruppen af en anden. Denne reaktion danner en peptidbinding og et vandmolekyle og er et andet eksempel på dehydreringssyntese (figur 2). 50 eller færre) kaldes peptider, og præfikser bruges ofte til at specificere disse tal: dipeptider (to aminosyrer), tripeptider (tre aminosyrer) og så videre. Mere generelt betegnes det omtrentlige antal aminosyrer: oligopeptider dannes ved at forbinde op til ca.20 aminosyrer, hvorimod polypeptider syntetiseres fra op til ca. 50 aminosyrer. Når antallet af aminosyrer, der er bundet sammen, bliver meget stort, eller når flere polypeptider bruges som bygningsunderenheder, kaldes de makromolekyler, der resulterer, proteiner. Den kontinuerligt variable længde (antallet af monomerer) af disse biopolymerer sammen med forskellige mulige R-grupper på hver aminosyre muliggør en næsten ubegrænset mangfoldighed i de typer proteiner, der kan dannes.

figur 2. Peptidbindingsdannelse er en dehydreringssyntesereaktion. Den første aminosyre (alanin) er bundet til aminogruppen af den indkommende anden aminosyre (alanin). I processen frigives et molekyle vand.
tænk over det
- hvor mange aminosyrer er der i polypeptider?
proteinstruktur
størrelsen (længden) og den specifikke aminosyresekvens af et protein er vigtige determinanter for dets form, og formen af et protein er kritisk for dets funktion. I processen med biologisk kvælstoffiksering (se biogeokemiske cyklusser) interagerer jordmikroorganismer kollektivt kendt som jordstængler symbiotisk med rødder af bælgplanter såsom sojabønner, jordnødder eller bønner for at danne en ny struktur kaldet en knude på planterødderne. Planten producerer derefter et bærerprotein kaldet leghemoglobin, et protein, der bærer nitrogen eller ilt. Leghemoglobin binder med en meget høj affinitet til dets substrat ilt i et specifikt område af proteinet, hvor formen og aminosyresekvensen er passende (det aktive sted). Hvis formen eller det kemiske miljø på det aktive sted ændres, endda lidt, er substratet muligvis ikke i stand til at binde så stærkt, eller det binder muligvis slet ikke. For at proteinet skal være fuldt aktivt, skal det således have den passende form til dets funktion.
proteinstruktur er kategoriseret i form af fire niveauer: primær, sekundær, tertiær og Kvartær. Den primære struktur er simpelthen sekvensen af aminosyrer, der udgør polypeptidkæden. Figur 3 viser den primære struktur af et protein.
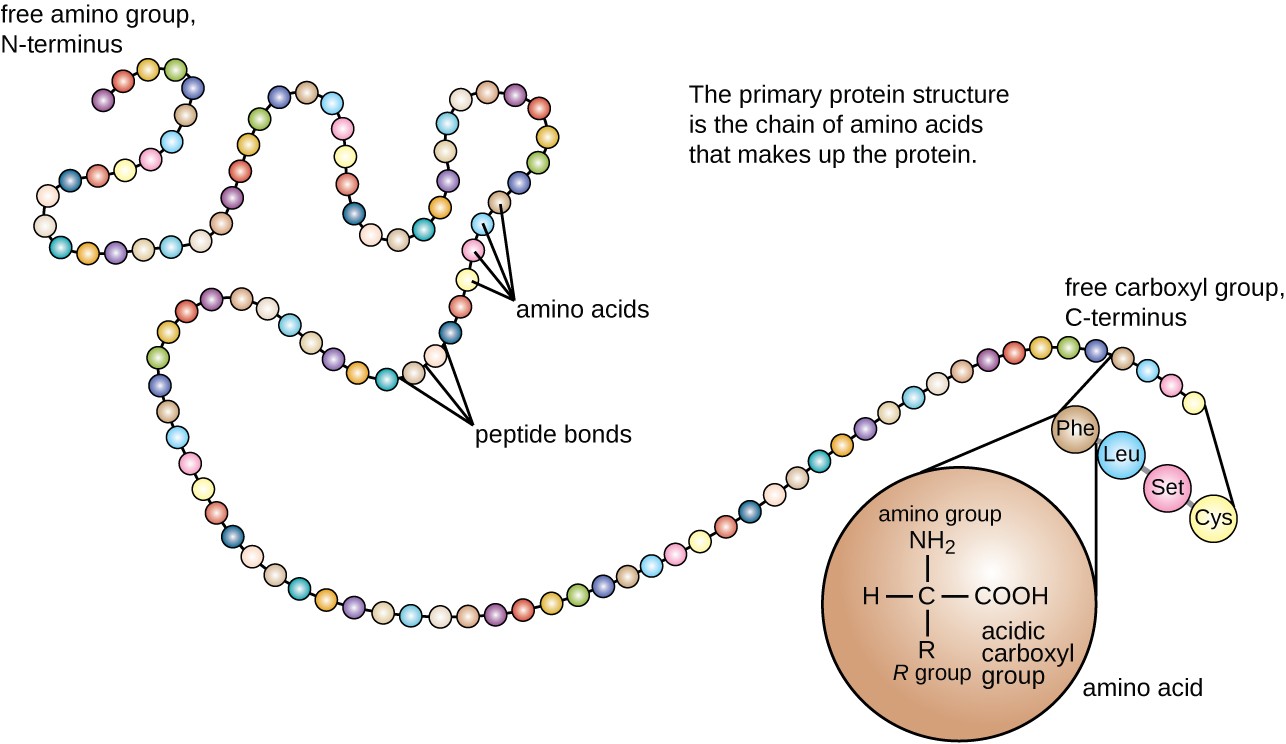
figur 3. Klik for at se et større billede. Den primære struktur af et protein er sekvensen af aminosyrer. (kredit: ændring af arbejde fra National Human Genome Research Institute)
kæden af aminosyrer, der definerer et proteins primære struktur, er ikke stiv, men er i stedet fleksibel på grund af arten af de bindinger, der holder aminosyrerne sammen. Når kæden er tilstrækkelig lang, kan hydrogenbinding forekomme mellem Amin-og carbonylfunktionelle grupper inden i peptidrygraden (undtagen R-sidegruppen), hvilket resulterer i lokal foldning af polypeptidkæden i spiraler og ark. Disse former udgør et proteins sekundære struktur. De mest almindelige sekundære strukturer er den røde spiral og den plisserede plade. I strukturen af en kolon-spiral holdes spiralen af hydrogenbindinger mellem iltatomet i en carbonylgruppe af en aminosyre og hydrogenatomet i aminogruppen, der kun er fire aminosyreenheder længere langs kæden. I det priplisserede ark dannes plovene af lignende hydrogenbindinger mellem kontinuerlige sekvenser af carbonyl-og aminogrupper, der yderligere adskilles på rygraden i polypeptidkæden (figur 4).

figur 4. Den sekundære struktur af et protein kan være en kurp-spiral eller et kurplisseret ark eller begge dele.
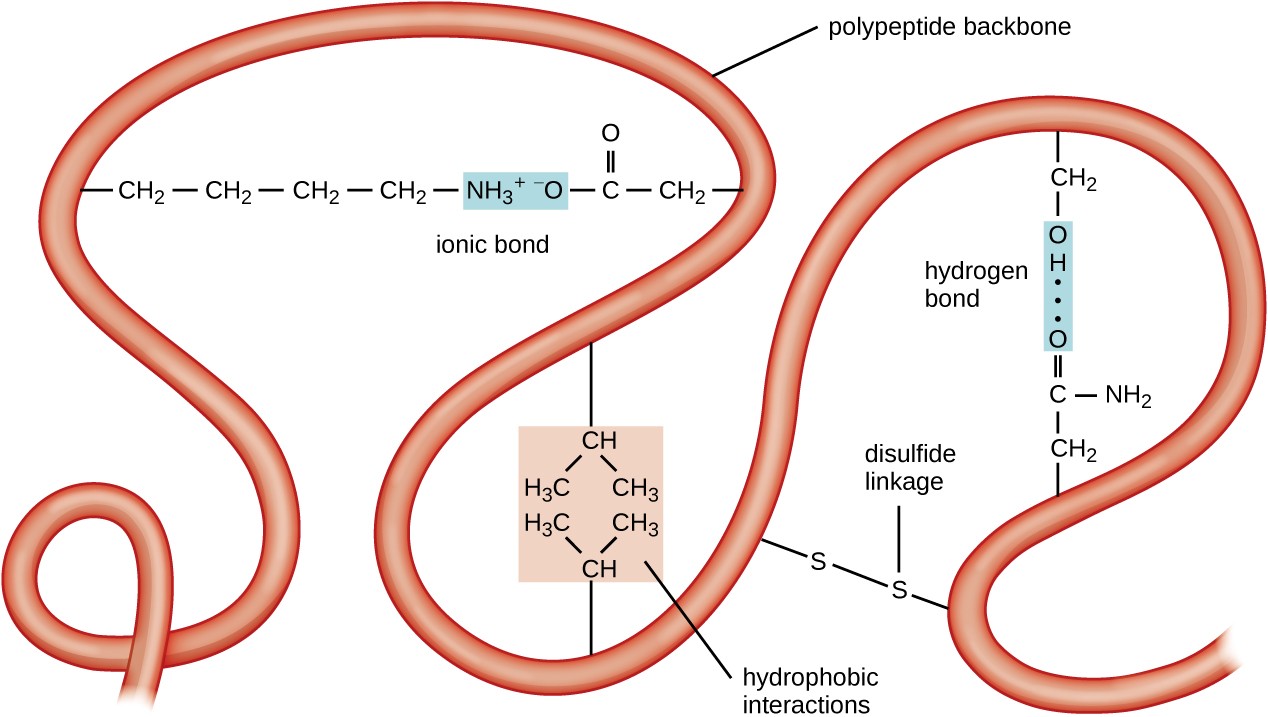
figur 5. Klik for at se større billede. Den tertiære struktur af proteiner bestemmes af en række attraktive kræfter, herunder hydrofobe interaktioner, ionisk binding, hydrogenbinding og disulfidforbindelser.
det næste niveau af proteinorganisation er den tertiære struktur, som er den store tredimensionelle form af en enkelt polypeptidkæde. Tertiær struktur bestemmes af interaktioner mellem aminosyrerester, der er langt fra hinanden i kæden. En række interaktioner giver anledning til protein tertiær struktur, såsom disulfidbroer, som er bindinger mellem sulfhydryl (–SH) funktionelle grupper på aminosyresidegrupper; hydrogenbindinger; ioniske bindinger; og hydrofobe interaktioner mellem ikke-polære sidekæder. Alle disse interaktioner, svage og stærke, kombineres for at bestemme den endelige tredimensionelle form af proteinet og dets funktion (Figur 5).
den proces, hvormed en polypeptidkæde antager en storskala tredimensionel form kaldes proteinfoldning. Foldede proteiner, der er fuldt funktionelle i deres normale biologiske rolle, siges at have en indfødt struktur. Når et protein mister sin tredimensionelle form, er det muligvis ikke længere funktionelt. Disse udfoldede proteiner denatureres. Denaturering indebærer tab af den sekundære struktur og tertiær struktur (og, hvis den er til stede, den kvartære struktur) uden tab af den primære struktur.
nogle proteiner er samlinger af flere separate polypeptider, også kendt som proteinunderenheder. Disse proteiner fungerer kun tilstrækkeligt, når alle underenheder er til stede og korrekt konfigureret. Interaktionerne, der holder disse underenheder sammen, udgør proteinets kvaternære struktur. Den samlede kvaternære struktur stabiliseres ved relativt svage interaktioner. Hemoglobin har for eksempel en kvaternær struktur af fire kugleformede proteinunderenheder: to liter og to liter polypeptider, der hver indeholder en jernbaseret hæm (figur 6).

figur 6. Et hæmoglobinmolekyle har to liter og to liter polypeptider sammen med fire hæmgrupper.
en anden vigtig klasse af proteiner er de konjugerede proteiner, der har en nonprotein-del. Hvis det konjugerede protein har et kulhydrat bundet, kaldes det et glycoprotein. Hvis det har et lipid fastgjort, kaldes det et lipoprotein. Disse proteiner er vigtige komponenter i membraner. Figur 7 opsummerer de fire niveauer af proteinstruktur.

Figur 7. Proteinstruktur har fire organisationsniveauer. (kredit: ændring af arbejde fra National Human Genome Research Institute)
tænk over det
- hvad kan der ske, hvis et proteins primære, sekundære, tertiære eller kvaternære struktur ændres?
primær struktur, dysfunktionelle proteiner og cystisk fibrose

figur 8. Klik for at se et større billede. Det normale CFTR-protein er et kanalprotein, der hjælper salt (natriumchlorid) med at bevæge sig ind og ud af celler.
proteiner forbundet med biologiske membraner klassificeres som ydre eller indre. Ekstrinsiske proteiner, også kaldet perifere proteiner, er løst forbundet med den ene side af membranen. Iboende proteiner eller integrerede proteiner er indlejret i membranen og fungerer ofte som en del af transportsystemer som transmembranproteiner. Cystisk fibrose (CF) er en human genetisk lidelse forårsaget af en ændring i transmembranproteinet. Det påvirker mest lungerne, men kan også påvirke bugspytkirtlen, leveren, nyrerne og tarmen. CF er forårsaget af et tab af aminosyren phenylalanin i et cystisk fibrose transmembranprotein (CFTR). Tabet af en aminosyre ændrer den primære struktur af et protein, der normalt hjælper med at transportere salt og vand ind og ud af celler (figur 8).
ændringen i den primære struktur forhindrer proteinet i at fungere korrekt, hvilket får kroppen til at producere usædvanligt tykt slim, der tilstopper lungerne og fører til ophobning af klæbrig slim. Slimet forhindrer bugspytkirtlen og forhindrer naturlige bakterier i at hjælpe kroppen med at nedbryde mad og absorbere vitale næringsstoffer.
i lungerne hos personer med cystisk fibrose giver det ændrede slim et miljø, hvor bakterier kan trives. Denne kolonisering fører til dannelsen af biofilm i lungernes små luftveje. De mest almindelige patogener, der findes i lungerne hos patienter med cystisk fibrose, er Pseudomonas aeruginosa (figur 9a) og Burkholderia cepacia. Pseudomonas adskiller sig inden for biofilmen i lungen og danner store kolonier, kaldet “mucoid” Pseudomonas. Kolonierne har en unik pigmentering, der dukker op i laboratorieundersøgelser (figur 9b) og giver læger den første anelse om, at patienten har CF (sådanne kolonier er sjældne hos raske individer).

figur 9. (a) en scanningselektronmikrograf viser den opportunistiske bakterie Pseudomonas aeruginosa. B) pigmentproducerende P. aeruginosa på cetrimidagar viser det grønne pigment kaldet pyocyanin. (credit a: ændring af arbejde fra Centers for Disease Control and Prevention)
nøglebegreber og Resume
- aminosyrer er små molekyler, der er essentielle for alt liv. Hver har et karbon, hvortil et hydrogenatom, en karbongruppe og en amingruppe er bundet. Den fjerde bundne gruppe, repræsenteret af R, varierer i kemisk sammensætning, størrelse, polaritet og ladning blandt forskellige aminosyrer, hvilket giver variation i egenskaber.
- peptider er polymerer dannet ved binding af aminosyrer via dehydreringssyntese. Bindingerne mellem de forbundne aminosyrer kaldes peptidbindinger. Antallet af aminosyrer bundet sammen kan variere fra nogle få til mange.
- proteiner er polymerer dannet ved binding af et meget stort antal aminosyrer. De udfører mange vigtige funktioner i en celle, der tjener som næringsstoffer og mineraler; opbevaringsmolekyler til kulstof, nitrogen og energi; og strukturelle komponenter.
- strukturen af et protein er en kritisk determinant for dets funktion og beskrives ved en gradueret klassificering: primær, sekundær, tertiær og Kvartær. Den oprindelige struktur af et protein kan forstyrres af denaturering, hvilket resulterer i tab af dets højere ordens struktur og dets biologiske funktion.
- nogle proteiner dannes af flere separate proteinunderenheder, interaktionen mellem disse underenheder, der komponerer proteinkompleksets kvaternære struktur.
- konjugerede proteiner har en nonpolypeptiddel, der kan være et kulhydrat (danner et glycoprotein) eller en lipidfraktion (danner et lipoprotein). Disse proteiner er vigtige komponenter i membraner.
Multiple Choice
hvilken af følgende grupper varierer mellem forskellige aminosyrer?
- brintatom
- R-gruppe
- aminogruppe
aminosyrerne, der er til stede i proteiner, adskiller sig i hvilket af følgende?
- størrelse
- form
- sidegrupper
- alle ovenstående
hvilke af følgende Obligationer er ikke involveret i tertiær struktur?
- peptidbindinger
- ioniske bindinger
- hydrofobe interaktioner
- brintbindinger
udfyld Blanket
sekvensen af aminosyrer i et protein kaldes dets __________.
denaturering indebærer tab af __________ og __________ strukturer uden tab af __________ struktur.
True/False
en ændring i en aminosyre i en proteinsekvens resulterer altid i et tab af funktion.
tænk over det
- opvarmning af et protein tilstrækkeligt kan få det til at denaturere. I betragtning af definitionen af denaturering, hvad siger denne erklæring om styrken af peptidbindinger i sammenligning med hydrogenbindinger?
- det viste billede repræsenterer et tetrapeptid.

- hvor mange peptidbindinger er i dette molekyle?
- Identificer sidegrupperne af de fire aminosyrer, der udgør dette peptid.
