hvad er tætheden af celler?
Læsertilstand
tætheden af biologisk materiale er ansvarlig for aflejring af celler til bunden af vores laboratorierør og flerbrøndsplader og tjener som grundlag for den rutinemæssige centrifugering, der er en del af så mange biologers daglige liv. Disse meget samme forskelle i tæthed mellem celler og deres vandige ydre er også grundlaget for den kontrast, vi observerer i fasemikroskopibilleder. Disse forskelle er også vigtige uden for laboratorieindstillingen. For eksempel er plankton nødt til at kæmpe med denne tæthedsforskel for at forblive i en dybde i havet, hvor sollys er rigeligt snarere end at synke til de sorte dybder. I betragtning af at de fleste biologer og biokemikere dagligt bruger adskillelse baseret på tæthed, forekommer det overraskende, hvor sjældent tætheder som dem, der er samlet i tabel 1, faktisk diskuteres.
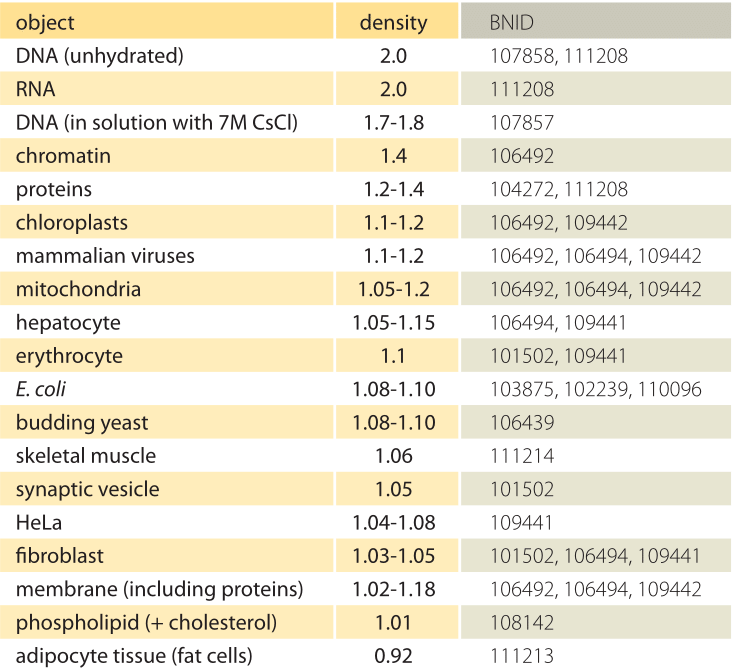
tabel 1: tætheder af biologiske objekter i forhold til vand. Dette svarer næsten til at give dem i enheder på g/ml eller 1000 kg/m3. Værdier sorteres i faldende rækkefølge. Medmindre andet er angivet, blev værdierne målt i saccharose eller ficoll-opløsning.
Hvad er det underliggende grundlag for de forskellige tætheder af forskellige organeller og celletyper? Disse forskelle kan i høj grad tilskrives forholdet mellem vandindhold og tørmasse. Proteiner har en massefylde på 1,3-1,4 (BNID 104272, 101502) i forhold til vand (eller næsten ækvivalent i enheder på g/ml eller 1000 kg/m3). I betragtning af benchmarkværdien på 1 for vandtætheden, et spektrum af mellemværdier for celletætheden mellem 1 og 1.3 opnås baseret på den relative overflod af proteiner og vand. Lipider er i den lave ende ved siden af vand med en densitet på omkring 1 (BNID 108142). I den anden ekstremitet kan stivelsesgranuler med en densitet på kvit 1,5 (BNID 103206) og nukleotider ved kvit 1,7 forskyde den samlede massebalance i modsat retning.
at kende densiteten er ofte baseret på det sted, hvor en given biologisk komponent sætter sig, når den spindes i en centrifuge indeholdende en gradient af koncentrationer, der ofte produceres af saccharose eller i tilfælde af DNA, cæsiumchlorid. Tætheden afspejler massen divideret med volumenet, men for ladede forbindelser i opløsning påvirkes densiteten også af skaller af såkaldt bundet vand. Tætheden bliver i dette tilfælde en effektiv tæthed, reduceret af det bundne vand og dermed noget afhængig af saltkoncentrationen (BNID 107858).
sedimenteringshastigheden, som forekommer i en centrifuge, kvantificeres i enheder af Svedberg, som er oprindelsen af navnene 70S, 23S osv. for ribosomet og dets rRNA-underenheder. En 23S rRNA vil sedimentere med en hastighed på 23 til 10-12 m/s under normal tyngdekraft. I en ultracentrifuge, der producerer en acceleration på en million g, vil hastigheden proportionalt skalere til 23 til 10-6 m/s eller ca.1 mm/min. Sedimenteringshastigheden afhænger af molekylets densitet, størrelse og form. For lignende former og tætheder skaleres sedimenteringshastigheden som kvadratroden af molekylmassen. I sådanne tilfælde går molekylmassen som kvadratet af sedimenteringshastigheden, således at 23S og 16S underenheder af ribosomet har en molekylvægt med et forhold på omtrent (23/16)2 eller ca.2, som er tæt integreret med målinger på 0,9 og 0.5 MDa henholdsvis (BNID 110972, 110967). I klinikken bruges sedimentationshastigheden af erythrocytter (røde blodlegemer) rutinemæssigt til at måle betændelse. Satser meget højere end 10 mm/time indikerer normalt tilstedeværelsen af pro-sedimenteringsfaktoren fibrinogen, der er en generel indikator for en inflammatorisk tilstand.
det er velkendt, at vand er den mest rigelige molekylære fraktion af celler, men hvor rigeligt nøjagtigt? Hvis vi undersøger væv fra multicellulære organismer, er det en simpel opgave at måle vævets masse før og efter tørring at finde vandindholdet. Men hvordan kan man udføre sådanne målinger for celler? Når vi vejer en masse celler før og efter tørring, hvordan måler vi kun cellerne uden vand omkring dem? Selv efter centrifugering er der vand tilbage i cellepelleten, hvilket resulterer i tvetydighed omkring selve tørmassen.
endnu en gang kommer radio-isotopisk mærkning til undsætning (Cayley et al 1991). Først måles mærket vand (ved hjælp af tritium, 3H) i en cellepellet. Dette angiver summen af vand i og uden for cellerne. Derefter måler en anden opløselig forbindelse, der er mærket, men som ikke kan komme ind i cellen, såsom 14C-inulin eller 3H-PEG, vandmængden uden for cellerne i en centrifugeret pellet (For eksempel i E. coli omkring 25-35% af pelletsvolumenet (BNID)). Forskellen angiver vandindholdet i cellerne. Sådanne metoder fører til typiske værdier fra 60-65 masseprocent for spirende gær og røde blodlegemer til 70% for E. coli og amoeba D. discoideum og op til 80% for rotte muskel-og svinehjertevæv (BNID 105938, 103689). Da tørstofbidraget domineres af bestanddele med densitet kur 1.3 (dvs.proteiner), fører dette til den karakteristiske samlede tæthed på kur 1.1 (BNID 103875, 106439, 101502). Volumen kan udledes til at være omkring 300-500 mg/ml (BNID 108131, 108135, 108136), men under langsomme vækstværdier kan være højere. Lave tætheder er almindelige i tørre frø og undervandsplanter, der har flydende dele med tætheder på mindre end det omgivende vand, hvilket giver dem mulighed for at flyde. Densiteter, der er lavere end vandets, kan opnås enten ved gas som i tang og nogle bakterier eller ved anvendelse af opløste stoffer med molekylvægt (mv) lavere end de omgivende medier (f.eks. udskiftning af natrium med MVM-23 med ammonium med MVM-18) som i de små krebsdyr, antarktiske copepoder.60% vand (40% i celler, 15% i interstitiel væske og 5% i blodplasma, BNID 110743), og de fleste af os har oplevet de stærke virkninger af dehydrering efter at have glemt at drikke bare et par glas. Alligevel kan nogle celler være overraskende robuste over for et fald i deres vandindhold. For eksempel blev hastigheden af glukosemetabolismen i rotteleverceller ikke påvirket af 25% tab af intracellulært vand. Et sådant fald kan opnås ved osmose – ændring af toniciteten (opløst koncentration) af den ekstracellulære væske. Et ekstremt eksempel er den bemærkelsesværdige saltlage rejer. At leve i miljøer, hvor den udvendige saltkoncentration kan svinge og være meget høj, viste sig at have cyster, der kan udtørres til kun 2% vand uden irreversibel skade og ved hydratiseringsniveauer på højere end 37% (kun ca.halvdelen af dens fuldt hydratiserede tilstand) deres fysiologi opfører sig som normalt. Denne robusthed i lyset af vandtab kan være relateret til en sondring, der undertiden foretages mellem to former for vand i celleindretningen. Normalt “bulkvand”, som er mere dispensabelt og” bundet vand”, som er forbundet med de cellulære komponenter og tjener som et opløsningsmiddel, der er afgørende for korrekt funktion.





