introduktion
cytotoksiske celler er integreret i kampen mod virusinficerede celler og kræftceller. Disse celler dræber gennem tre forskellige veje, frigivelsen af lytiske granuler, Fas-receptor–ligand-vej eller TRAIL-TRAIL-receptorvejen. Med henblik på dette papir vil vi fokusere på degranulering. Når en cytotoksisk celle møder en målcelle, klæber den tæt på den og danner immunsynapsen. De lytiske granuler polariseres derefter mod den immunologiske synaps og frigives fra den cytotoksiske celle rettet mod målet (1). Disse granulater indeholder forskellige cytotoksiske mediatorer, såsom perforin og gransymer. Frigivet perforin kan danne forbigående porer i målcellemembranen, der tillader gransymer at komme ind i målcellen. Indtræden medieres sandsynligvis også af perforinoligomerer, der danner ufuldstændige porer (buer) (2), og det er også blevet foreslået, at gransymer og perforin kan optages i målcellerne gennem den endosomale vej (3, 4). Dataene bag disse foreslåede mekanismer er for nylig blevet diskuteret i detaljer (5). Caspasevejen aktiveres, hvilket resulterer i apoptose (6, 7). Membranen af disse cytotoksiske granulater indeholder lysosomal-associeret membran glycoprotein-1 (LAMP1), også kendt som CD107a (8). Den luminale del af rotte CD107a udsættes kortvarigt for den ekstracellulære side af cellemembranen efter degranulering, før den igen internaliseres. Derfor indikerer cd107a-farvning, at der er sket en degranuleringshændelse (9). Mens rollen for CD107a stadig bestemmes, har siRNA-undersøgelser mod CD107a vist, at det er vigtigt for perforinhandel inden i vesiklerne, da levering af perforin til lytiske granuler hæmmes i fravær af CD107a (10). CD107a har også vist sig at have en rolle i at beskytte cytotoksiske celler mod død ved at binde til perforin og forhindre indsættelse i cellemembranen (11).
der er to hovedtyper af cytotoksiske lymfocytter, naturlige dræberceller (NK) og CD8 T-celler. Begge celletyper dræber gennem frigivelse af lytiske granulater, Fas-receptoren/Fas-ligandvejen og TRAIL/TRAIL-receptorvejen, men den stimulus, der er nødvendig for at aktivere disse to cellegrupper, er forskellig. T-celler genkender antigen præsenteret af MHC klasse i-molekyler gennem deres aktiverende t-cellereceptor (TCR), mens NK-celler genkender målcelleantigener, selvom forskellige hæmmende og aktiverende receptorer. Hæmmende receptorer er vigtige for at forhindre NK-celler i at dræbe sunde celler, mens aktivering af receptorer inducerer NK-cellecytotoksicitet.
før identifikationen af CD107a som en markør for degranulering i NK-celler (12) var output til måling af den cytotoksiske evne målcellernes død. Påvisning af CD107a ved strømningscytometri tillod forskere at identificere de specifikke effektorceller med cytotoksisk evne. Siden opdagelsen er der gennemført en bred vifte af publikationer af data fra mus og humane undersøgelser, der viser fordelen ved at anvende et anti-CD107a antistof. Rotten er en værdifuld immunologisk dyremodel til undersøgelse af sygdomme som leukæmi og graft vs. værtssygdom (13), men funktionelle aflæsninger er blevet hæmmet af manglen på specifikke anti-rotte CD107a-antistoffer af høj kvalitet til strømningscytometri. Dette papir beskriver dannelsen af et antistof mod rotte CD107a og karakterisering af degranulationsresponset i rotte NK og CD8+ T-celler.
materialer og metoder
Dyr
armenske indavlede hamstere (Cytogen Research and Development Inc., MA, USA) blev anbragt i Institut for komparativ medicin på Rikshospitalet, Oslo Universitetshospital, efter aftale med institutionelle retningslinjer. Rottestammerne PVG-RT1U, PVG-RT7b, PVG-RT1N og PVG-R23 blev anvendt ombytteligt og vedligeholdt i mere end 20 generationer og anbragt i overensstemmelse med retningslinjer fastsat af Forsøgsdyrbestyrelsen under Norges landbrugsministerium og af den europæiske konvention til beskyttelse af hvirveldyr, der anvendes til eksperimentelle og andre videnskabelige formål. Rotter blev brugt i alderen 8-12 uger. Laboratoriedyrfaciliteterne underkastes et rutinemæssigt sundhedsovervågningsprogram og testes for infektiøse organismer i henhold til en ændring af Federation of European Laboratory Animal Science Association anbefalinger. Dyreforsøg blev reguleret gennem laboratorieforskrifter, som er fremsat af Dyrevelfærdsloven, hvor Norge følger EU-laboratorieretningen og Den Europæiske laboratoriekonvention.
Abs og reagenser
antistoffer mod NKp46 , NKR-P1A 3.2.3-PB eller ukonjugeret (kun bindende NKR-P1A, men ikke NKR-P1B, i PVG-stammen), CD8 (OKS8-biotin), CD2 (OKS34, ukonjugeret), TCR (R73-Aleksa647), mus IgD b-allotype (TIB96-ukonjugeret, brugt som mus IgG-isotype) og CD45.2 (His41-FITC, brugt som mus IgG-isotype) blev lavet i vores laboratorium og konjugeret i henhold til standardprotokoller. Antistoffer mod CD3 (IF4, ukonjugeret) og dens isotype mus IgM (MM-30, ukonjugeret) og armensk Hamster IgG isotype kontrol (HTK88-FITC) blev købt fra Biolegend (San Diego, CA, USA). Kommercielle anti-CD107a antistoffer blev købt fra AbCam (Cambridge, UK) (H4A3-FITC), eBioscience (San Diego, CA, USA) (ID48-PerCP-eFluor) og Lifespan (Seattle, V, USA) (LS-C8580-ukonjugeret). LS-C8580 blev konjugeret med Aleksa488 NHS ester (Sigma-Aldrich, St. Louis, MO, USA) til brug i funktionelle analyser. Anti-FLAG antistof (M2, ukonjugeret) og anti-mus IgG (goat polyklonal-FITC) blev købt fra Sigma-Aldrich (St. Louis, MO, USA). IL – 2 blev opnået fra en dialyseret cellekultur supernatant af en kinesisk hamster ovarie (CHO) cellelinie stabilt transficeret med en rotte IL-2 ekspressionskonstruktion. Peridinin Chlorophyll-et protein (PerCP) konjugeret streptavidin, FITC hamster IgG polyklonal isotype kontrol, FITC mus IgG1 isotype kontrol (MOPC-FITC) og GolgiStop blev købt fra BD biosciences (Franklin Lakes, NJ, USA). Goat anti-Armensk hamster (polyklonal-FITC) blev købt fra Jackson Immunoresearch (Vestlund, PA, USA). Supernatanter fra hybridomer OKS41, CD172a (SIRPa), R73 (Anti-rat TCRA-kar), OKS19 (anti-CD5), OKS12 (Anti-Igk-kæde) og OKS33 (anti-CD45RA) blev fremstillet internt. Kontrol hamster serum blev afledt af ikke-immuniserede armenske hamstere.
kloning af rotte CD107a
rotte CD107a blev PCR-amplificeret fra cDNA genereret fra PVG-rottesplenocytter og subkloneret til en PMK-ekspressionsvektor indeholdende et puromycinresistensgen (en generøs gave fra Dr. Michael R. D.) (14). CD107 primere blev designet baseret på en rotte CD107a (LAMP1) cDNA sekvens (GenBank: NM_012857). Fremad primer: 5′ – GCCCCAGCACTGTTCGAGGT-3′; omvendt primer: 5′-GTTGTTACCGTCCTTACACACT-3′. Et anionisk trypsin-1-lederpeptid (MSALLILALVGAAVA) blev anvendt i ekspressionsvektoren, og den originale CD107 transmembranregion blev erstattet af et CD8 transmembranfragment for at lette høj overfladeekspression. Et FLAG-tag (DYKDDDDK) blev ligeret til N-terminalen af CD107-proteinet for at gøre overfladeekspression detekterbar. Alle indsatte sekvenser og åben læseramme i den endelige kimære plasmidkonstruktion blev undersøgt og bekræftet ved Sanger DNA-sekventering.
transfektion.36 celler med PMK-CD107a-Plasmid
293t-celler blev podet i en 6-brønds cellekulturplade med 4 ml RPMI 1640-medium, transficeret med 7,5 liter FuGENE6-reagens (Roche, producentens protokol) og inkuberet ved 37 liter C med 5% CO2. FuGENE6-reagenset blev forfortyndet med Opti-MEM (Gibco) og blandet med 1,5 PMH-CD107a-plasmid og 1 PML-ECO-gnaverspecifik retroviral emballageplasmid (Addgen #12371). Fireogtyve timer efter transfektion blev supernatanten descanteret og erstattet med rpmi1640 medium med 2% FBS og overført til 32 liter C til retroviral produktion. Otteogfyrre timer senere blev supernatanten høstet og filtreret med et 0,2-liter Filtropur s-filter (Sarstedt) og gemt ved -80 liter C til retroviral transduktion.
den 105.36 celler blev podet pr. brønd i en 24-brønds cellekulturplade (Corning) og dyrket med frisk RPMI1640 medium med 10% FBS natten over. Supernatanten blev fjernet, og RPMI1640 indeholdende 10% FBS, 16 liter polybrene (til en endelig koncentration 8 liter/ml) og 1,5 ml retroviral supernatant blev tilsat og centrifugeret ved 32 liter C ved 2400 rpm i 2 timer. Cellerne blev derefter inkuberet ved 32 kg C i 1 time, hvorefter supernatanten blev fjernet og erstattet med frisk rpmi1640-medium med 10% FBS og dyrket i 3 dage ved 37 kg C med 5% CO2 (på dag 2 kunne komplet medium med 1 ng/ml puromycin anvendes). Cd107a – flag transfektanter blev undersøgt for overfladeekspression af FLAG-tag og blev derefter anvendt til antistofimmunisering eller antistofscreening.
generering af CD107a, der udtrykker Transfektanter
den kimære rotte CD107a plasmid blev transficeret til CHO-celler. Kort sagt blev CHO-celler dyrket i komplet rpmi1640 medium (cRPMI; RPMI1640 medium med 10% FBS, 1 mm Na pyruvat, 50 liter 2-mercaptoethanol), indtil de nåede 30% sammenløb. Plasmidet på 2,5 liter blev blandet med 7,5 liter fugen 6-reagens (Roche) og tilsat dråbevis på cellerne. To dage efter blev CHO-cellerne løsnet med rpmi1640-medium suppleret med 2 mm EDTA og blev podet ud i 96-brønds fladbundede cellekulturplader (25 celler/brønd) med selektionsmedium (cRPMI suppleret med 20 liter/ml puromycin) til kloning af stabile transfektanter. Efter 10-12 dages kultur blev voksne kloner screenet med anti-FLAG antistof (M2). En af klonerne, der udtrykker det højeste overfladeniveau af FLAG og CD107a, blev brugt til immuniseringer.
immunisering og cellefusion
de 3 – til 10-uger gamle mandlige armenske indavlede hamstere blev immuniseret ved intraperitoneale injektioner (i.p.) med 2 liter 106 CHO.CD107a-FLAGCELLER en gang om ugen i 3 uger. Et boost med 4 kar 106 stabilt transficerede celler.CD107a-FLAG blev givet i. p. 32 dage efter første immunisering, og sera blev analyseret for overfladefarvning af både CHO.CD107a-FLAG og BC.CD107a-flag transfektanter. To af de tre dyr var positive, og 3 dage efter boosting blev miltceller høstet og samlet fra de to dyr, hvoraf den ene havde splenomegali. Cirka 2,0-108-miltceller og 1,4-108 NS0-myelomceller blev vasket tre gange i dmem med additiver (1 mm natriumpyruvat, 0,05 mM 2-mercaptoethanol og antibiotikum/antimykotisk) og centrifugeret ved 90 g i 10 minutter. Ved at holde alt på 37 liter C fra dette punkt fremad blev pelleten opløst ved at banke på røret og foropvarmet polyethylenglycol 1500 (Roche) blev tilsat dråbe for dråbe under forsigtigt omrøring i 1 min. Tre milliliter DMEM med additiver blev gradvist tilsat til de næste 3 minutter efterbehandling med en ekstra 7 ml før centrifugeret ved 500 g. pelleten blev vasket ved omhyggelig skylning (ingen resuspension) med DMEM med additiver og 20% FBS (DMEM-20) og dyrket natten over. Celler blev høstet den følgende dag, og der blev tilsat 100 ml DMEM-20 med 2 liter hypoksantin–aminopterin–thymidin (SIGMA) og 10% hybridoma-kloningstilskud (HCS) (PAA). Cellesuspensionen blev overført til 96-brøndsplader. Efter 12 dage blev supernatanter fra voksende kloner testet ved strømningscytometri til farvning af overfladeantigener, der var til stede på CD107a-FLAG og CHO.CD107a-FLAG, men ikke på BC.36 celler transficeret med irrelevante flag-mærkede antigener som negative kontroller. 9 ud af 12 positive kloner, der producerede specifikke antistoffer, blev yderligere subkloneret under anvendelse af DMEM-20 suppleret med hypoksantin-thymidin og HCS. Kun en klon (SIM1) producerede stadig antistoffer efter subkloning, og dette blev yderligere subklonet endnu en gang. CD107a-specifikke hamster – IgG-antistoffer blev påvist af FITC anti-Armensk hamster IgG (Jackson Immunoresearch). Anti-CD107a fra SIM1 hybridoma blev oprenset af HiTrap Protein g HP (GE Healthcare, Life Sciences) og FITC-konjugeret i henhold til standardprocedurer eller Aleksa488-konjugeret i henhold til producentens protokol.
generering af effektorceller
enkeltcellesuspensioner blev fremstillet ud fra milten. Lymfocytter blev isoleret ved hjælp af en Lymfoprep-gradient og derefter kørt over en nylonuldsøjle for at fjerne B-celler og makrofager. Til dannelse af IL-2-aktiverede NK-celler (LAK) blev de resterende celler dyrket natten over i IL-2. Den følgende dag blev ikke-klæbende celler fjernet ved vask med PBS, og de vedhængende NK-celler blev opretholdt i RPMI suppleret med IL-2, 10% varmeinaktiveret FBS, 1% Streptomycin/Penicillin, 1 mm natriumpyruvat og 50 rpm 2-mercaptoethanol. Celler blev dyrket i 8-10 dage. Til generering af berigede NK-celler eller sorterede T-og NK-celler blev celler beriget ved negativ selektion efter nylonuldstrinnet. Til berigelse af NK-celler blev Pan-mus IgG-Dynabeads (Invitrogen Dynal) overtrukket med antistoffer mod makrofager (OKS41), T-celler (R73 og OKS19) og B-celler (OKS12 og OKS33). Til berigelse af T-celler blev Pan-mus IgG-Dynabeads farvet med antistoffer mod makrofager (OKS41) og B-celler (OKS12 og OKS33). Celler blev beriget med to trin med negativ selektion med farvede perler i 30 minutter ved 4 liter C. Berigede NK-celler havde en renhed på ca. 50-60% og blev anvendt til degranuleringsundersøgelser. Berigede T-celler (79-85% renhed) blev yderligere sorteret for TCR+ celler ved hjælp af en FACS Aria (BD Biosciences).
Degranulationsassays
for at måle degranulationsresponset ved farvning med anti-rotte CD107a (SIM1) under målcellestimulering blev NK-effektorer og YAC-målceller inkuberet i et forhold på 1 til 1 på 3-celle 105-celle / brønd (medmindre andet er angivet) i medier indeholdende SIM1 mAb, de andre kommercielt tilgængelige anti-CD107a-antistoffer eller isotype-kontrol. For at måle degranulationsresponset på antistofstimulering fra NK-celler brugte vi flade bund 96-brøndsplader belagt med varierende koncentrationer af anti-NKp46 (Ven23), anti-NKR-P1A (3.2.3) og en mus IgG1 isotype kontrol (TIB96). Den følgende dag blev plader vasket med PBS og blokeret med cRPMI, før tilsætning af 3 liter 105 berigede NK-celler suspenderet i cRPMI indeholdende SIM1 blev tilsat pr. For at måle degranulering fra T-celler blev de sorteret og dyrket i cRPMI med IL-2 i 2-3 dage. De 96-brønds flade bundplader blev belagt natten over med antistoffer mod CD3 (IF4), CD2 (OKS34) eller en IgM-isotypekontrol (MM-30). Omkring 3 liter 105 T-celler blev tilsat pr.brønd i cRPMI indeholdende SIM1. Alle analyser blev inkuberet i 4 timer. Golgistop blev tilsat i de sidste 3 h inkubation for at forhindre nedbrydning af internaliseret CD107a. celler blev derefter vasket og farvet med antistoffer mod de passende overfladereceptorer og analyseret under anvendelse af FACS Canto eller LSR II (BD Biosciences).
Kromfrigivelsesassay
YAC-1 målceller (5 til 106 celler / ml cRPMI) tilsat 3.7 Mbk51cr blev inkuberet ved 37 liter C i 1 time under omrøring hvert 15.minut. Celler blev derefter vasket tre gange med PBS med 2% FBS og resuspenderet til 1 liter 105 celler/ml i cRPMI. LAK-effektorceller og målceller blev belagt ved de specificerede forhold i et endeligt volumen på 200 liter. Celler blev centrifugeret og inkuberet i 4 timer ved 37 liter C. specifik frigivelse af 51cr blev målt ved hjælp af Cobra auto-gamma (Packard).
resultater
for at skabe et antistof mod CD107a lavede vi en ekspressionsvektor indeholdende den ekstracellulære membranregion af rotte CD107a, transmembranregionen af rotte CD8 og en 3′-terminal FLAG-tag for at detektere overfladeekspression (figur 1a). Vektoren blev overført til CHO-celler og BV.36 t cellelinie og screenet for cd107a-ekspression ved anvendelse af et anti-FLAG-antistof (M2) (figur 1b). CD107a stabilt transficerede CHO-celler blev injiceret i Armenske indavlede hamstere en gang om ugen i 3 uger med et sidste boost af CD107a stabilt transficerede cho-celler 3 dage før fusion med NS0 myelomcellelinjen. Supernatanter fra de forskellige kloner blev testet for specificitet mod CD107a-FLAG, men ikke irrelevant FLAG-mærket.36 transfektanter. En klon, SIM1, viste sig at binde specifikt til CD107a, der udtrykker transfektant, men ikke til FLAG transfekteret kontrol (figur 1C).

Figur 1. Dannelse af et anti-rotte CD107a monoklonalt antistof (SIM1). (A) skematisk vektorkort over ekspressionsvektoren med leader peptid, FLAG-tag, CD107a insert og transmembran domæne af CD8. B) ovarie af kinesisk hamster, der er stabilt transficeret.36 celler blev testet for celleoverfladeekspression af FLAG-mærket CD107a ved anvendelse af et anti-FLAG-antistof (M2) (skraverede histogrammer). Negativ kontrol er sekundært antistof alene (gennemsigtigt histogram). C) celler transficeret med CD107a-FLAG eller irrelevant antigen (NKR-P1F-FLAG) blev farvet med hamsterkontrolserum, SIM1 supernatant eller et anti-FLAG-antistof (M2).
klonen SIM1 blev yderligere testet i funktionelle analyser parallelt med to kommercielt tilgængelige CD107a-antistoffer, som potentielt kunne krydsreagere med rotte CD107a i strømningscytometri. De testede antistofkloner var H4A3 fra AbCam (som krydser reagerer med mennesker, rotter, mus og primater i strømningscytometri) og antistofklonen LS-C8580 fra LifeSpan BioSciences (som krydser reagerer med CD107a fra mus, mennesker og rotter i immunhistokemi og vestlige blots ifølge producentens hjemmeside). Vores SIM1-antistofklon identificerede degranulerende celler i nærvær af målceller og viste lidt baggrundsfarvning i fravær af mål (øverste panel figur 2a). Klon H4A3 farvede den højeste procentdel af NK-celler efter målcellestimulering (midtpanel). Der var imidlertid også et højt niveau af baggrundsfarvning i fravær af målceller, hvilket indikerer uspecifik binding. Meget lave niveauer af degranulation, hvis nogen, blev målt ved LS-C8580 mAb klon (nederste panel). Specificiteten af disse antistoffer blev bekræftet ved positiv farvning af BS.CD107a – flag transfektant, men ikke BS.NKR-P1F-FLAG kontrol (figur 2b). Antistofklonen H4A3, som har vist sig at binde til humant CD107a (16), plettede ikke rotte CD107a-transficerede celler, hvilket indikerer, at der ikke er nogen krydsreaktion med rotte CD107a. anti-mus CD107a-klonen ID48 undlod også at plette rotte CD107a-transfektanten. Ukonjugeret LS-C8580 viste på den anden side specifik farvning af cd107a transficerede celler (data ikke vist). LS-C8580-klonen er dog kun tilgængelig som ukonjugeret antistof, som ikke er egnet til degranuleringsundersøgelser. Gentagne forsøg i vores laboratorium på at konjugere LS-C8580 til Aleksa488 har desværre ikke givet nogen stærke farvningskonjugater, selvom den lille prøvestørrelse og koncentration af LS-C8580 kan være årsagen til den dårlige konjugation. Konjugeret LS-C8580 viser reduceret, men specifik farvning af cd107a transficerede celler (figur 2b), men som vist i figur 2a var vi ikke i stand til at detektere degranulerende celler under funktionelle analyser med dette konjugat. Afslutningsvis pletter SIM1 mAb specifikt degranulerende rotte NK-celler efter stimulering med målceller.

figur 2. SIM1 måler degranulation fra naturlige killer (NK) og CD8 T-celler. (A) procent degranulerende celler blev målt ved anvendelse af anti-CD107a antistoffer SIM1, H4A3 og LS-C8580, med eller uden YAC-1 målceller som en stimulus. Et repræsentativt eksperiment på fire er vist (B). Farvning af cellelinjen CD107a-FLAG med SIM1 -, H4A3 -, LS-C8580-eller ID48-antistofkloner. SV.36 celler transficeret med irrelevant flag-mærket antigen.NKR-P1G-FLAG) blev inkluderet som en negativ kontrol, (C) berigede NK-celler blev stimuleret med pladebundet anti-NKp46, anti-NKR-P1A eller mus IgG1 som isotype-kontrol, og SIM1 blev brugt til at måle procentvise degranulerende celler. Nkp46 + (Ven23) eller NKR-P1Abright (3.2.3) celler blev lukket på. D) TCR + -celler blev sorteret (renhed 99%) og dyrket i IL-2 i 2-3 dage. Cellerne blev derefter stimuleret med pladebundet anti-CD3 og anti-CD2 eller mus IgM isotype kontrol for anti-CD3. Det nederste panel viser stimulering med anti-CD3 og anti-CD2 og farvning med en SIM1 isotype kontrol (FITC hamster IgG polyklonal). T-celler blev sorteret ved hjælp af R73-Aleksa647 og 3.2.3-PB antistoffer, gating på R73+ / 3.2.3-celler. De viste Data er fra et repræsentativt eksperiment med tre separate uafhængige eksperimenter.
direkte stimulering af aktivering af NK-receptorer gennem pladebundne antistoffer er en anden potent metode til at inducere degranulering. For at teste SIM1-klonen i dette funktionelle assay inkuberede vi berigede NK-celler på plader belagt med antistoffer mod de aktiverende receptorer NKp46 og NKR-P1A (figur 2C). Som en negativ kontrol blev plader belagt med mus IgG1 isotype kontrol. Farvning med SIM1-antistoffet identificerede 25,5 eller 44% degranulerende celler efter NK-cellestimulering i plader overtrukket med henholdsvis 5 liter/ml anti-NKp46 eller anti-NKR-P1A. Procentdelen af degranulerende celler steg yderligere, når pladerne blev overtrukket med en højere koncentration af stimulerende antistoffer (10 liter/ml). Ingen degranulering blev induceret i brønde belagt med mus IgG1 isotype kontrol.
vi så tydeligt degranulering i NK-celler stimuleret med enten målceller eller med antistoffer mod aktiveringsreceptorer ved hjælp af vores SIM1-antistof. Vi ønskede også at bekræfte dette i cytotoksiske T-celler. T-celler blev sorteret fra miltceller og dyrket i IL-2 i 2-3 dage. T-cellerne blev derefter stimuleret med pladebundet anti-CD3 og anti-CD2 (figur 2D). Degranulering blev målt fra dyrkede CD8 + T-celler, når de blev stimuleret med anti-CD3 og anti-CD2 på både dag 2 og 3. Ingen degranulering blev målt fra ikke-cytotoksiske CD4 T-celler eller efter stimulering med isotype-kontrolantistof, hvilket yderligere demonstrerede specificiteten af vores SIM1-antistof.
Lymfokinaktiverede dræberceller (LAK) dannes ved dyrkning af NK-celler i IL-2 i 7-10 dage og bruges almindeligvis som meget potente effektorceller i chrom-frigivelsesassays for at studere cytotoksicitet og bør derfor være i stand til at generere høje niveauer af degranulering. For at måle degranulering fra LAK-celler brugte vi oprindeligt en 1:1 forhold mellem effektor og mål, men fandt uventet lave niveauer af degranulering (data ikke vist). Ved at gøre en titrering for at finde optimale effektor til målforhold så vi stigende niveauer af degranulering kunne opnås, når effektor til målforhold var under 1 (figur 3a). Det optimale forhold for degranulationsanalyser er derfor i modsætning til cytotoksicitetsanalyser, hvor niveauet af cytotoksicitet stiger med højere effektor: målforhold (figur 3b).
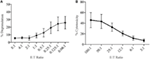
figur 3. Lav effektor:målforhold er vigtige for at sikre tilstrækkelig følsomhed i degranulationsanalyser med rotte NK-celler. (A) degranulering af LAK-celler dyrket 8-10 dage i IL-2 mod YAC-1-mål ved forskellige effektor:målforhold. (B) cytotoksicitet af IL-2-dyrket LAK mod YAC-1-målceller blev bekræftet med chrom-frigivelsesanalysen afsluttet på dag 8-10. Alle grafer er kumulative af tre eller flere separate eksperimenter med søjler, der viser SD.
Diskussion
i den indledende test af SIM1 og de forskellige kommercielle CD107a antistoffer i degranulationsassays i rotten valgte vi et lille udvalg af effektor til målforhold med en skævhed mod flere effektorceller end mål baseret på nuværende litteratur (12, 16, 17). Effektor til målcelleforhold kan variere fra papir til papir, men tidligere undersøgelser, der titrerede effektor til målforhold, har vist, at optimal degranulering fra mus NK-celler toppede ved 4,5: 1 forhold med YAC – 1 målceller (18) og humane NK-celler dræbte k562-celler bedst i et forhold på 5:1 eller 10:1 (12). Imidlertid, når vi bruger et større udvalg af effektor til målforhold, vi viser, at degranulering ved hjælp af rotte LAK-celler blev mere effektivt induceret, når der blev brugt fire eller flere mål pr.effektorcelle. Denne forskel i optimal effektor / mål-forhold mellem rotten og andre arter kan skyldes den anvendte type målceller, da titreringer af effektor / mål-forhold mellem mennesker og mus i ovennævnte undersøgelser anvendte målceller, der stammede fra den samme art. Effektorcellerne kan være mere følsomme over for målceller fra samme art og har derfor brug for færre målceller for at blive aktiveret. YAC-1-cellelinjen, der anvendes i vores undersøgelse, er en mus T-celle lymfom, som har været standarden i mange år for at stimulere cytotoksicitet fra rotte NK-celler. Vi kan ikke udelukke, at brug af en rottemålcelle ville resultere i stærkere stimulering af NK-cellerne, og efterfølgende kan færre målceller være nødvendige for at inducere degranulering.
det fremgår også af denne undersøgelse, at effektor til målforhold anvendt til cytotoksicitetsanalyser ikke korrelerer godt med de forhold, der er nødvendige for at måle optimal degranulationsrespons i effektorcellerne. Dette er ikke overraskende, da aflæsningen for disse to analyser er forskellige, med cytotoksicitet, der måler målcelledød, og degranulering, der måler NK-responsen på mål.
afslutningsvis har vi hævet et antistof mod rotte CD107a (SIM1) og karakteriseret dets evne til at detektere degranulering i cytotoksiske lymfocytter i rotten. Vi har vist, at SIM1 er specifik for degranulerende celler, og gennem optimering af degranulationsprotokollen har vi bestemt, at brug af effektor:målcelleforhold lavere end 1:4 sikrer optimal stimulering af LAK-celler. Udviklingen af anti-rotte CD107a (SIM1) muliggør bedre analyse og karakterisering af de cytotoksiske reaktioner af rottelymfocytter og vil være et værdifuldt værktøj i rottens mange sygdomsmodeller.
Etikerklæring
undersøgelsen er godkendt af national Animal Research Authority (FDU), Norge (tilladelsesnummer: ID-1698).
Forfatterbidrag
AS har været ansvarlig for ekspressionsanalyse, funktionelle analyser og skrivning af manuskriptet. K-DD har udført cDNA-kloning og generering af transfektanter. JTV har været involveret i projektplanlægning og supervision samt i håndskriftets skrivning. LK har været ansvarlig for immuniseringer, hybridomateknologien, skrivning af manuskriptet og projektovervågning.
interessekonflikt Erklæring
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
forfatterne takker Ulla Heggelund og Stine Martinsen for teknisk assistance i laboratoriet og personalet på dyrefaciliteten ved Institut for komparativ medicin på Rikshospitalet, Oslo Universitetshospital for hjælp til vaccinationer. Tak til Marit Inngjerdingen for videnskabelige diskussioner.
Funding
forskningen blev finansieret af universitetet i Oslo, det sydøstlige Norge Regional Health (2009104) og Legatet til Henrik Homans Minde.
1. Orange JS. Dannelse og funktion af den lytiske NK-celle immunologiske synaps. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038/nri2381
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
2. Metkar SS, Marchioretto M, Antonini V, Lunelli L, Vang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, valmue M, Martinvalet D, et al. I de fleste tilfælde er det ikke muligt at få en læge til at bestemme, om en person er i stand til at bestemme, om han eller hun er i stand til at udføre en undersøgelse. Nat Immunol (2011) 12(8):770-7. doi: 10.1038 / ni.2050
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
5. Voskoboinik I, JC, Trapani JA. Funktion, dysfunktion og human patologi. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KS, Martens A, Benestad HB, Vaage JT, et al. En anden profylaktisk MHC-uoverensstemmende knoglemarvstransplantation beskytter mod rotte akut myeloid leukæmi (BNML) uden dødelig graft-versus-host sygdom. Transplantation (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
14. Jeg er en af dem, der er interesseret i at finde ud af, hvad der er bedst. Anvendelser af retrovirus-medieret ekspressionskloning. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Reduceret degranulering af NK-celler hos patienter med hyppigt tilbagevendende herpes. Clin Vaccine Immunol (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, træ SM, BJ Orrkstrr Orrm NK, lang EO, et al. Funktionel analyse af humane NK-celler ved strømningscytometri. Metoder Mol Biol (2010) 612:335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
