introduktion af cellecyklusinhibitor
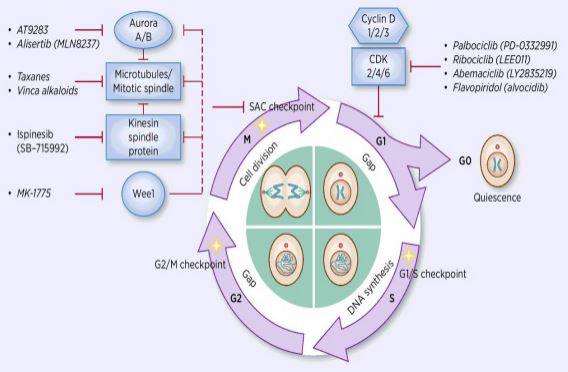
processen med cellecyklusregulering er aktivering eller inaktivering af forskellige regulatoriske faktorer under overvågning af kontrolpunkter, hvorved processen med celle-DNA-replikation og opdeling i to datterceller initieres. Blandt mange cellecyklusregulatorer er cyclinafhængig kinase (CDK) kernen, og det er et netværkssystem, der regulerer cellecyklussen med cyclin og cyclinafhængige kinasehæmmere (CKI ‘ er). CDK ‘er er en klasse af serin/threonin kinaser, og i øjeblikket findes 13 arter, herunder CDK1~13, som spiller en rolle i cellecyklusregulering af CDK’ er og transkriptionel regulering af CDK ‘ er. Reguleringen af cellecyklussen er faktisk reguleringen af kontrolpunkter, hvor G1/s reguleringspunkter er de vigtigste. Når cellecyklussen stimuleres af eksterne signaler, såsom vækstfaktorer, binder den katalytiske underenhed CDK4/CDK6 sig til den regulerende underenheds Cyklind, og CDKs-resterne aktiveres ved phosphorylering/dephosphorylering. Efter aktivering af CDK ‘ er phosphoryleres RB-proteinet. Rb-genet, også kendt som retinoblastomgenet, er det første klonede tumorundertrykkende gen, og dets evne til at danne et kompleks med transkriptionsfaktorer (såsom E2F) efter phosphorylering af proteinet går tabt. E2F spiller en vigtig rolle i cellecyklusregulering og inducerer ekspressionen af Cyclin og CDK2 og danner et Cyclin/CDK2-kompleks, som yderligere phosphorylerer Rb-protein og frigiver E2F fuldt ud. derefter kommer E2F ind i kernen for at aktivere en række cellecyklusser i S-fase. I den sene fase af DNA-replikation i S-fasen aktiveres CDK2 af cyclin, som inaktiverer transkriptionsfaktor E2F i tide og forhindrer apoptose forårsaget af vedvarende aktiveret E2F. Forskningsstatistikker viser, at mere end 90% af humane kræftformer har mutationer i beslægtede gener i CDK -, Cyclin -, CKI-og Rb-veje, hvor CDK og dens tilsvarende regulatoriske underenhed Cyclin er den hyppigst dysfunktionelle. Derudover fremmer udsving i cellecyklussen kemoterapiresistens og reducerer virkningerne af kemoterapi. Derfor er reguleringen af CDK/Cyclin-aktivitet, som gendanner normal cellecyklus, en af strategierne til behandling af tumorer.
Cellecyklusinhibitorer anvendes nu klinisk
lægemiddelforskere har fokuseret på at finde forskellige typer CDK-og Cyclininhibitorer som banebrydende anticancermedicin. I øjeblikket er CDK-hæmmere hovedsageligt opdelt i det endogene og det eksogene. Den største klasse af endogene småmolekylehæmmere er proteiner med lav molekylvægt, der klassificeres i to brede kategorier i henhold til forskelle i strukturelle funktioner, og en klasse kaldes den dobbelte specifikke familie INK4, inklusive p15, p16, p18, p19, som hæmmer proteinfamilien. Det inhiberende afhængige protein af CyclinD-associeret kinase binder til den tilsvarende frie CDK4 og blokerer derved bindingen af CDK4 til den tilsvarende cyclinD for at danne et katalytisk dimerkompleks. Den anden klasse kaldes Kip-familien, herunder P21,P27, P57. Denne proteinfamilie kan danne en trimer med et dimerisk kompleks sammensat af cyclin E/CDK2 og cyclinA/CDK1 ved at blokere det katalytisk aktive centrum af dimeren. Inhibering af disse endogene inhibitorer, når de kombineres med kinasekomplekset, regulerer specifikt dets aktivitet og derved præcist regulerer cellens transformation fra G1 til S-fase. Undersøgelser har vist, at forekomsten og udviklingen af flere tumorer er forbundet med nedsat ekspression af CDK ‘ er/cykliner eller nedsat ekspression af endogene hæmmere, såsom sletning af P16, som har forhold til udviklingen af melanom, lungekræft, brystkræft og kolorektal cancer. Sletning af P27-protein er almindelig ved brystkræft, prostatacancer, tyktarmskræft og gastrointestinal kræft. Derfor er sletning af endogen CDKs-hæmmer eller genmutation en vigtig reference til tumordiagnose. Endogene småmolekylehæmmere er også en klasse af vigtige ikke-kodende RNA ‘ er opdaget i de senere år. Målstedsregionerne binder til hinanden for hurtigt og effektivt at nedbryde mRNA eller hæmme translation af proteinet, kontrollere proteinet på et lavere eller optimalt niveau og kræve livsaktiviteter. Mere end 10 mikroRNA ‘ er er blevet opdaget involveret i cellecyklusregulering. Blandt dem er miR1-2 og miR3-4 målrettet CDK4, og cellecyklussen arresteres i G1-fasen, som hæmmer tumorcelleproliferation; miR-22 målretter CDK6-celler. Cyklussen er stillestående i G1-fasen, hvilket inducerer aldring i brystkræftceller. I forskellige biologiske processer regulerer disse miRNA ‘ er cellecyklusprogression ved at målrette mod E2F, CDK, Cyclin, P21, P27, DNA-polymerase alfa osv. at fremme eller blokere centrale regulatorer af cellecyklussen. Eksogene inhibitorer omfatter antisense nukleinsyrer, antistoffer, små interfererende RNA-interferens (siRNA) og små molekylforbindelser. Små molekylforbindelser er den vigtigste klasse af eksogene CDK-hæmmere. I de senere år, da forståelsen af krystalstruktur giver folk mulighed for at gennemføre molekylære simuleringsundersøgelser, er der gjort gennembrud i design og udvikling af meget effektive og selektive undersøgelser af kemiske hæmmere af CDK ‘ er. Det kan siges, at sådanne forbindelser har Nye medlemmer hver dag. På nuværende tidspunkt kan CDK-hæmmere med små molekyler opdeles i følgende 13 kategorier, Roscovitin og Olomouc, pyrimidiner (PD-033299), flavonoider (Flavopiridoler), thiasoler (SNS03), antracen og dets derivater (SU951), piperidon (Paulloner), piperidon, pyrasolopyridin (A703), pyrasiner ( At751), Butyrolacton-1 (butyrolacton-1), scorpionin (UCN-01) og andre to arter. Tretten små molekylehæmmere er kommet ind i kliniske forsøg. De er alle småmolekylære kemikalier af plane heterocykler, der konkurrerer med ATP om binding til ATP-bindingsstedet for CDK-kinase. In vivo-eksperimenter viste, at CYC202 har god lægemiddelresistens og god oral fysiologisk aktivitet og har åbenlyse hæmmende virkninger på faste tumorer hos nøgne mus podet af human tyktarmskræft og livmodercancerceller. I fase Ib-studier tog 10 patienter med kræft i æggestokkene CYC i mere end 20 måneder uden stigning i tumorer eller alvorlige behandlingsrelaterede bivirkninger, blandt hvilke en patients tumor er krympet med mere end 30%, og nogle patienter, der er blevet behandlet i mere end et år, har en stabil tilstand. Fase II kliniske undersøgelser har vist, at CYC202 alene har en lidt dårligere virkning og er effektiv i kombination med andre kemoterapeutiske lægemidler. Fase IIb kliniske forsøg med CYC202 i kombination med capecitabin til behandling af brystkræft kombineret med 2,2-difluorodeoksycytidin eller cisplatin til behandling af lungekræft og nasopharyngeal carcinoma er også i gang. Udviklingen og anvendelsen af RNA-interferenteknologi med små molekyler har gjort det muligt at studere genekspression af specifikke interventionsmålmolekyler, og mange forskere er begyndt at gribe ind i syntesen af CDK/Cyclin på det genetiske niveau. Limaet al. transficeret Cyclin-målrettet siRNA til Hep3B, HepG2, SNU449 (Cyclin overekspression) og HuH7 (Cyclin overekspression) og fandt, at Cyclinekspression blev reduceret med 90% i celler. DNA-syntese er signifikant reduceret, og celler gennemgår apoptose. Galimberti et al. transfekteret siRNA rettet mod Cyclin, CDK2 og CDK1 til mus lungecancerceller HOP-62, h-522 og H-23, henholdsvis og fandt, at Cyclin/CDK2 kan inducere apoptose og hæmme spredning af lungecancerceller. Nedsat CDK1-ekspression forårsaget af CDK1 siRNA-interferens forårsager kun cellefasestop og bremser celleproliferation; mens CDK1 og CDK2 siRNA-Co-interferens fører til et samtidig fald i cdk1-og CDK2-ekspression, hvilket forårsager modstand i cellecyklus s-og G2/M-faser. Stagnationen inducerede også apoptose af cellerne. Cao Yinfang og anden vellykket transfektion af CDK2/Cyclin siRNA rekombinant ekspressionsvektor i HepG2-celler viste, at CDK2-og Cyclin-mRNA-ekspression faldt signifikant, cellecyklus blev arresteret i S-fase, G1-faseceller steg signifikant, caspase-3-aktivitet forbedret, HepG2-celler gennemgik apoptose, og cellecyklusændringer var i overensstemmelse med nedsat proliferation af HepG2-cellersin vitro efter transfektion.
funktion af cellecyklusinhibitor
med uddybningen af forståelsen af den vigtige rolle cellecyklusregulering i tumordannelse og apoptose er cellecyklusregulering blevet undersøgt yderligere i tumorkemoterapiresistens. Cyclinafhængige kinaser (CDK ‘ er), som spiller en rolle i kørsel af cellemotoren under cellecyklussen, er ideelle mål for tumorterapi. De fleste af kræftcellerne har aktivering, overekspression af celledelingscyklusgenet (cdk) og defekter i CDKIs-funktion. CDK-hæmmeren udøver en pausehandling, der hæmmer cellecyklussen. I de senere år er CDKIs blevet et vigtigt højdepunkt i kræftbehandling, som hæmmer aktiviteten af CDK ‘ er i cellecyklussen. En række kliniske undersøgelser har også vist, at en enkelt applikation kan have moderate effekter. I kombination med traditionelle cytotoksiske kemoterapeutiske lægemidler kan CDKIs imidlertid signifikant forbedre antitumoreffekten af traditionelle kemoterapeutiske lægemidler. Derfor er forskning i kræfteffekterne af CDKIs-lægemidler og andre kemoterapeutiske lægemidler blevet et hot spot i den nuværende behandling af tumorresistens.
Reference
- Bendris N, Lemmers B, Blanchard J M. cellecyklus, cytoskelet dynamik og videre: de mange funktioner af cycliner og CDK-hæmmere. Cellecyklus. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt S G, et al. Målretning mod nukleare kinaser i kræft: udvikling af cellecykluskinasehæmmere. Farmakologi & terapeutiske midler. 2014, 142(2):258-269.
- Stone a, Sutherland R L, Musgrove E A. hæmmere af cellecykluskinaser: nylige fremskridt og fremtidsudsigter som kræftterapeutika. Crit Rev Oncog. 2012, 17(2):175-198.Mcarthur G. regulering af cellecyklus og melanom. Aktuelle Onkologiske Rapporter. 2016, 18(6):34.
- Malumbres M, Barbacid M. cellecyklus, CDKs og kræft: et skiftende paradigme. Natur Anmeldelser Kræft. 2009, 9(3):153-166.
