brugen af ensartet terminologi inden for og mellem undersøgelser er afgørende for at muliggøre en effektiv prøveproces. CDISC-standarder som CDASH, SDTM, SEND og ADaM standardiserer de strukturer, der skal bruges, når man indsamler og indsender data, men hvad med dataværdierne selv?
dette indlæg giver et overblik over CDISCS standardiserede kontrollerede terminologi, og hvordan den skal bruges til at indsamle og indsende data på en måde, der fremskynder forsøg og muliggør tværundersøgelsesanalyse.
Hvis du er interesseret i at læse mere om CDISC-standarder, kan du læse vores blogs alt hvad du behøver at vide om SDTM og introduktion til CDISC-standarder.
CDISC partner med nci til at definere standardiseret terminologi
CDISC har indgået et samarbejde med National Cancer Institute (nci) for at hjælpe med at bringe konsistens til terminologi i kliniske forsøg. Gennem dette samarbejde er der defineret et standard sæt terminologi og opdateres kvartalsvis, hvilket bringer semantisk konsistens på tværs af studier. Ved hjælp af denne terminologi vil det samme stykke information blive repræsenteret på samme måde på tværs af undersøgelser.
lad os tage et simpelt eksempel-køn:
- skal Mand være repræsenteret af “mand”, “mand”, “M”eller ” 1″?
- hvordan skal en person, der er interseksuel, registreres?
i gåede dage kan disse oplysninger være indsamlet på forskellige måder for hver undersøgelse. CDISC NCI-Terminologistandarden definerer nu, at de eneste tilladte muligheder er “F”, “M”, “U” og “udifferentieret”, og at en person, der er interseksuel, skal registreres som “udifferentieret”. Du kan se, hvordan dette meget enkle eksempel allerede gør det meget lettere at forstå de underliggende data og let segmentere for forskellige populationer på tværs af undersøgelser.
![]() Bemærk
Bemærk
FDA ‘ s datastandardkatalog mandater nu, at den standardiserede NCI-terminologi skal bruges til at for alle nye undersøgelser. Dette gør en anmelders liv meget lettere, da de ved, hvordan man fortolker dataene.

Hvordan defineres CDISC nci-terminologi?
tabellen nedenfor viser, hvordan Standardkønterminologien er defineret.
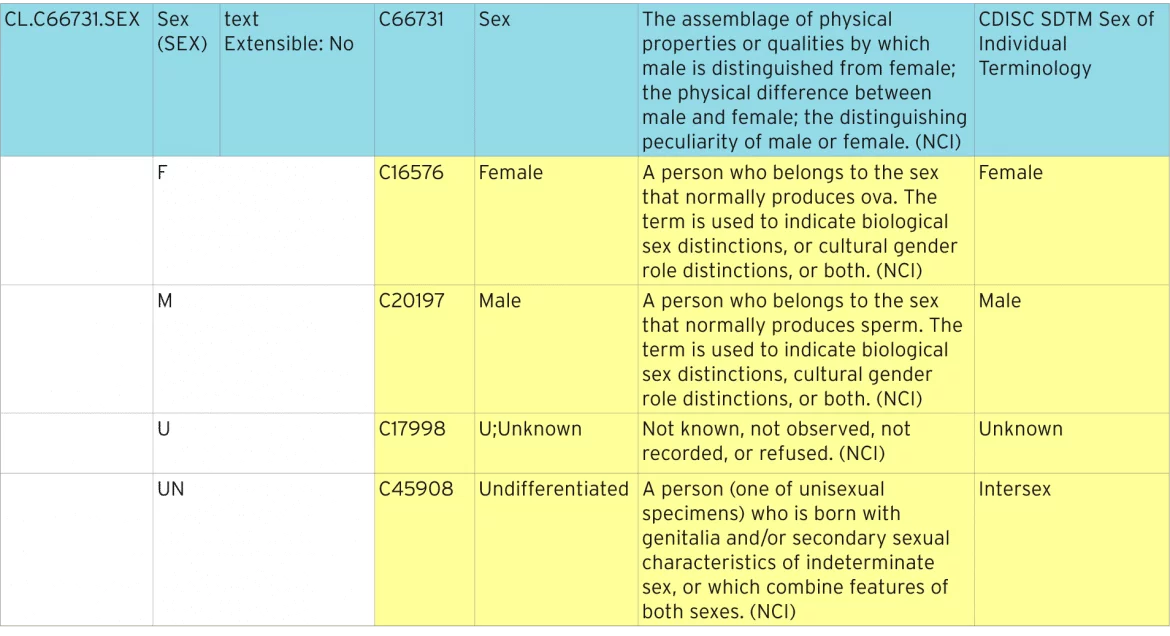
identificering af standardiseret terminologi
den blå linje repræsenterer kodelisten, der indeholder alle de enkelte koder. Kodelisten har en standard ” C-kode “af”C66731”. Hver af de enkelte koder har sin egen C-kode, f.eks. “C16576”. Disse C-koder bruges i ODM-metadata til at identificere kodelister som værende NCI-standardterminologi.
udvidelighed
denne kodeliste er defineret som ikke-udvidelig, hvilket betyder, at uanset hvor kodelisten bruges, må den ikke indeholde nogen udtryk, der ikke er angivet her. Kodelister, der kan udvides, kan tilføjes yderligere vilkår. Disse Yderligere vilkår skal beskrives som udvidede vilkår og kan ikke duplikeres eller synonymer af eksisterende vilkår.
Indsendelsesværdi, synonymer og foretrukket udtryk
indsendelsesværdien er det, der skal indsendes til en regulator. Den værdi, der faktisk vises på en formular, kan være anderledes, og måske et af synonymerne eller det foretrukne udtryk.
Fås i mange farver
NCI-Terminologistandarderne Fås i en række formater, der passer til forskellige behov, herunder ODM, HTML og RDF. Eksemplet ovenfor er taget fra versionen.
grupperet i undergrupper for CDASH, SDTM, ADaM og mere
for nemheds skyld er NCI-terminologien grupperet i et antal undergrupper.
- SDTM-terminologi indeholder udtryk til brug i en SDTM-baseret indsendelse
- CDASH-terminologi indeholder udtryk til brug i CDASH-baseret dataindsamling
- ADaM-terminologi indeholder udtryk til brug i ADaM-datasæt
- SEND terminologi indeholder udtryk til brug i en SEND-baseret indsendelse
- Protokolterminologi indeholder udtryk til brug med Protokolrepræsentationsmodellen (PRM) og det kliniske Forsøgsregister>
brug af CDISC NCI-terminologi i en undersøgelse
ved definition af indsendelsesmetadata i define-ml bruges kodelister til at definere faste lister af værdier for visse variabler. I henhold til gældende FDA-regulering skal disse kodelister være i overensstemmelse med den standardiserede CDISC NCI-terminologi, hvor en sådan terminologi findes. De er knyttet til den standardiserede terminologi ved at tilføje aliaser til C-koderne, f.eks.:
<Alias Name="C66731" Context="nci:ExtCodeID"/>
Når du definerer dataindsamlingsmetadata i ODM, er der ikke noget krav om at bruge den standardiserede terminologi, men hvis du gør det, fjernes behovet for at kortlægge udtryk fra dine indsamlede data til dine indsendte data. Dette forenkler i høj grad din ende-til-ende studieproces og øger sammenhængen mellem studier.
styring af opdateringer
håndtering af terminologiopdateringer kan være en betydelig mængde arbejde, især med standarderne, der opdateres så regelmæssigt. Hvordan ved du, hvilke studier eller organisationsstandarder der kan blive påvirket af ny terminologi? Hvordan foretager du derefter de nødvendige opdateringer på en effektiv, pålidelig måde?
den nemmeste måde at håndtere dette på er ved at bruge et CDISC-bevidst metadatalager, der giver dig mulighed for at definere organisatoriske standarder bygget på den standardiserede terminologi og opbygge dine studier ud fra disse standarder. Da depotet forstår forholdet mellem alle standarder og dine studier, kan det forenkle processen med opdatering til nye versioner af CDISC nci-Terminologistandarderne.
