en vigtig del af forståelsen af, hvordan disse systemer virkerat kontrollere celledeling var opdagelsen af, at p53 påvirker både kræft ogaldring. Tyner et al. (2002) udtænkt agenetisk strategi hos mus for at sammenligne virkningerne af fraværet af p53 eller asmaller end normalt p53-protein. De to mutante transgene muselinjer havde enten en fuldstændig sletning af p53-genet (p53 -) eller en afkortet form af p53 (p53m, mutant), der ikke havde de første seks eksoner af p53-genet (figur 2).
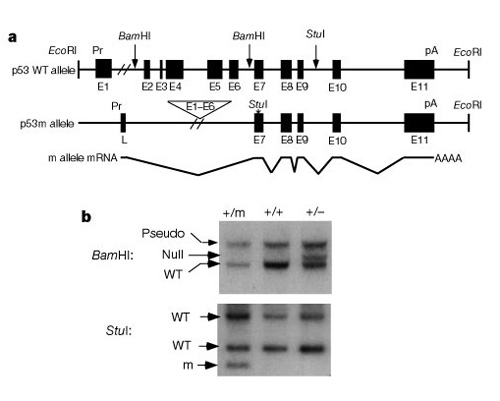
den første halvdel af undersøgelsen sammenlignede tre grupper af mus:gruppe 1, p53+/p53-(sletningaf en kopi af p53); gruppe 2, p53+/p53m(delvis deletion mutant); og gruppe 3, p53+/p53+(vildtype, normal). Tabel 1 viser disse tre grupper og deres eksperimentelle resultaterrelateret til kræft og aldrende fænotyper. Interessant nok udviklede ingen af musene igruppe 2 med det trunkerede p53-protein livstruende tumorer, mens 45% af gruppe 3 (vildtype) og over 80% af gruppe 1 udvikletlivstruende tumorer. Gruppe 2-mus havde også en mellemliggende levetid mellem den meget korte levetid for gruppe 1 og den længere levetid for gruppe 3-mus. Konklusionen fra disse data er, at den delvise p53-mutation reducerede forekomsten afkræft og samtidig syntes at forårsage et underskud i levetiden, ikke en forlænget levetid.
| tabel 1. Experimental results from genetic mousestudies with p53 mutants | |||
| Genotype | Cancer phenotype | Agingphenotype | |
| Group 1 | p53+/p53- (complete deletion) | 80%had tumors | Muchshorter life span |
| Group 2 | p53+/p53m (partial mutant) | None | Shorterlife span |
| Group 3 | p53+/p53+ (wild type) | 45%had tumors | Normallife span |
| tilpasset fra Tyner etal. 2002 | |||
forfatterne ogsåbemærkede, at Gruppe 2-musene udviklede fænotyper, der er karakteristiske for gamle mus, sådansom langsom hårgenvækst og hunchbacked spines på grund af skeletændringer, tidligereend de vilde mus gjorde (figur 3).

i anden halvdel af undersøgelsen spurgte Tyner og kollegerfungerede forskelligt i nærvær af normal p53. De opdrættede en yderligere transgen muselinje med p53 – / p53m mutantalleler og fandt ud af, at disse mus ikke havde den stærke tumorbeskyttelse og visteen meget mindre levetidseffekt. Så mutanten p53 havde på en eller anden måde brug for at arbejde ikoncert med normal p53 for at få en effekt. Som en generel observation rapporterede forskerne, at celler fra p53+/p53m heterosygoten viste sig at være ca.tre gange så hårde attransformere som vildtypeceller. Selv om disse celler var resistente over forkræft, forårsagede denne p53+ / p53mbaggrund også tidligere aldring. Faktisk syntes aktiviteten af p53 i disseheterosygoter at være særlig højere end dens aktivitet i naturen type.It syntes, at en sådan ændring, mens apriori, ville være godt mod både kræft og aldring, men at turnedout ikke at være tilfældet.
senere, Mooreet al. demonstreret det i kulturetceller med den samme mutation, der forårsager trunkeret p53-protein, kom dette trunkerede protein ind i kernen og kolokaliserede med den normale p53. De undersøgte også p53-proteinets halveringstid i celler og fandt ud af, at heterosygoterne med en kopi af mutanten p53 havde ca.en tredobbelt stigning i stabiliteten af det normale p53-protein sammenlignet medstabiliteten i den vilde type alene, hvilket betyder, at stabiliteten af proteinet blev forbedretover normal. Disse resultater i dyrkede celler udvidede og bekræftede undersøgelsen udført af Tyner et al. hos mus. Desuden var dette den første celledelingsresponsvej, der blev opdaget at fungere via p53 og modulerer klart både kræftfald og aldring.
i RB-stien, som kan signalere udgang fra celledivisionscyklussen, begivenheder såsom DNA-beskadigelse eller utilstrækkelig replikation, der fører til korte telomerer ved kromosomender forårsager nedsat CDK-signalering. Dette øger RB-proteinkinaseaktiviteten og øger følgelig aktiviteten af transkriptionsfaktoren E2F. Hvad er betydningen af E2F? Denne transkriptionsfaktor binder sig til promotorerne af RNA-polymerase-underenheder og andre proteiner, der er nødvendige for, at S-fasen kan begynde, og det hjælper med at starte celledivision (Campisi 2003; Viinberg 1995). Det ser således ud til, at både p53 ogrb-veje påvirker de samme cellecyklusstyringsmekanismer.
