læringsmål
- skriv den kemiske formel for en simpel ionisk forbindelse.
- Genkend polyatomiske ioner i kemiske formler.
Vi har allerede stødt på nogle kemiske formler til enkle ioniske forbindelser. En kemisk formel er en kortfattet liste over elementerne i en forbindelse og forholdet mellem disse elementer. For bedre at forstå, hvad en kemisk formel betyder, Skal vi overveje, hvordan en ionisk forbindelse er konstrueret ud fra dens ioner.
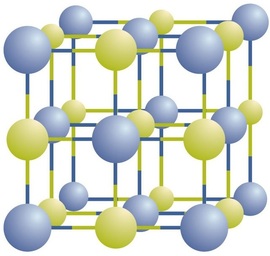
ioniske forbindelser findes som vekslende positive og negative ioner i regelmæssige, tredimensionelle arrays kaldet krystaller (figur \(\Sideindeks{1}\)). Som du kan se, er der ingen individuelle \(\ce{NaCl}\) “partikler” i arrayet; i stedet er der et kontinuerligt gitter af alternerende natrium-og chloridioner. Vi kan dog bruge forholdet mellem natriumioner og chloridioner, udtrykt i de lavest mulige hele tal, som en måde at beskrive forbindelsen på. I tilfælde af natriumchlorid er forholdet mellem natriumioner og chloridioner udtrykt i laveste hele tal 1:1, Så vi bruger \(\ce{NaCl}\) (et \(\ce{Na}\) symbol og et \(\ce{Cl}\) symbol) til at repræsentere forbindelsen. Således er \(\ce{NaCl}\) den kemiske formel for natriumchlorid, som er en kortfattet måde at beskrive det relative antal forskellige ioner i forbindelsen. En makroskopisk prøve er sammensat af myriader af NaCl-par; hvert enkelt par kaldes en formelenhed. Selvom det er praktisk at tro, at \(\ce{NaCl}\) krystaller er sammensat af individuelle \(\ce{NaCl}\) enheder, viser figur \(\Sideindeks{1}\), at ingen enkelt ion udelukkende er forbundet med nogen anden enkelt ion. Hver ion er omgivet af ioner med modsat ladning.
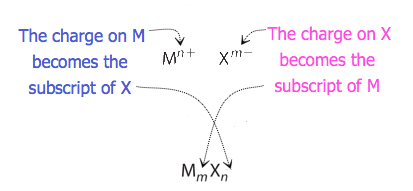
formlen for en ionforbindelse følger flere konventioner. For det første er kationen skrevet før anionen. Fordi de fleste metaller danner kationer, og de fleste ikke-metaller danner anioner, lister formler typisk metallet først og derefter det ikke-metal. For det andet er afgifter ikke skrevet i en formel. Husk, at komponentarten i en ionisk forbindelse er ioner, ikke neutrale atomer, selvom formlen ikke indeholder ladninger. Endelig har den korrekte formel for en ionisk forbindelse altid en netto nulladning, hvilket betyder, at den samlede positive ladning skal svare til den samlede negative ladning. For at bestemme den korrekte formel for enhver kombination af ioner skal du bestemme, hvor mange af hver ion der er behov for for at afbalancere de samlede positive og negative ladninger i forbindelsen.
denne regel er i sidste ende baseret på det faktum, at materie generelt er elektrisk neutral.
Ved konvention antager, at der kun er et atom, hvis et abonnement ikke er til stede. Vi bruger ikke 1 som abonnement.
Hvis vi ser på den ioniske forbindelse bestående af lithiumioner og bromidioner, ser vi, at lithiumionen har en 1+ ladning, og bromidionen har en 1− ladning. Kun en ion af hver er nødvendig for at afbalancere disse afgifter. Formlen for lithiumbromid er \(\ce{LiBr}\).
når en ionforbindelse dannes af magnesium og ilt, har magnesiumionen en 2+ ladning, og iltatomet har en 2− ladning. Selvom begge disse ioner har højere ladninger end ionerne i lithiumbromid, balancerer de stadig hinanden i et en-til-en-forhold. Derfor er den korrekte formel for denne Ioniske forbindelse \(\ce{MgO}\).
overvej nu den ioniske forbindelse dannet af magnesium og chlor. En magnesiumion har en 2 + ladning, mens en chlorion har en 1− ladning:
\
kombination af en ion af hver afbalancerer ikke de positive og negative ladninger fuldstændigt. Den nemmeste måde at afbalancere disse afgifter på er at antage tilstedeværelsen af to chloridioner for hver magnesiumion:
\
nu er de positive og negative ladninger afbalanceret. Vi kunne skrive den kemiske formel for denne Ioniske forbindelse som \(\ce{MgClCl}\), men konventionen er at bruge et numerisk abonnement, når der er mere end en ion af en given type—\(\ce{MgCl2}\). Denne kemiske formel siger, at der er en magnesiumion og to chloridioner i denne formel. (Læs ikke” Cl2 ” – delen af formlen som et molekyle af det diatomiske elementære chlor. Klor findes ikke som et diatomisk element i denne forbindelse. Det eksisterer snarere som to individuelle chloridioner.) Efter konvention anvendes det laveste hele talforhold i formlerne af ioniske forbindelser. Formlen \(\ce{Mg2Cl4}\) har afbalancerede ladninger med ionerne i forholdet 1:2, men det er ikke det laveste hele talforhold.
for forbindelser, hvor forholdet mellem ioner ikke er så indlysende, kan abonnementerne i formlen opnås ved at krydse ladninger: brug den absolutte værdi af ladningen på en ion som abonnementet for den anden ion. Denne metode er vist skematisk i figur 3.3.2.
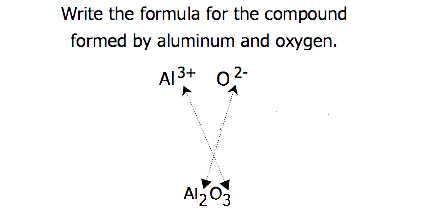
ved krydsning af afgifter er det undertiden nødvendigt at reducere abonnementerne til deres enkleste forhold for at skrive den empiriske formel. Overvej for eksempel forbindelsen dannet af Pb4+ og O2−. Brug af de absolutte værdier af ladningerne på ionerne som Abonnementer giver formlen Pb2O4. Dette forenkler til sin korrekte empiriske formel PbO2. Den empiriske formel har en PB4 + ion og to O2− ioner.
eksempel \(\Sideindeks{1}\)
skriv den kemiske formel for en ionforbindelse sammensat af hvert par ioner.
- natriumion og svovlion
- aluminiumion og fluorid ion
- 3+ jernion og iltion
opløsning
- for at opnå en valensskaloktet danner natrium en ion med en 1+ ladning, mens svovlionen har en 2− ladning. To natrium 1 + ioner er nødvendige for at afbalancere 2− ladningen på svovlionen. I stedet for at skrive formlen som \(\ce{NaNaS}\), forkorter vi den efter konvention til \(\ce{Na2S}\).
- aluminiumionen har en 3 + ladning, mens fluoridionen dannet af fluor har en 1− ladning. Tre fluor 1-ioner er nødvendige for at afbalancere 3+ ladningen på aluminiumionen. Denne kombination er skrevet som \(\ce{AlF3}\).
- jern kan danne to mulige ioner, men ionen med en 3+ ladning er angivet her. Iltatomet har en 2-ladning som en ion. For at afbalancere de positive og negative ladninger ser vi på det mindst almindelige multiple—6: to jern 3+ ioner giver 6+, mens tre 2− iltioner giver 6− og derved afbalancerer de samlede positive og negative ladninger. Formlen for denne Ioniske forbindelse er således \(\ce{Fe2O3}\). Alternativt kan du anvende metoden med krydsafgifter vist i figur 3.3.2.
øvelse \(\Sideindeks{1}\)
skriv den kemiske formel for en ionforbindelse sammensat af hvert par ioner.
- calciumion og ilt ion
- 2 + kobber ion og svovl ion
- 1 + kobber ion og svovl ion
svar A:
CaO
svar b:
CuS
svar c:
Cu2S
polyatomiske ioner
nogle ioner består af grupper af atomer, der er kovalent bundet sammen og har en samlet elektrisk ladning. Fordi disse ioner indeholder mere end et atom, kaldes de polyatomiske ioner. Strukturerne, navne og formler for nogle polyatomiske ioner findes i tabel 3.3.1.
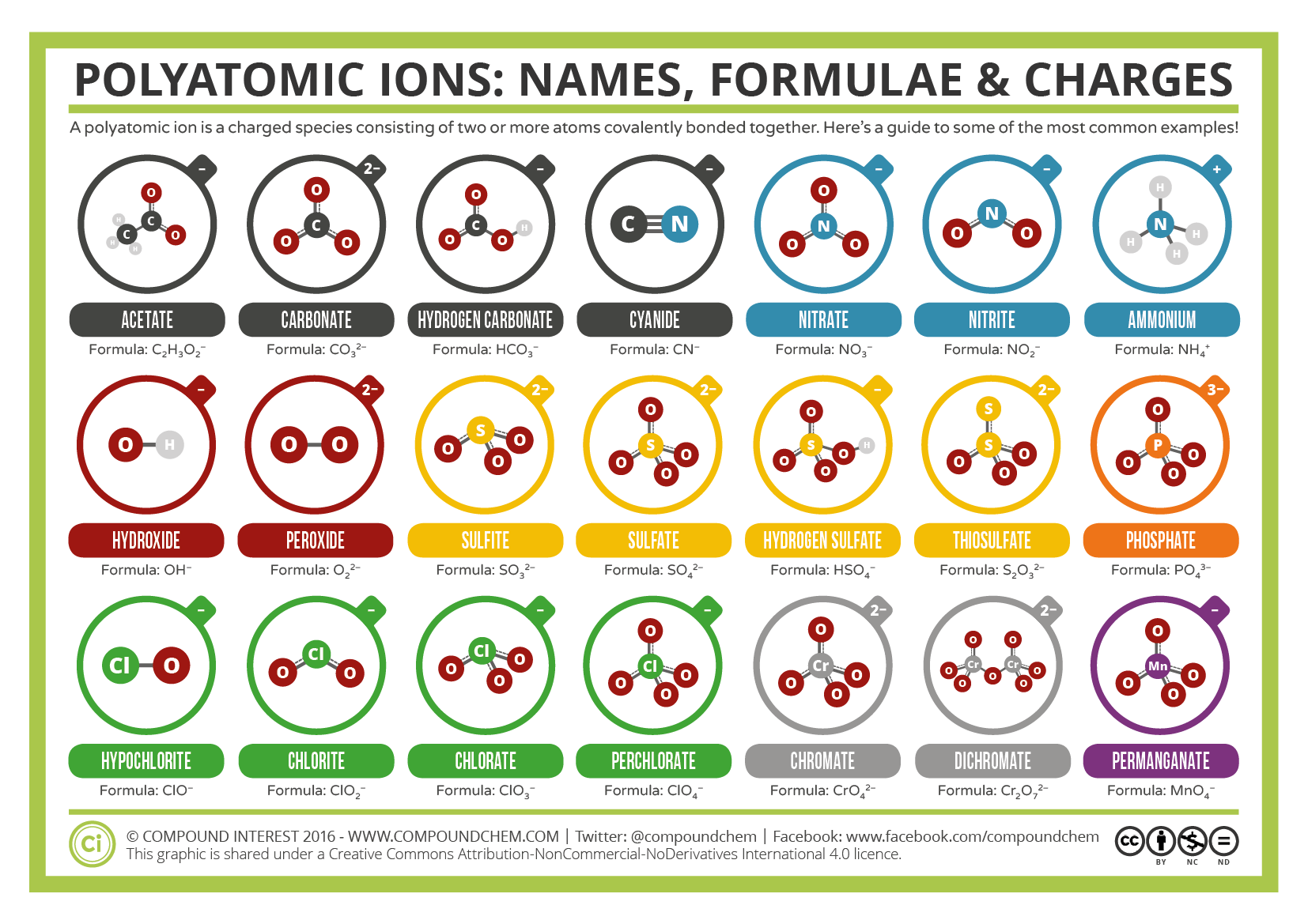
tabel \(\Sideindeks{1}\): Nogle polyatomiske ioner
polyatomiske ioner har definerede formler, navne og ladninger, der ikke kan ændres på nogen måde. Tabel \(\Sideindeks{2}\) viser ionnavne og ionformler for de mest almindelige polyatomiske ioner. For eksempel er \(\ce{NO3^ { – }}\) nitration; det har et nitrogenatom og tre iltatomer og en samlet 1− ladning. Figur \(\Sideindeks{2}\) viser de mest almindelige polyatomiske ioner.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. De resterende polyatomiske ioner er alle negativt ladede og klassificeres derfor som anioner. Imidlertid er kun to af disse, hydroksidionen og cyanidionen, navngivet ved hjælp af “-ide”-suffikset, der typisk indikerer negativt ladede partikler. De resterende polyatomiske anioner, som alle indeholder ilt, i kombination med et andet ikke-metal, findes som en del af en serie, hvor antallet af ilt i den polyatomiske enhed kan variere. Som det gentagne gange er blevet understreget i flere afsnit i denne tekst, bør ikke to kemiske formler have et fælles kemisk navn. Et enkelt suffiks,” – ide”, er utilstrækkeligt til at skelne navnene på anionerne i en beslægtet polyatomisk serie. Derfor anvendes”- ate “og” – ite ” suffikser for at betegne, at de tilsvarende polyatomiske ioner er en del af en serie. Derudover angiver disse suffikser også det relative antal iltegener, der er indeholdt i de polyatomiske ioner. Bemærk, at alle de polyatomiske ioner, hvis navne slutter i “-ate”, indeholder en mere ilt end de polyatomiske anioner, hvis navne slutter i “-ite.”Desværre, ligesom det fælles system til navngivning af overgangsmetaller, angiver disse suffikser kun det relative antal ilt, der er indeholdt i de polyatomiske ioner. For eksempel har nitrationen, som er symboliseret som NO3−1, et mere ilt end nitritionen, som er symboliseret som NO2−1. Sulfationen er imidlertid symboliseret som SO4-2. Mens både nitrationen og sulfationen deler et “-ate” suffiks, indeholder førstnævnte tre iltegener, men sidstnævnte indeholder fire. Derudover indeholder både nitration og sulfition tre iltegener, men disse polyatomiske ioner deler ikke et fælles suffiks. Desværre kræver den relative karakter af disse suffikser, at ionformlen/ionnavnekombinationerne af de polyatomiske ioner simpelthen skal huskes.
reglen for konstruktion af formler for ioniske forbindelser indeholdende polyatomiske ioner er den samme som for formler indeholdende monatomiske (enkeltatom) ioner: de positive og negative ladninger skal balancere. Hvis der er behov for mere end en af en bestemt polyatomisk ion for at afbalancere ladningen, skal hele formlen for den polyatomiske ion være lukket i parentes, og det numeriske abonnement placeres uden for parenteserne. Dette er for at vise, at abonnementet gælder for hele den polyatomiske ion. To eksempler er vist nedenfor:

eksempel \(\Sideindeks{2}\)
skriv den kemiske formel for en ionforbindelse sammensat af hvert par ioner.
- kaliumion og sulfation
- calciumion og nitration
opløsning
- kaliumioner har en ladning på 1+, mens sulfationer har en ladning på 2−. Vi har brug for to kaliumioner for at afbalancere ladningen på sulfationen, så den korrekte kemiske formel er \(\ce{K_2SO_4}\).
- calciumioner har en ladning på 2+, mens nitritioner har en ladning på 1 -. Vi har brug for to nitrationer for at afbalancere ladningen på hver calciumion. Formlen for nitrat skal vedlægges i parentes. Således skriver vi \(\ce{Ca (NO3)2}\) som formlen for denne Ioniske forbindelse.
øvelse \(\Sideindeks{2}\)
skriv den kemiske formel for en ionforbindelse sammensat af hvert par ioner.
- magnesiumion og carbonation
- aluminiumion og acetation
svar A:
Mg2+ og CO32- = MGCO3
svar b:
Al3+ og C2H3O2- = Al(C2H3O2)3
genkendelse af ioniske forbindelser
der er to måder at genkende ioniske forbindelser på. For det første er forbindelser mellem metal-og ikke-metalelementer normalt Ioniske. For eksempel indeholder CaBr2 et metallisk element (calcium, et Gruppe 2A metal) og et ikke-metallisk element (brom, en gruppe 7A ikke-metallisk). Derfor er det højst sandsynligt en ionisk forbindelse. (Faktisk er det ionisk.) I modsætning hertil indeholder forbindelsen NO2 to elementer, der begge er ikke-metaller (nitrogen, fra gruppe 5A og ilt, fra gruppe 6a). Det er ikke en ionisk forbindelse; det hører til den kategori af kovalente forbindelser, der diskuteres andre steder. Bemærk også, at denne kombination af nitrogen og ilt ikke har nogen elektrisk ladning specificeret, så det er ikke nitritionen.
for det andet, hvis du genkender formlen for en polyatomisk ion i en forbindelse, er forbindelsen ionisk. For eksempel, hvis du ser formlen \(\ce{Ba(NO3)2}\), kan du genkende “NO3″−delen som nitration, \(\rm{NO_3^ -}\). (Husk, at konventionen til skrivning af formler for ioniske forbindelser ikke skal omfatte den ioniske ladning.) Dette er en anelse om, at den anden del af formlen, \(\ce{Ba}\), faktisk er \(\ce{Ba^{2+}}\) ion, hvor 2+ ladningen afbalancerer den samlede 2− ladning fra de to nitrationer. Således er denne forbindelse også ionisk.
eksempel \(\Sideindeks{3}\)
Identificer hver forbindelse som ionisk eller ikke ionisk.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{OF2}\)
løsning
- natrium er et metal, og ilt er et ikke-metal; derfor forventes \(\ce{Na2O}\) at være ionisk.
- både fosfor og chlor er ikke-metaller. Derfor er \(\ce{PCl3}\) ikke ionisk.
- \(\ce{NH4}\) i formlen repræsenterer ammoniumionen, \(\ce{NH4^ {+}}\), hvilket indikerer, at denne forbindelse er ionisk.
- både ilt og fluor er ikke-metaller. Derfor er \(\ce{OF2}\) ikke ionisk.
øvelse \(\Sideindeks{3}\)
Identificer hver forbindelse som ionisk eller ikke ionisk.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(NH4)3PO4}\)
- \(\ce{SOCl2}\)
svar A:
ikke ionisk
svar B:
ionisk
svar C:
ionisk
svar D:
ikke ionisk
ser nærmere: blod og havvand
videnskaben har længe erkendt, at blod og havvand har lignende sammensætninger. Når alt kommer til alt har begge væsker ioniske forbindelser opløst i dem. Ligheden kan være mere end blot tilfældighed; mange forskere mener, at de første livsformer på jorden opstod i oceanerne. Et nærmere kig viser imidlertid, at blod og havvand er helt forskellige. En 0,9% opløsning af natriumchlorid tilnærmer saltkoncentrationen, der findes i blod. I modsætning hertil er havvand hovedsageligt en 3% natriumchloridopløsning, over tre gange koncentrationen i blod. Her er en sammenligning af mængderne af ioner i blod og havvand:
| Ion | procent i havvand | procent i blod |
|---|---|---|
| na+ | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Denne forskel er signifikant, fordi hydrogencarbonationen og nogle relaterede ioner har en afgørende rolle i styringen af blodets syrebaseegenskaber. Mængden af hydrogenphosphationer – \(\ce{HPO4^{2−}}\) og \(\ce{H2PO4^{—}}\)-i havvand er meget lav, men de er til stede i højere mængder i blod, hvor de også påvirker syre-base egenskaber. En anden bemærkelsesværdig forskel er, at blod ikke har betydelige mængder af sulfationen (\(\ce{SO4^{2−}}\)), men denne ion er til stede i havvand.
nøgle grillbarer
- korrekte kemiske formler for ioniske forbindelser afbalancerer den samlede positive ladning med den samlede negative ladning.
- grupper af atomer med en samlet ladning, kaldet polyatomiske ioner, findes også.
øvelser
-
hvilke oplysninger findes i formlen for en ionforbindelse?
-
hvorfor indeholder de kemiske formler for nogle ioniske forbindelser abonnementer, mens andre ikke gør det?
3. Skriv den kemiske formel for den ioniske forbindelse dannet af hvert par ioner.
- Mg2+ og i−
- Na+ og O2−
4. Skriv den kemiske formel for den ioniske forbindelse dannet af hvert par ioner.
- Na+ og Br−
- Mg2+ og Br−
- Mg2+ og S2−
5. Skriv den kemiske formel for den ioniske forbindelse dannet af hvert par ioner.
- K+ og Cl−
- Mg2+ og Cl−
- Mg2+ og Se2−
6. Skriv den kemiske formel for den ioniske forbindelse dannet af hvert par ioner.
- Na+ og N3−
- Mg2+ og N3−
- Al3+ og S2−
7. Skriv den kemiske formel for den ioniske forbindelse dannet af hvert par ioner.
- Li+ og N3−
- Mg2+ og P3−
- Li+ og P3−
8. Skriv den kemiske formel for den ioniske forbindelse dannet af hvert par ioner.
- Fe3+ og Br−
- Fe2+ og Br−
- Au3+ og S2−
- Au+ og S2−
9. Skriv den kemiske formel for den ioniske forbindelse dannet af hvert par ioner.
- Cr3+ og O2−
- Cr2+ og O2−
- Pb2+ og Cl−
- Pb4+ og Cl−
10. Skriv den kemiske formel for den ioniske forbindelse dannet af hvert par ioner.
- Cr3+ og NO3−
- Fe2+ og PO43−
- Ca2+ og CrO42−
- Al3+ og OH−
11. Skriv den kemiske formel for den ioniske forbindelse dannet af hvert par ioner.
- NH4+ og NO3−
- h+ og Cr2O72−
- Cu+ og CO32−
- Na+ og HCO3−
12. For hvert par elementer skal du bestemme ladningen for deres ioner og skrive den korrekte formel for den resulterende Ioniske forbindelse mellem dem.
- Ba og S
- Cs og i
13. For hvert par elementer skal du bestemme ladningen for deres ioner og skrive den korrekte formel for den resulterende Ioniske forbindelse mellem dem.
- K og S
- Sc og Br
14. Hvilke forbindelser vil du forudsige at være Ioniske?
- Li2O
- (NH4)2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Hvilke forbindelser vil du forudsige at være Ioniske?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2cro4
- C8H18
- NH3
svar
1. forholdet mellem hver type ion i forbindelsen
2. Nogle gange er der brug for mere end en ion for at afbalancere ladningen på den anden ion i en ionisk forbindelse.
- MgI2
- Na2O
- NaBr
- MgBr2
- MGS
- KCL
- MgCl2
- Mgse
- na3n
- Mg3n2
- AL2S3
- li3n
- mg3p2
- li3p
- febr3
- Febr2
- AU2S3
- au2s
- Cr2O3
- Cro
- PbCl2
- PbCl4
- Cr(No3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- h2cr2o7
- cu2co3
- NaHCO3
- Ba2+, S2−, bas
- cs+, i−, CSI
- K+, S2−, K2s
- SC3+, br−, scbr3
- Ioniske
- ikke Ioniske
- Ioniske
- ikke Ioniske
- ikke Ioniske
- ikke Ioniske
- ikke Ioniske
- ikke Ioniske
- div>
- ionisk
ikke ionisk ikke ionisk - ionisk
ikke ionisk ikke ionisk
- ionisk
