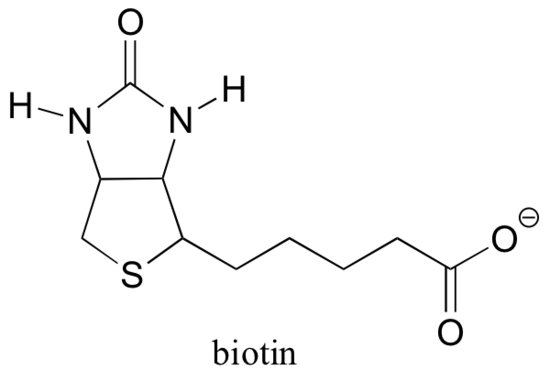
13.5 D: Biotin er et CO2-bærende coensym
Husk fra afsnit 6.5 B, at mange stoffer er afhængige af hjælp fra coensymer, som er små (i forhold til protein) organiske molekyler, der binder – kovalent eller ikke-kovalent – på et aktivt sted og hjælpe det med at katalysere dets reaktion. S-adenosylmethionin (SAM, afsnit 9.1 A) og ATP (afsnit 10.2) er to eksempler, som vi hidtil har stødt på, og vi vil se flere flere i de kommende kapitler. Selvom Rubisco (beskrevet i del B i dette afsnit) er en undtagelse, er de fleste stoffer, der katalyserer carboksyleringsreaktioner, afhængige af et kaldet biotin, der tjener som en midlertidig bærer af kulsyre.
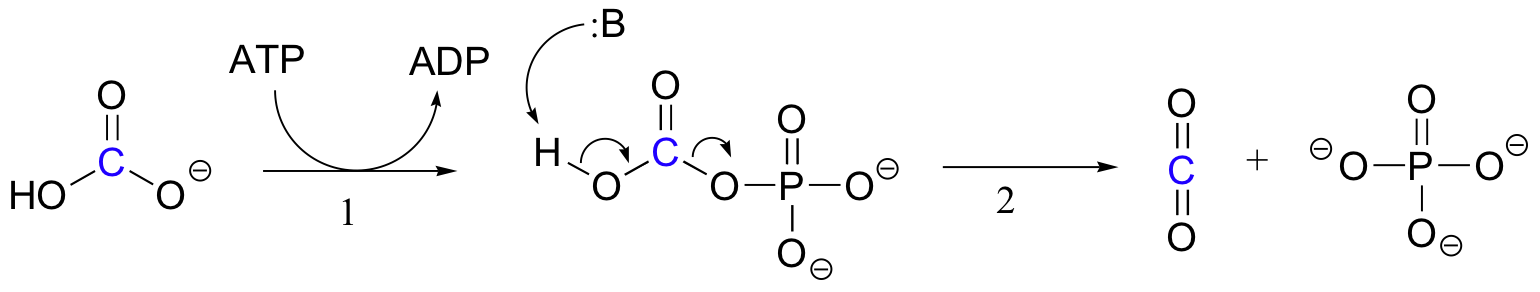
Bemærk, at CO2 i denne reaktion er afledt af bicarbonat, i modsætning til Rubisco-reaktionen, hvor CO2 ‘fikseres’ direkte fra atmosfæren.

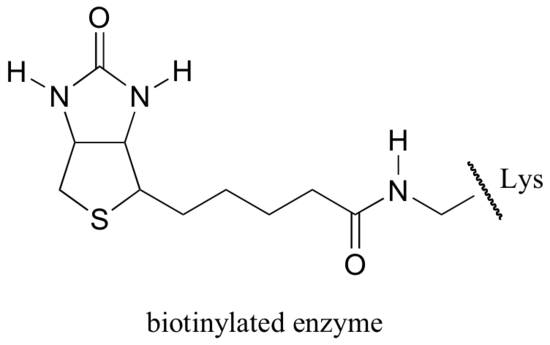
Biotin er kovalent bundet til det aktive sted lysin.
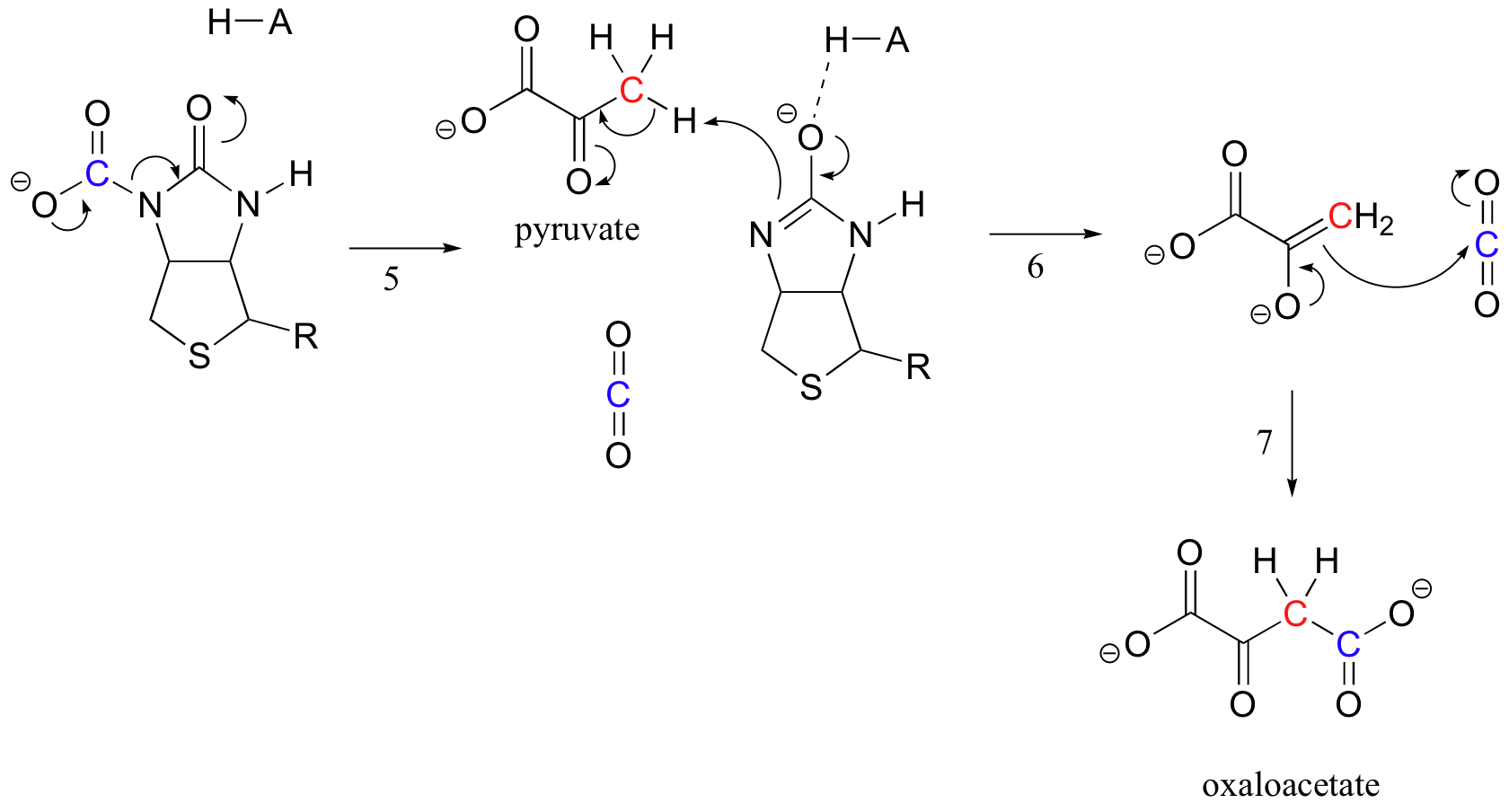
den nøjagtige mekanisme, hvormed biotinafhængige karboksyleringsreaktioner fungerer, forstås stadig ikke fuldstændigt, men følgende er et sandsynligt billede. For det første phosphoryleres bicarbonationen med ATP (trin 1, Se afsnit 10.2) og aktiveres således til dekarboksylation, som genererer fri CO2 (trin 2).
biotins job er at holde fast i kulstofmolekylet, indtil pyruvat kommer ind på det aktive sted. Biotin involverer deprotonation af amidnitrogenet til dannelse af et enolatlignende mellemprodukt (trin 3 – amider har en pKa på cirka 17, og dette sænkes ved tilstedeværelsen af en aktiv syre nær iltet). Dette trin efterfølges af angreb af det nukleofile nitrogen på kulsyre for at danne karboksybiotinyleret (trin 4).
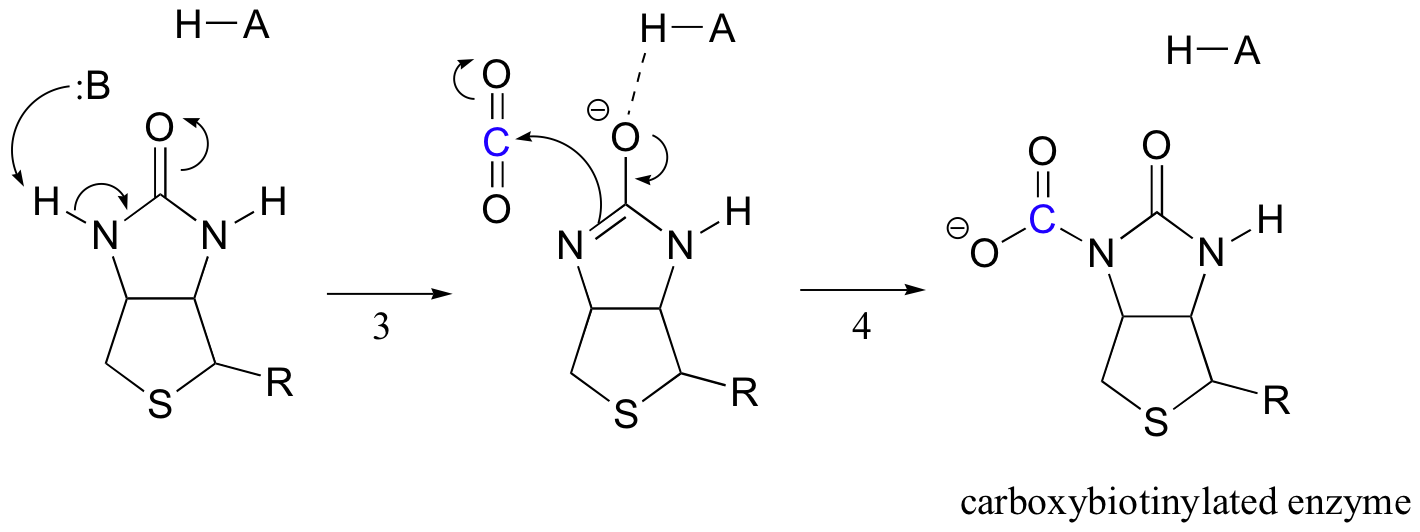
når et pyruvatmolekyle binder, får omlejring af den aktive stedarkitektur det forrige trin til at gå i omvendt retning (trin 5), frigøre CO2 og generere en biotinbase til at deprotonere alfa-kulstof fra pyruvat, så det på en aldollignende måde kan kondensere med CO2 til dannelse af oksaloacetat (trin 6-7).
hvis du har studeret noget biokemi, har du måske hørt om biotin i en noget anden sammenhæng, hvad der diskuteres i dette afsnit. Et protein kaldet avidin, der findes i overflod i æggehvide, binder ikke-kovalent og ekstremt tæt til biotin (faktisk er avidin-biotin det strammeste protein-ligandbindende par kendt for videnskaben). Biokemikere bruger ofte denne egenskab ved kovalent at forbinde et biomolekyle af interesse med biotin. Den ‘biotinylerede’ art kan derefter let isoleres fra en kompleks blanding ved at køre blandingen gennem en ‘affinitetskolonne’, der er belagt med avidin.
