der er en række måder, hvorpå en celle kan bevæge sig fra et punkt i rummet til et andet. I et flydende medium kan denne metode være en slags svømning ved hjælp af ciliær eller flagellær bevægelse til at drive cellen. På faste overflader fungerer disse mekanismer klart ikke effektivt, og cellen gennemgår en gennemsøgningsproces. I dette afsnit begynder vi med en diskussion af ciliary/flagellar bevægelse, og derefter overveje de mere komplicerede krav til cellulær gennemsøgning.
Cilia og flagella, der primært adskiller sig i længde snarere end konstruktion, er mikrotubuli-baserede organeller, der bevæger sig med en frem og tilbage bevægelse. Dette oversættes til” roing ” af de relativt korte cilia, men i den længere flagella får strukturens fleksibilitet frem og tilbage til at blive forplantet som en bølge, så flagellarbevægelsen er mere bølgende eller piskelignende (overvej hvad der sker, når du vugger en haveslange hurtigt fra side til side sammenlignet med et kort stykke af den samme slange). Kernen i begge strukturer kaldes aksoneme, som er sammensat af 9 mikrotubuli-dubletter forbundet med hinanden ved hjælp af ciliære dyneinmotoriske proteiner og omgiver en central kerne af to separate mikrotubuli.
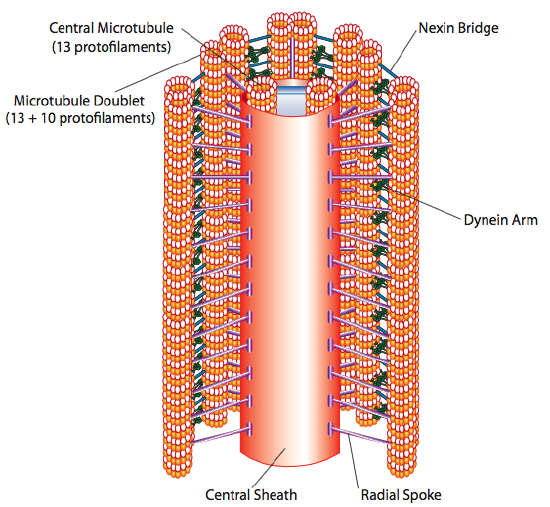
Dette er kendt som” 9+2 ” – formationen, selvom de ni dubletter ikke er de samme som de to centrale mikrotubuli. A tubule er en fuld 13-protofilamenter, men B tubule smeltet til det indeholder kun 10 protofilamenter. Hver af de centrale mikrotubuli er en fuld 13 protofilamenter. 9 + 2 aksonemet strækker længden af cilium eller flagellum fra spidsen, indtil den når basen, og forbinder til cellelegemet gennem en basallegeme, som er sammensat af 9 mikrotubuli tripletter arrangere i en kort tønde, ligesom centriolerne, hvorfra de er afledt.
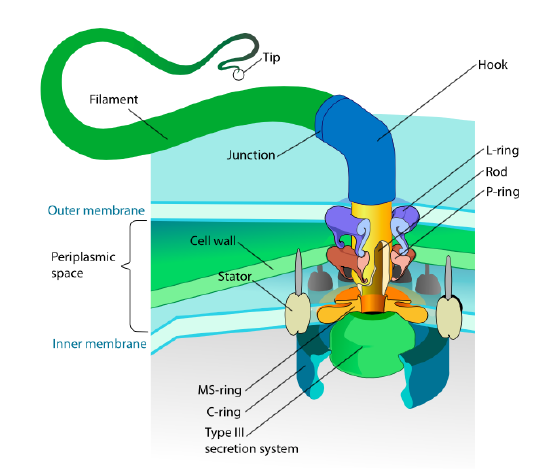
dette afsnit henviser kun til eukaryoter. Nogle prokaryoter har også bevægelige vedhæng kaldet flagella, men de er helt forskellige i både struktur og mekanisme. Flagellaen selv er lange spiralformede polymerer af proteinet flagellin, og basen af flagellinfibrene er forbundet med et rotationsmotorprotein, ikke en translationsmotor. Denne motor (figur \(\Sideindeks{18}\)) bruger ion (H+ eller Na+ afhængigt af arter) ned ad en elektrokemisk gradient for at give energien til at rotere så mange som 100000 omdrejninger pr. Det antages, at rotationen drives af konformationsændringer i statorringen, beliggende i cellemembranen.
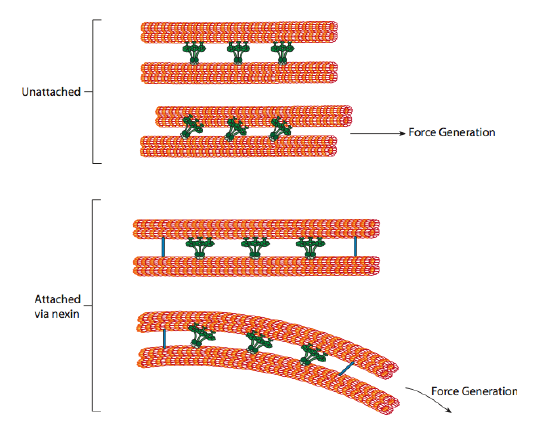
ciliary dyneins giver motorens kapacitet, men der er også to andre bindingsproteiner i aksonemet. Der er neksiner, der forbinder a-tubule af en dublet til B-tubule af dens tilstødende dublet, således forbinder den ydre ring. Og der er radiale eger, der strækker sig fra A-tubulen i hver dublet til det centrale par mikrotubuli i kernen af aksonemet. Ingen af disse har nogen motoraktivitet. De er dog afgørende for bevægelsen af cilia og flagella, fordi de hjælper med at omdanne en glidende bevægelse til en bøjningsbevægelse. Når ciliary dynein (meget lig cytoplasmatiske dyneiner, men har tre hoveder i stedet for to) er i indgreb, binder den en a-mikrotubuli på den ene side, en B-mikrotubuli fra den tilstødende dublet og bevæger sig den ene i forhold til den anden. En linje af disse dyneins, der bevæger sig i koncert, ville således glide en dublet i forhold til den anden, hvis (og det er en stor “hvis”) de to dubletter havde fuldstændig bevægelsesfrihed. Men da dubletter er forbundet med hinanden proteiner, hvad der sker som en dublet forsøger at glide er, at det bøjer den tilsluttede struktur i stedet (figur \(\Sideindeks{17}\)). Denne bøjning tegner sig for roebevægelsen af cilia, som er relativt korte, såvel som piskebevægelsen af den lange flagella, som formerer bøjningsbevægelsen ned ad aksonemet.
selvom vi tænker på ciliær og flagellær bevægelse som metoder til fremdrift af en celle, såsom flagellær svømning af sæd mod et æg, er der også en række vigtige steder, hvor cellen er stationær, og cilia bruges til at bevæge væske forbi cellen. Faktisk er der celler med cilia i de fleste større organer i kroppen. Flere ciliære dyskinesier er rapporteret, hvoraf den mest fremtrædende, primære ciliære dyskinesi (PCD), som inkluderer Kartagener syndrom (KS), skyldes mutation af DNAI1-genet, som koder for en underenhed (mellemkæde 1) af aksonemal (ciliær) dynein. PCD er kendetegnet ved åndedrætsbesvær på grund af tilbagevendende infektion, og diagnosen KS stilles, hvis der også er situs inversus, en tilstand, hvor den normale venstre-højre asymmetri i kroppen (f.eks. Det første symptom skyldes inaktivitet af de mange cilia af epithelceller i lungerne. Deres normale funktion er at holde slim i åndedrætssporet konstant i bevægelse. Normalt hjælper slimet med at holde lungerne fugtige for at lette funktionen, men hvis slimet bliver stationært, bliver det en yngleplads for bakterier samt bliver en irriterende og hindring for korrekt gasudveksling.
Situs inversus er en interessant misdannelse, fordi den opstår i embryonal udvikling og kun påvirker 50% af PCD-patienter, fordi den nedsatte ciliærfunktion forårsager randomisering af venstre-højre asymmetri, ikke reversering. I meget enkle vendinger, under den tidlige embryonale udvikling, skyldes venstre-højre asymmetri delvis bevægelsen af molekylære signaler i en venstre ov gennem den embryonale knude. Denne strømning skyldes den koordinerede slagning af cilia, så når de ikke virker, forstyrres strømmen, og randomisering opstår.
andre symptomer på PCD-patienter påpeger også arbejdet med cilia og flagella i kroppen. Mandlig infertilitet er almindelig på grund af immotil sæd. Kvindelig infertilitet, men mindre almindelig, kan også forekomme på grund af dysfunktion af ovidukens cilia og æggeleder, der normalt bevæger ægget sammen fra æggestok til livmoder. Interessant er der også en lav forening af hydrocephalus internus (overfyldning af hjernens ventrikler med cerebrospinalvæske, hvilket forårsager deres udvidelse, der komprimerer hjernevævet omkring dem) med PCD. Dette skyldes sandsynligvis dysfunktion af cilia i de ependymale celler, der forer ventriklerne, og som hjælper med at cirkulere CSF, men er tilsyneladende ikke helt nødvendige. Da CSF bulkstrøm menes at være drevet primært af systole / diastol ændring i blodtryk i hjernen, antager nogle, at cilia primært kan være involveret i U gennem nogle af de strammere kanaler i hjernen.
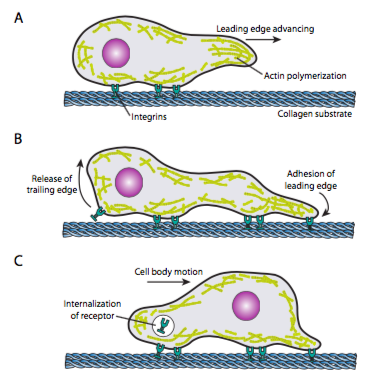
cellekrybning (figur \(\Sideindeks{19}\)) kræver koordineret omlægning af forkantmikrofilamentnetværket, der strækker sig (ved både polymerisering og glidende filamenter) og derefter danner adhæsioner på det nye fremadrettede punkt. Dette kan tage form af filopodia eller lamellipodia,og ofte begge samtidigt. Filopodia er lange og meget tynde fremspring med kernebundter af parallelle mikrofilamenter og høje koncentrationer af celleoverfladereceptorer. Deres formål er primært at mærke miljøet. Lamellipedia strækker sig ofte mellem to lopodia og er mere af en bred flæse end en finger. Internt danner actin mere i masker end bundter, og den bredere kant gør det muligt at lave flere vedhæftninger til substratet. Mikrofilamentnetværket omarrangeres derefter igen, denne gang åbner et rum i cytoplasmaet, der fungerer som en kanal til bevægelse af mikrotubuli mod fronten af cellen. Dette sætter transportnetværket på plads for at hjælpe med at flytte intracellulært bulkmateriale fremad. Da dette sker, frigives de gamle adhæsioner på haleenden af cellen. Denne frigivelse kan ske gennem to primære mekanismer: endocytose af receptoren eller deaktivering af receptoren ved signalering/konformationsændring. Selvfølgelig, denne forenkling modsiger kompleksiteten i at koordinere og kontrollere alle disse handlinger for at opnå rettet bevægelse af en celle.
en model af mikrofilamentkraftgenerering, den elastiske bruniske Ratchet-Model (Mogilner og Oster, 1996), foreslår, at actinfilamenterne, der skubber ud mod membranens kanter, bøjes i varierende grad på grund af brunisk bevægelse af cellemembranen som følge af kontinuerlig minut termisk udsving. Hvis bøjningen er stor nok, kan en ny actinmonomer passe ind mellem membranen og spidsen af filamentet, og når det nu længere filament bøjes tilbage, kan det udøve et større skub på membranen. Det er klart, at et enkelt filament ikke genererer meget kraft, men den koordinerede udvidelse af mange filamenter kan skubbe membranen fremad.
Når en celle modtager et signal om at bevæge sig, er det indledende cytoskeletale respons at polymerisere actin og opbygge flere mikrofilamenter til at inkorporere i forkanten. Afhængigt af signalet (attraktivt eller afstødende) kan polymeriseringen forekomme på den samme eller modsatte side af cellen fra punktet for signalreceptoraktivering. Betydeligt kan polymeriseringen af nyt f-actin alene generere tilstrækkelig kraft til at bevæge membranen fremad, selv uden involvering af myosin-motorer! Modeller af kraftgenerering diskuteres, men starter generelt med inkorporering af nyt g-actin i et filament ved spidsen; det vil sige ved filament-membrangrænsefladen. Selvom det teknisk set kan være nok, er myosiner involveret i en levende celle og hjælper med at skubbe og arrangere filamenter retningsbestemt for at oprette den nye forkant. Derudover skal nogle filamenter og netværk hurtigt afbrydes, og der skal oprettes nye forbindelser, både mellem filamenter og mellem filamenter og andre proteiner, såsom adhæsionsmolekyler eller mikrotubuli.
hvordan styres polymeriseringen og actinomlejringen? Receptorerne, der signalerer cellebevægelse, kan indlede noget forskellige veje, men mange deler nogle fælles træk ved aktivering af et eller flere medlemmer af Ras-familien af små Gtpaser. Disse signalmolekyler, såsom Rac, Rho og cdc42, kan aktiveres af receptortyrosinkinaser (se RTK-Ras-aktiveringsveje, Kap. 14). Hver af disse har en lidt anden rolle i cellemotilitet: cdc42-aktivering fører til filopodia-dannelse, Rac aktiverer en vej, der inkluderer Arp2/3 og cofilin til lamellipodia-dannelse, og Rho aktiverer myosin II for at kontrollere fokal vedhæftning og dannelse af spændingsfibre. En anden type receptorkaskade, G-protein signaleringskaskade (også Kapitel 14), kan føre til aktivering af PLC og efterfølgende spaltning af PIP2 og stigning i cytosolisk Ca2+. Disse ændringer, som tidligere nævnt, kan også aktivere myosin II, såvel som remodeling gelsolin, cofilin og profilin. Dette nedbryder eksisterende actinstrukturer for at gøre cellen mere flydende, samtidig med at det bidrager mere g-actin til at danne det nye forkant cytoskelet.
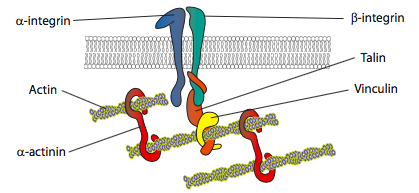
in vitro-eksperimenter viser, at når membranen skubber fremad, skabes nye klæbekontakter gennem adhæsionsmolekyler eller receptorer, der binder substratet (ofte cellekulturglas eller fade er belagt med kollagen, filaminin eller andre ekstracellulære matriceproteiner). Kontakterne rekrutterer derefter cytoskeletale elementer for større stabilitet for at danne en fokal vedhæftning (figur \(\Sideindeks{20}\)). Dannelsen af fokale adhæsioner ser imidlertid ud til at være en artefakt af cellekultur, og det er uklart, om de typer adhæsioner, der dannes in vivo, rekrutterer de samme typer cytoskeletale komponenter.
det tredje trin til cellebevægelse er bulkbevægelsen af det cellulære indhold fremad. Mekanismerne for denne fase er uklare, men der er nogle beviser for, at ved hjælp af forbindelser mellem actincytoskelettet i forkanten og de forreste dele af mikrotubuli-cytoskelettet omarrangeres mikrotubuliene for at danne en effektiv transportvej til bulkbevægelse. Et andet aspekt ved dette kan være en “corralling” – effekt af actin-netværkene, der retningsbestemt åbner plads mod forkanten. Mikrotubuli kommer derefter lettere ind i dette rum end at arbejde gennem et stramt actinnet, hvilket tvinger strømmen i den rigtige retning.
meget af arbejdet med mikrotubule-actininteraktioner i cellemotilitet er blevet udført gennem forskning på den neuronale vækstkegle, som undertiden omtales som en celle i snor, fordi den virker næsten uafhængigt som en gennemsøgende celle og søger efter den rette vej til at føre sin akson fra cellelegemet til sin rette synaptiske forbindelse (A. V. Schaefer et al., Dev. Celle 15: 146-62, 2008).
endelig skal cellen fortryde sine gamle vedhæftninger på bagkanten. Dette kan ske på en række forskellige måder. In vitro er gennemsøgende celler blevet observeret at rive sig ud af substratet og efterlade små stykker membran og tilknyttede adhæsionsproteiner i processen. Den genererede kraft antages at komme fra actin-myosin-spændingsfibre, der fører fra de mere fremadrettede fokale adhæsioner. Der er dog mindre destruktive mekanismer til rådighed for cellerne. I nogle tilfælde kan adhæsiviteten af den cellulære receptor for det ekstracellulære substrat reguleres internt, måske ved phosphorylering eller dephosphorylering af en receptor. En anden mulighed er endocytose af receptoren, idet den fjernes fra celleoverfladen. Det kan simpelthen genbruge op til forkanten, hvor det er nødvendigt (dvs.transcytose), eller hvis det ikke længere er nødvendigt eller beskadiget, kan det nedbrydes i et lysosom.
