Elektronegativitu a Vazba Polarita
i když jsme definovali kovalentní vazby jako sdílení elektronů, elektrony do kovalentní vazby nejsou vždy rovným dílem dva vázané atomy. Pokud vazba spojuje dva atomy téhož prvku, tam bude vždy být jeden atom přitahuje elektrony v pouto silnější než druhý atom má, jak je znázorněno na Obrázku 4.3 „Polární vs. Nepolární Kovalentní Vazby“. Když taková nerovnováha se vyskytuje, je výsledkem nahromadění některé negativní náboj (tzv. parciální záporný náboj a určené δ−) na jednu stranu dluhopisů a některé pozitivní náboj (označené δ+) na druhé straně dluhopisů. Kovalentní vazba, která má nerovné sdílení elektronů, jako v části (b) Obrázek 4.3 „Polární vs. Nepolární Kovalentní Vazby“, se nazývá polární kovalentní bondA kovalentní vazby s nevyváženou elektronové distribuce přes pouto.. Kovalentní vazba, která má stejné sdílení elektronů (část (a) obrázku 4.3 „polární versus nepolární kovalentní vazby“) se nazývá nepolární kovalentní vazbakovalentní vazba s vyváženou distribucí elektronů napříč vazbou..
Obrázek 4.3 Polární vs. Nepolární Kovalentní vazbu
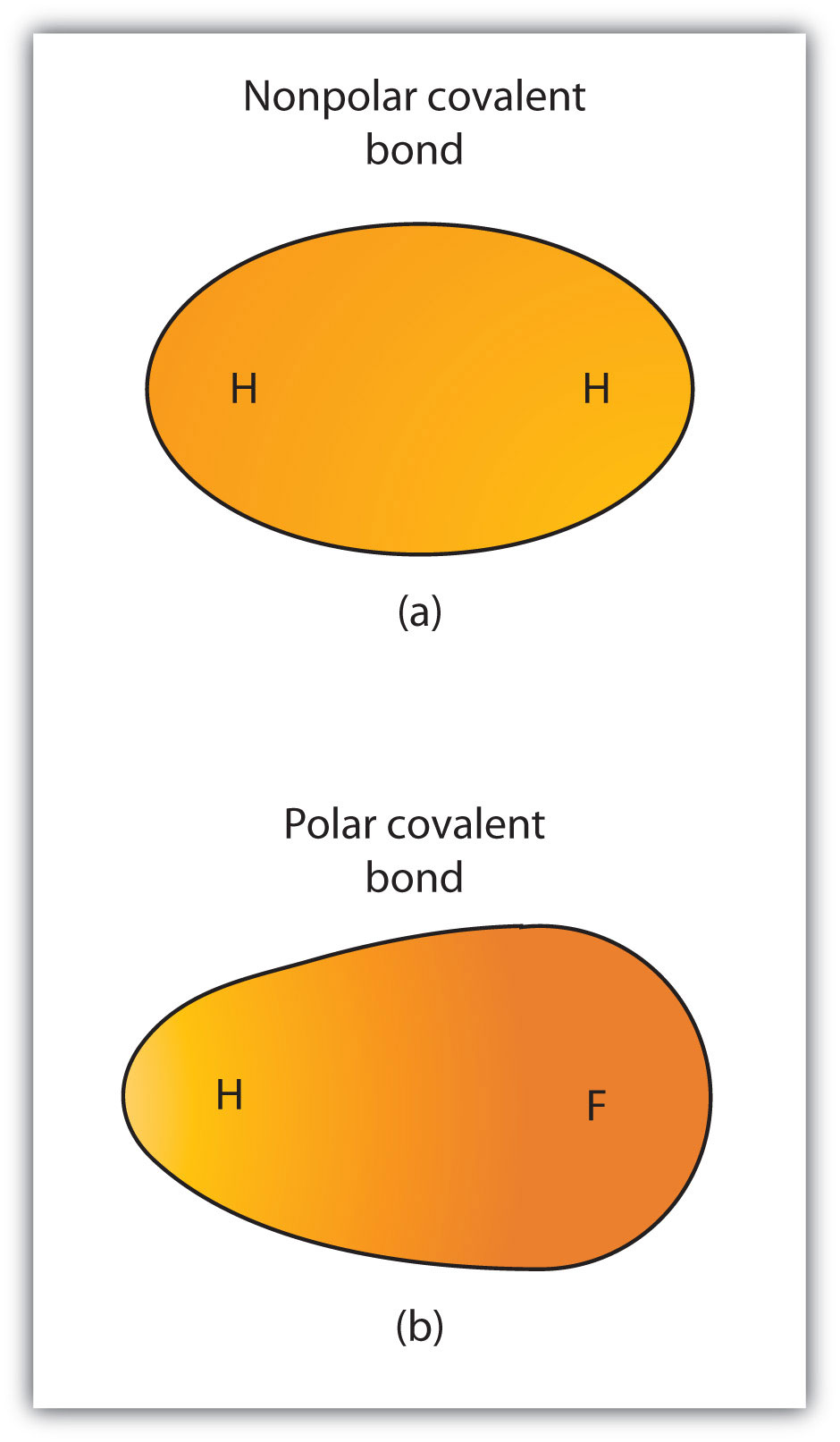
(a) elektrony v kovalentní vazby jsou stejně sdílí oba atomy vodíku. Jedná se o nepolární kovalentní vazbu. (b) atom fluoru přitahuje elektrony ve vazbě více než atom vodíku, což vede k nerovnováze v distribuci elektronů. Toto je polární kovalentní vazba.
jakákoli kovalentní vazba mezi atomy různých prvků je polární vazba, ale stupeň polarity se velmi liší. Některé vazby mezi různými prvky jsou pouze minimálně polární, zatímco jiné jsou silně polární. Iontové vazby lze považovat za nejvyšší polaritu, přičemž elektrony jsou přenášeny spíše než sdíleny. Posoudit relativní polaritu kovalentní vazby, chemici používají elektronegativitu relativní míra toho, jak silně atom přitahuje elektrony, když tvoří kovalentní vazbu., což je relativní míra toho, jak silně atom přitahuje elektrony, když vytváří kovalentní vazbu. Existují různé číselné stupnice pro hodnocení elektronegativity. Obrázek 4.4 „elektronegativita různých prvků“ ukazuje jednu z nejpopulárnějších-Paulingovu stupnici. Polaritu kovalentní vazby lze posoudit stanovením rozdílu v elektronegativitě dvou atomů tvořících vazbu. Čím větší je rozdíl v elektronegativitách, tím větší je nerovnováha sdílení elektronů ve vazbě. Ačkoli nejsou tam žádná tvrdá a rychlá pravidla, obecné pravidlo je, jestli rozdíl v electronegativities je méně než asi 0,4, vazba je považována za nepolární; je-li rozdíl větší než 0,4, vazba je považována za polární. Pokud je rozdíl v elektronegativitách dostatečně velký (obecně větší než asi 1,8), je výsledná sloučenina považována spíše za iontovou než kovalentní. Rozdíl elektronegativity nula samozřejmě označuje nepolární kovalentní vazbu.
obrázek 4.4 Electronegativities Různých Prvků
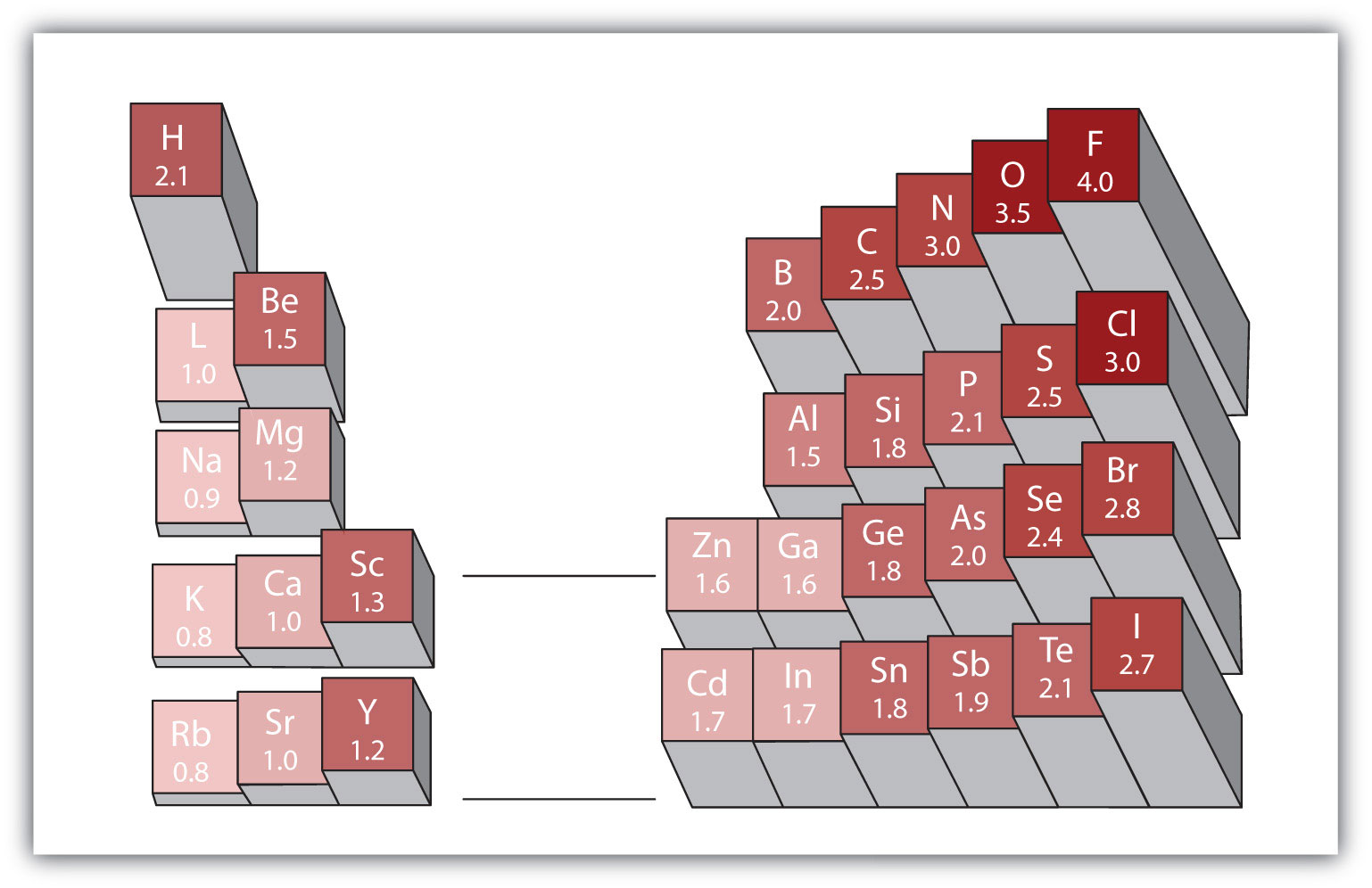
populární měřítko pro electronegativities má hodnotu pro atomy fluoru nastaven na 4.0, což je nejvyšší hodnota.
při Bližším Pohledu: Linus Pauling
Pravděpodobně nejvlivnější chemik 20. století, Linus Pauling (1901-94) je jediný, kdo vyhrál dva jednotlivce (to znamená, nesdílené) Nobelovy Ceny. Ve třicátých letech použil Pauling nové matematické teorie k vyjádření některých základních principů chemické vazby. Jeho kniha The Nature of the Chemical Bond z roku 1939 je jednou z nejvýznamnějších knih, jaké kdy v chemii vyšly.
v roce 1935 se Paulingův zájem obrátil na biologické molekuly a za svou práci na struktuře bílkovin získal Nobelovu cenu za chemii v roce 1954. (Byl velmi blízko k objevení struktury dvojité šroubovice DNA, když James Watson a James Crick oznámili svůj vlastní objev její struktury v roce 1953.) Mu byla později udělena Nobelova cena za mír z roku 1962 za jeho snahu zakázat testování jaderných zbraní.
v pozdějších letech se Pauling přesvědčil, že velké dávky vitaminu C zabrání nemocem, včetně běžného nachlazení. Většina klinických výzkumů neprokázala spojení, ale Pauling pokračoval v užívání velkých dávek denně. Zemřel v roce 1994, poté, co strávil celý život vytvářením vědeckého odkazu, který si málokdo bude rovnat.

Linus Pauling byl jedním z nejvlivnějších chemiků 20.století.
Příklad 6
Popište electronegativity rozdíl mezi každým párem atomů a výsledná polarita (nebo bond).
- C a H
- H a H
- Na a Cl
- O a H
Řešení
- Uhlík má elektronegativitu 2,5, zatímco hodnota pro vodík je 2.1. Rozdíl je 0,3, což je poměrně malé. Vazba C-H se proto považuje za nepolární.
- oba atomy vodíku mají stejnou hodnotu elektronegativity-2.1. Rozdíl je nulový, takže vazba je nepolární.
- elektronegativita sodíku je 0,9, zatímco chlor je 3,0. Rozdíl je 2,1, což je poměrně vysoké, a tak sodík a chlor tvoří iontovou sloučeninu.
- s 2,1 pro vodík a 3,5 pro kyslík je rozdíl elektronegativity 1,4. Očekávali bychom velmi polární vazbu, ale ne tak polární, že vazba O–H je považována za iontovou.
Dovednost-Budova Cvičení
-
C a O
-
K a Br
-
N a N
-
Uo a F
Popište electronegativity rozdíl mezi každým párem atomů a výsledná polarita (nebo bond).
Kdy molekuly jsou dluhopisy polární, molekula jako celek lze zobrazit nerovnoměrné rozložení náboje, v závislosti na tom, jak jednotlivé dluhopisy jsou orientované. Například, orientace dva O–H vazby v molekule vody (Obrázek 4.5 „Fyzikální Vlastnosti a Polarita“) je ohnutá: jeden konec molekuly má částečný kladný náboj a na druhém konci má parciální záporný náboj. Stručně řečeno, samotná molekula je polární. Polarita vody má obrovský dopad na její fyzikální a chemické vlastnosti. (Například teplota varu vody je pro tak malou molekulu vysoká a je způsobena skutečností, že polární molekuly se navzájem silně přitahují.) Naproti tomu, zatímco dvě vazby C=O v oxidu uhličitém jsou polární, leží přímo proti sobě, a tak navzájem ruší účinky. Molekuly oxidu uhličitého jsou tedy celkově nepolární. Tento nedostatek polarity ovlivňuje některé vlastnosti oxidu uhličitého. (Například oxid uhličitý se stává plynem při -77°C, což je téměř o 200° nižší než teplota, při které voda vaří.)
Obrázek 4.5 Fyzikální Vlastnosti a Polarita.

fyzikální vlastnosti vody a oxidu uhličitého jsou ovlivněny jejich polarit.
Concept Review cvičení
-
jaký je název pro vzdálenost mezi dvěma atomy v kovalentní vazbě?
-
Co znamená elektronegativita atomu?
-
jaký typ vazby vzniká mezi dvěma atomy, pokud je rozdíl v elektronegativitách malý? Střední? Velký?
Odpovědi
-
délka pouto
-
Elektronegativita je kvalitativní měřítko, jak moc atom přitahuje elektrony v kovalentní vazbě.
-
nepolární; polární; iontová
Klíčové Takeaways
- Kovalentní vazby mezi různými atomy mají různé bond délek.
- kovalentní vazby mohou být polární nebo nepolární, v závislosti na rozdílu elektronegativity mezi zúčastněnými atomy.
cvičení
-
která je delší–vazba C–H nebo vazba C-O? (Viz tabulka 4.2 „přibližné délky vazeb některých jednoduchých vazeb“.)
-
která je kratší-n-H vazba nebo C-H vazba? (Viz tabulka 4.2 „přibližné délky vazeb některých jednoduchých vazeb“.)
-
nanometr je 10-9 m. použití údajů v tabulce 4.2 „přibližné délky vazeb některých jednoduchých vazeb“a v tabulce 4.3 „porovnání délek vazeb pro jednoduché a vícenásobné vazby“, určete délku každé vazby v nanometrech.
- C–O vazby
- C=O vazby
- H–N vazby
- C≡N vazby
-
angstrom (Å) je definována jako 10-10 m. Pomocí Tabulky 4.2 „Přibližné Bond Délek Některé jednoduché Vazby“ a Tabulka 4.3 „Srovnání Bond Délek pro Jeden a Více Dluhopisů“, určit délku každého dluhopisu v nm.
- A C-C bond
- A C=C bond
- An N N N bond
- an H-O bond
- viz cvičení 3. Proč je nanometrová jednotka užitečná jako jednotka pro vyjádření délky vazby?
viz cvičení 4. Proč je angstromova jednotka užitečná jako jednotka pro vyjádření délky vazby?
pomocí obrázku 4.4″ elektronegativity různých prvků “ určete, který atom v každém páru má vyšší elektronegativitu.
- H nebo C
- O nebo Br
- Na nebo Rb
- já, nebo Cl
Pomocí Obrázku 4.4 „Electronegativities Různých Prvků“, zjistit, který atom v každé dvojici má nižší elektronegativitu.
- Mg nebo O
- nebo F
- Al nebo Ga
- O nebo já
Budou elektrony sdíleny rovnoměrně nebo nerovnoměrně po každé kovalentní vazby? Pokud je nerovnoměrně, ke kterému atomu jsou elektrony silněji přitahovány?
- C–O vazby
- F–F vazba
- S–N vazby
- I–Cl vazba
Budou elektrony sdíleny rovnoměrně nebo nerovnoměrně po každé kovalentní vazby? Pokud je nerovnoměrně, ke kterému atomu jsou elektrony silněji přitahovány?
- C–C vazby
- S–Cl vazba
- O–H vazba
- H–H vazba
Odpovědi
-
C–O vazba je delší.
-
- 0.143 nm
- 0.120 nm
- 0.100 nm
- 0.116 nm
-
skutečné délky vazby jsou velmi malé, takže jednotka nanometrů usnadňuje pochopení výrazu délky.
-
- C
- O
- Na
- Cl
-
- nerovnoměrně k O
- stejně
- nerovnoměrně k N
- nerovnoměrně směrem k Cl
