Zavedení inhibitor buněčného cyklu
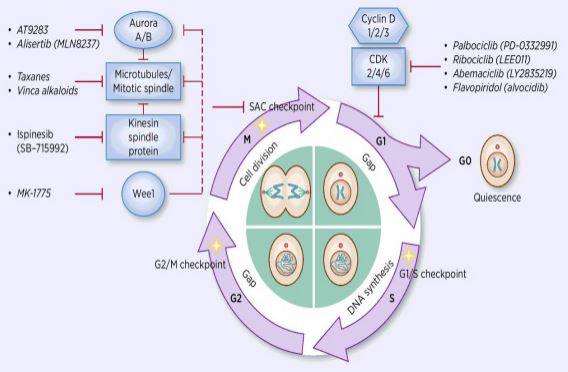
proces buněčného cyklu nařízení je aktivace nebo inaktivace různé regulační faktory pod dohledem kontrolních bodů, čímž zahájení procesu buněčné replikace DNA a rozdělení na dvě dceřiné buňky. Mezi mnoha regulátory buněčného cyklu je jádrem cyklin-dependentní kináza (CDK) a je to síťový systém, který reguluje buněčný cyklus inhibitory cyklin a cyklin-dependentní kinázy (CKIs). CDKs jsou třída serin/threonin kinázy, a v současné době 13 druhů se nacházejí, včetně CDK1~13, které hrají roli v buněčném cyklu regulace CDKs a transkripční regulace CDKs. Regulace buněčného cyklu je ve skutečnosti regulace kontrolních bodů, přičemž nejdůležitější jsou regulační body G1/S. Když buněčného cyklu je stimulována vnější signály, jako jsou růstové faktory, katalytické podjednotky CDK4/CDK6 se váže na regulační podjednotku CyclinD, a CDKs zbytky jsou aktivovány fosforylací/dephosphorylation. Po aktivaci CDK je protein Rb fosforylován. Rb gen, také známý jako retinoblastom genu, je první klonovaný tumor supresorový gen, a jeho schopnost tvořit komplex s transkripčními faktory (jako jsou E2F) po fosforylaci proteinu je ztracen. E2F hraje důležitou roli v buněčném cyklu nařízení a indukuje expresi CyclinE a CDK2 a tvoří CyclinE/CDK2 komplexem, který dále fosforyluje Rb protein a plně uvolní E2F. Následně, E2F vstupuje do jádra aktivovat řadu buněčných cyklů do S fáze. V pozdní fázi replikace DNA během S fáze, CDK2 je aktivován cyclinE, který inaktivuje transkripční faktor E2F v čase, prevenci apoptózy způsobené trvale aktivovány E2F. Výzkum statistiky ukazují, že více než 90% lidských nádorů mutace v souvisejících genech v CDK, Cyklin, CKI, a Rb cesty, s CDK a jeho odpovídající regulační podjednotku Cyklin je nejčastěji dysfunkční. Kromě toho kolísání buněčného cyklu podporuje rezistenci na chemoterapii a snižuje účinky chemoterapie. Regulace aktivity CDK / cyklinu, která obnovuje normální buněčný cyklus, je proto jednou ze strategií léčby nádorů.
inhibitory buněčného cyklu se nyní používají klinicky
výzkumníci léčiv se zaměřili na nalezení různých typů inhibitorů CDK a cyklinu jako špičkových protirakovinových léků. V současné době jsou inhibitory CDK rozděleny hlavně na endogenní a exogenní. Největší třída endogenní malé molekuly inhibitorů je nízkomolekulární proteiny, které jsou rozděleny do dvou širokých kategorií v závislosti na rozdíly ve strukturální funkce, a jedna třída se nazývá dual konkrétní rodiny INK4, včetně p15, p16, p18, p19, která inhibuje protein rodinu. Inhibiční-dependentní protein CyclinD-kinázy spojené se váže na odpovídající zdarma CDK4, a tím blokuje vazbu CDK4 na odpovídající cyclinD tvoří katalytické dimer komplexu. Druhá třída se nazývá rodina Kip, včetně P21, P27, P57. Tato rodina proteinů může tvořit trimer s dimerním komplexem složeným z cyklinu E/CDK2 a cykliny/CDK1 blokováním katalyticky aktivního centra dimeru. Inhibice těchto endogenních inhibitorů v kombinaci s komplexem kinázy specificky reguluje jeho aktivitu, čímž přesně reguluje transformaci buňky z fáze G1 do fáze S. Studie prokázaly, že výskyt a rozvoj mnohočetné nádory jsou spojeny se sníženou vyjádření CDKs/cyclins nebo snížené expresi endogenní inhibitory, jako jsou delece P16, který má vztah s rozvojem melanomu, rakoviny plic, rakoviny prsu a rakoviny tlustého střeva. Delece proteinu P27 je běžná u rakoviny prsu, rakoviny prostaty, rakoviny tlustého střeva a rakoviny gastrointestinálního traktu. Proto je delece endogenního inhibitoru CDKs nebo genové mutace důležitou referencí pro diagnostiku nádoru. Endogenní inhibitory malých molekul jsou také třídou důležitých nekódujících RNA objevených v posledních letech. Cílové stránky regionů svázat k sobě, aby rychle a efektivně degradovat mRNA nebo inhibují translaci proteinu, ovládání bílkovin na nižší nebo optimální úrovni a které vyžadují pro životní aktivity. Bylo objeveno více než 10 mikroRNA zapojených do regulace buněčného cyklu. Mezi nimi, miR1-2 a miR3-4 cíl CDK4, respektive, a buněčného cyklu je zatčen v G1 fázi, který inhibuje proliferaci nádorových buněk; miR-22 cíle CDK6 buněk. Cyklus stagnuje ve fázi G1, což vyvolává stárnutí v buňkách rakoviny prsu. V různých biologických procesech tyto Mirna regulují progresi buněčného cyklu cílením na E2F, CDK, cyklin, P21, P27, DNA polymerázu alfa atd. podporovat nebo blokovat klíčové regulátory buněčného cyklu. Mezi exogenní inhibitory patří antisense nukleové kyseliny, protilátky, malá interferující interference RNA (siRNA) a sloučeniny s malými molekulami. Sloučeniny s malými molekulami jsou nejdůležitější třídou exogenních inhibitorů CDK. V posledních letech, protože pochopení krystalové struktury umožňuje lidem provádět studie Molekulární simulace, byly učiněny průlomy při navrhování a vývoji vysoce účinných a selektivních studií chemických inhibitorů CDK. Lze říci, že takové sloučeniny mají každý den nové členy. V současné době, malé molekuly CDK inhibitory lze rozdělit do následujících 13 kategoriích, Roscovitine a Olomouc, Pyrimidinů (PD-033299), Flavonoidy (Flavopiridols), Thiazoles (SNS03), anthracenu a jeho deriváty (SU951), piperidone (Paullones), imidazopyridine, pyrazolopyridine (AZ703), pyrazines ( AT751), butyrolaktonu-1 (butyrolaktonu-1), scorpionine (UCN-01) a dalších dvou druhů. Do klinických studií vstoupilo třináct inhibitorů malých molekul. Jsou to všechny chemické látky s malými molekulami rovinných heterocyklů, které soutěží s ATP o vazbu na vazebné místo ATP CDK kinázy. In vivo experimenty ukázaly, že CYC202 má dobré lékové rezistence a dobré ústní fyziologickou aktivitu a má zřejmý inhibiční účinky na solidních nádorů u nahých myší inokulovaných lidské rakoviny tlustého střeva a rakoviny dělohy buňky. Do Fáze Ib studie 10 pacientů s vaječníků brali CYC pro více než 20 měsíců bez navýšení v nádoru nebo závažné léčbou související nežádoucí účinky, mezi které jednoho pacienta nádor se zmenšil o více než 30%, a u některých pacientů, kteří byli léčeni více než jeden rok, mají stabilní stav. Klinické studie fáze II zjistily, že samotný CYC202 má mírně horší účinek a je účinný v kombinaci s jinými chemoterapeutickými léky. Fázi IIb klinických studiích CYC202 v kombinaci s kapecitabinem pro léčbu rakoviny prsu, v kombinaci s 2,2-difluorodeoxycytidine nebo cisplatinou pro léčbu rakoviny plic a karcinom nosohltanu jsou také v plném proudu. Vývoj a aplikace malé molekuly RNA interference technologie, a proto je možné studovat genové exprese konkrétních zásah cílových molekul, a mnoho vědci začali zasahovat do syntézy CDK/Cyklin na genetické úrovni. Limaet al. transfektovaly CyclinE-cílení siRNA do Hep3B, HepG2, SNU449 (CyclinE zvýšená exprese) a HuH7 (CyclinE nadměrně exprimován) a zjistil, že CyclinE exprese byla snížena o 90% v buňkách. Syntéza DNA je významně snížena a buňky podléhají apoptóze. Galimberti et al. transfektovaly siRNA cílení CyclinE, CDK2, a CDK1 do myší buňky rakoviny plic, HOP-62, H-522 a H-23, respektive, a zjistil, že CyclinE/CDK2 může indukovat apoptózu a inhibují proliferaci rakovinných buněk plic. Snížil CDK1 výraz způsobené CDK1 siRNA interference způsobuje mobilní fáze zatčení a zpomaluje buněčnou proliferaci, zatímco CDK1 a CDK2 siRNA co-rušení vést k souběžné snížení CDK1 a CDK2 výraz, což způsobuje odpor v buněčného cyklu S a G2/M fází. Stagnace také vyvolala apoptózu buněk. Cao Yinfang a další úspěšné transfekce CDK2/CyclinE siRNA rekombinantního expresního vektoru do buněk HepG2 ukázal, že CDK2 a CyclinE mRNA exprese výrazně snížila, buněčný cyklus byl zatčen v S fázi, G1 fáze buněk výrazně zvýšil, kaspázy-3 zvýšenou aktivitu, buněk HepG2 památek, apoptózy a buněčného cyklu změny byly v souladu se snížením proliferace HepG2 spoustu buněk in vitro po transfekci.
funkce inhibitoru buněčného cyklu
s prohloubením porozumění důležité úloze regulace buněčného cyklu při tvorbě nádorů a apoptóze byla regulace buněčného cyklu dále studována v rezistenci na chemoterapii nádorů. Cyklin-dependentní kinázy (CDK), které hrají roli při řízení buněčného motoru během buněčného cyklu, jsou ideálními cíli pro terapii nádorů. Většina rakovinných buněk má aktivaci, nadměrnou expresi genu buněčného dělení (cdk) a defekty funkce CDKIs. Inhibitor CDK vykazuje přerušovací účinek, který inhibuje buněčný cyklus. V posledních letech se Cdki staly hlavním vrcholem léčby rakoviny, která inhibuje aktivitu CDK v buněčném cyklu. Řada klinických studií také ukázala, že jediná aplikace může mít mírné účinky. Avšak v kombinaci s tradičními cytotoxickými chemoterapeutickými léky může CDKIs významně zvýšit protinádorový účinek tradičních chemoterapeutických léků. Proto se výzkum protinádorových účinků léků CDKIs a dalších chemoterapeutických léků stal horkým místem v současné léčbě rezistence na nádor.
Odkaz
- Bendris N, Lemmers B, Blanchard J M Buněčného cyklu, cytoskeletu dynamiku a dále: mnoho funkcí cyclins a CDK inhibitory. Buněčný Cyklus. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt S G, et al. Cílení na nukleární kinázy v rakovině: vývoj inhibitorů kinázy buněčného cyklu. Farmakologie & Therapeutics. 2014, 142(2):258-269.
- Stone a, Sutherland R L, Musgrove E a. inhibitory kináz buněčného cyklu: nedávné pokroky a budoucí vyhlídky jako léčba rakoviny. Crit Rev Oncog. 2012, 17(2):175-198.
- Xu W, Mcarthur G. regulace buněčného cyklu a melanom. Aktuální Onkologické Zprávy. 2016, 18(6):34.
- Malumbres M, Barbacid m. buněčný cyklus, CDKs a rakovina: měnící se paradigma. Příroda Hodnotí Rakovinu. 2009, 9(3):153-166.
