

oxid uhličitý (CO2) je chemická sloučenina. Jedná se o plyn při pokojové teplotě. Je vyroben z jednoho uhlíku a dvou atomů kyslíku. Lidé a zvířata uvolňují oxid uhličitý, když vydechují. Také pokaždé, když se spálí něco organického (nebo se vytvoří oheň), vytváří oxid uhličitý. Rostliny používají oxid uhličitý k výrobě potravin. Tento proces se nazývá fotosyntéza. Vlastnosti oxidu uhličitého studoval skotský vědec Joseph Black v roce 1750.
oxid uhličitý je skleníkový plyn. Skleníkové plyny zachycují tepelnou energii. Skleníkové plyny mění klima a počasí na naší planetě, Zemi. Tomu se říká změna klimatu. Skleníkové plyny jsou příčinou globálního oteplování, zvýšení teploty povrchu Země.
biologická role
oxid uhličitý je konečný produkt v organismech, které získávají energii štěpením cukrů, tuků a aminokyselin kyslíkem jako součást svého metabolismu. Jedná se o proces známý jako buněčné dýchání. To zahrnuje všechny rostliny, zvířata, mnoho hub a některé bakterie. U vyšších zvířat oxid uhličitý cestuje v krvi z tkání těla do plic, kde je vydechován. Rostliny přijímají oxid uhličitý z atmosféry k použití při fotosyntéze.
Suchý led,
Suchý led, nebo pevný oxid uhličitý, je pevné skupenství z plynu CO2 pod -109.3 °F (-78.5°C). Suchý led se na zemi nevyskytuje přirozeně, ale je vyroben člověkem. Je bezbarvý. Lidé používají suchý led, aby se věci za studena, a aby nápoje šumivé, zabít gophers, a zmrazit bradavice. Pára suchého ledu způsobuje udušení a nakonec smrt. Při použití suchého ledu se doporučuje opatrnost a odborná pomoc.

Na obvyklé tlak to nebude tát z pevného na tekuté, ale místo změny přímo z pevného skupenství na plyn. Tomu se říká sublimace. Změní se přímo z pevné látky na plyn při jakékoli teplotě vyšší než extrémně nízké teploty. Suchý led sublimuje při normální teplotě vzduchu. Suchý led vystavený normálnímu vzduchu vydává plynný oxid uhličitý, který nemá barvu. Oxid uhličitý může být zkapalněn při tlaku nad 5,1 atmosféry.
plynný oxid uhličitý, který vychází ze suchého ledu, je tak chladný, že když se mísí se vzduchem, ochlazuje vodní páru ve vzduchu na mlhu, která vypadá jako hustý bílý kouř. Často se používá v divadle k vytvoření vzhledu mlhy nebo kouře.
izolace a výroba
chemici mohou získat oxid uhličitý z chladicího vzduchu. Říkají tomu destilace vzduchu. Tato metoda je neúčinná, protože velké množství vzduchu musí být chlazeno, aby se získalo malé množství CO2. Chemici mohou také použít několik různých chemických reakcí k oddělení oxidu uhličitého. Oxid uhličitý se vytváří při reakcích mezi většinou kyselin a většinou uhličitanů kovů. Například reakce mezi kyselinou chlorovodíkovou a uhličitan vápenatý (vápenec nebo křída) je oxid uhličitý.
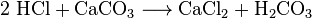
Na kyselinu uhličitou (H2CO3), pak se rozkládá na vodu a CO2. Takové reakce způsobují pěnění nebo bublání nebo obojí. V průmyslu se takové reakce mnohokrát používají k neutralizaci toků odpadních kyselin.
pálené vápno (CaO), chemická látka, která má široké použití, lze vyrobit zahříváním vápence na asi 850 °C. Tato reakce také dělá CO2:
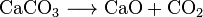
Oxid uhličitý je také ve spalovací všech uhlík obsahujících paliv, jako je metan (zemní plyn), ropné destiláty (benzín, nafta, petrolej, propan), uhlí nebo dřevo. Ve většině případů se také uvolňuje voda. Jako příklad chemické reakce mezi metanu a kyslíku je:
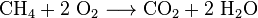
Oxid uhličitý se vyrábí v ocelárnách. Železo je snížena ze svých oxidů koksem do vysoké pece, výroba surového železa a oxidu uhličitého.

Kvasinky metabolizují cukr a vzniká oxid uhličitý a etanol, také známý jako alkohol, při výrobě vína, piva a jiných lihovin, ale také při výrobě bioethanolu:
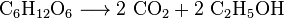
Všechny aerobní organismy vytvářet CO2 při oxidují sacharidy, mastné kyseliny a proteiny v mitochondriích buněk. Velký počet zapojených reakcí je mimořádně složitý a není snadno popsán. (Zahrnují buněčné dýchání, anaerobní dýchání a fotosyntézu). Photoautotrophs (tj. rostliny, sinice) použít další reakce: Rostliny absorbují CO2 ze vzduchu, a spolu s vodou, reagovat, tvořit sacharidy:
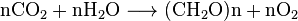
Oxid uhličitý je rozpustný ve vodě, v níž spontánně interconverts mezi CO2 a H2CO3 (kyselina uhličitá). Relativní koncentrace CO2, H2CO3 a deprotonovaných forem HCO−
3 (hydrogenuhličitan) a CO2−
3(uhličitan) závisí na kyselosti (pH). V neutrální nebo mírně zásadité vodě (pH > 6.5), hydrogenuhličitan forma převládá (>50%) se stal nejrozšířenější (>95%) na pH mořské vody, zatímco ve velmi alkalická voda (pH > 10.4) převládající (>50%) tvoří je uhličitan. Bikarbonátové a uhličitanové formy jsou velmi rozpustné. Vzduchově vyrovnaná oceánská voda (mírně alkalická s typickým pH = 8,2-8,5) obsahuje asi 120 mg hydrogenuhličitanu na litr.
průmyslová výroba
Průmyslový oxid uhličitý se vyrábí hlavně ze šesti procesů:
- zachycením přírodních pramenů oxidu uhličitého, kde se vyrábí působením okyselené vody na vápenec nebo dolomit.
- jako vedlejší produkt zařízení na výrobu vodíku, kde se metan přeměňuje na CO2;
- ze spalování fosilních paliv nebo dřeva;
- Jako vedlejší produkt kvašení cukru v pivovarnictví, whisky a jiné alkoholické nápoje;
- Z termický rozklad vápence CaCO3, ve výrobě vápna (oxidu Vápenatého, CaO);
Chemické reakce
Oxid uhličitý může být vytvořen pomocí jednoduché chemické reakce:
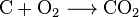 carbon + oxygen → carbon dioxide
carbon + oxygen → carbon dioxide
Images for kids
-

Crystal structure of dry ice
-

Pellets of „dry ice“, a common form of solid carbon dioxide
-

Carbon dioxide bubbles in a soft drink.
-

Dry ice used to preserve grapes after harvest.
-

Use of a CO2 fire extinguisher.
-

A carbon dioxide laser.
-

CO2 in Earth’s atmosphere if half of global-warming emissions are not absorbed.(NASA computer simulation).
-

Pterapod shell rozpuštěné v mořské vodě upraveny na oceán chemie předpokládá pro rok 2100.
-

Přehled fotosyntézy a dýchání. Oxid uhličitý (vpravo) spolu s vodou tvoří fotosyntézou kyslík a organické sloučeniny (vlevo), které mohou být dýchány na vodu a (CO2).
-

Rostoucí hladina CO2 hrozí Apolla 13, kteří se museli přizpůsobit kazety od velitelského modulu k napájení oxid uhličitý v lunárním modulu, který se používá jako záchranný člun.
-

CO2 concentration meter using a nondispersive infrared sensor
