Stručný popis dvou typů programované buněčné smrti-apoptózy a autofagie
Apoptóza, nebo typ I programované buněčné smrti, je nejvíce široce studoval formy buněčné smrti. Jeho morfologické vlastnosti mohou být identifikovány pod světelným mikroskopem, a patří mobilní smrštění, lisování chromatinu, blebbing cytoplazmatické membrány, a, konečně, vznik apoptotických těla (Obrázek 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
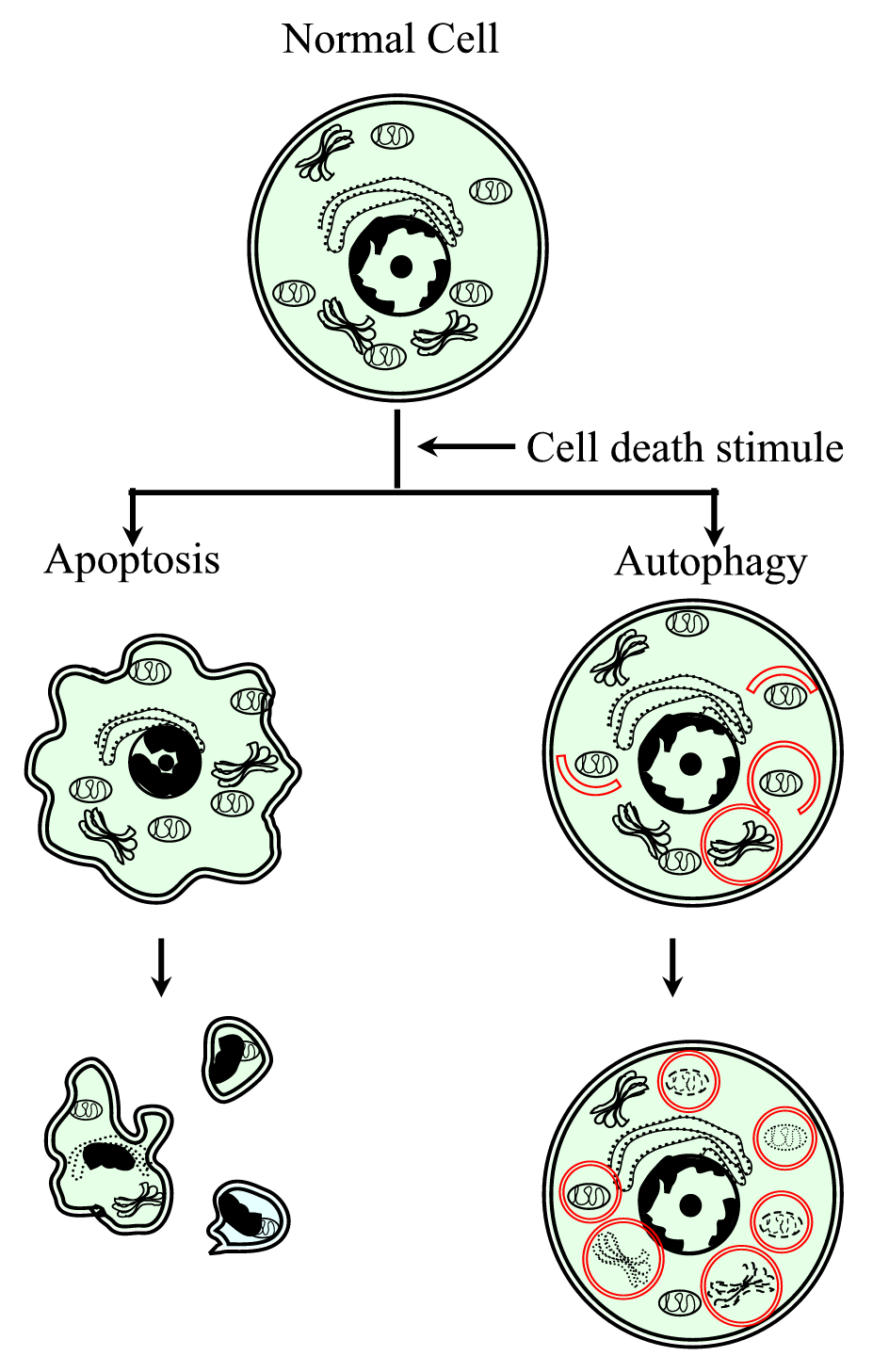
Figure 1.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi= „http://www.w3.org/2001/XMLSchema-instanceschematické znázornění procesu programované buněčné smrti typu I (apoptóza) a typu II (autofagie). Apoptóza je charakterizována buněčnou kontrakcí, zhutněním chromatinu, membránovými bleby a tvorbou apoptotických těl. Autofagie je charakterizována přítomností velkého počtu autofagosomů s cytoplazmatickým obsahem. Oba typy buněčné smrti nevyvolávají zánětlivou odpověď, protože cytoplazmatická membrána je zachována, dokud nejsou buněčné zbytky eliminovány sousedními nebo specializovanými.
Caspases jsou cysteinyl-aspartát-specifické proteázy, které jsou syntetizován v neaktivní formě jako zymogens tzv. pro-caspases (Obrázek 2). Tato neaktivní forma umožňuje řízené provádění procesu buněčné smrti. Kaspázy byly poprvé identifikovány u hlístic Ceanorhabditis elegans, ale homologní formy jsou přítomny u savců .
charakteristické znaky apoptózy, jako je fragmentace DNA a zhutněný chromatin, jsou výsledkem aktivity kaspázy. Během apoptózy je DNA fragmentována na velikost nukleosomu (200 bp). Faktor zodpovědný za fragmentaci DNA během apoptózy je specifické Dnázy (CAD, kaspázy aktivované Dnázy), který je aktivován aktivní kaspázy-3 . Aktivní kaspázy-3, v pořadí, se podílí na morfologické změny buněk během apoptózy, kde se štěpí rho-associated kinase-1 (ROCK-1) s cílem aktivovat a to, konečně, ovlivňuje cytoskeletární uspořádání způsobující apoptotických smrštění morfologie .

Číslo 2.
xmlns: xlink= „http://www.w3.org/1999/xlink “ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceCaspases zapojeny do apoptotických proces je syntetizován v neaktivní formě jako zymogens, jsou tvořena pro-domény, velkou podjednotku, a malé podjednotky. Zymogeny se aktivují a vytvářejí tetramery.
apoptotickou smrt buněk je vysoce regulována členové B-buněčného lymfomu 2 (Bcl-2) rodiny . Členové rodiny Bcl-2 byli klasifikováni jako antiapoptotické a proapoptotické proteiny podle jejich homologie Bcl-2 (BH)a organizace domény (obrázek 3). Přítomnost domén BH1, BH2, BH3 a BH4 odpovídá skupině, která inhibuje apoptózu. Pro-apoptotická skupina je naproti tomu rozdělena do dvou skupin: těch s doménami BH1, BH2 a BH3 a těch s doménami BH3 (definovanými pouze jako BH3; viz recenze v). Tato rodina proteinů plní své funkce na intracelulární úrovni uvnitř mitochondrií, což je klíčový prvek apoptózy.

Číslo 3.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi= „http://www.w3.org/2001/XMLSchema-instance B-buněčný lymfom 2 (Bcl-2) rodinné proteiny. A) obecná schematizace struktury proteinů Bcl-2. B) antiapoptotičtí členové-mají všechny čtyři domény BH. C) pro-apoptotické členy, které jsou zase rozděleny do dvou skupin: pouze multidomain a BH3.
apoptózu lze zahájit dvěma dobře popsanými cestami: vnější a vnitřní dráhy (obrázek 4). Vnější aktivace se provádí prostřednictvím účasti smrt ligandy (např. tumor nekrotizující faktor – TNF – nadčeleď, a TNF-související apoptózy indukované ligandy, nebo STOPA) s jejich příbuzný buněčné povrchové receptory smrti (jako TNF receptor 1, Fas, TRAIL receptor 1, nebo TRAIL receptor 2) (přezkoumána v ). Jakmile se ligand rozpozná a vazby na své receptory, série intracelulární komplexy jsou tvořeny aktivovat iniciátorem caspases (například -8 a -10), které pak aktivuje kata caspases (např. -3, -6 a -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. Ligand–receptor interakce indukuje montáž smrt indukující signální komplex (DISK) na podporu aktivace kaspázy-8, který je zase schopen aktivovat exekutor kaspázy -3, -6 nebo -7, provádění morfologické změny apoptózy. Vnitřní cesta je v režii mitochondriální vnější membrány permeabilization, který umožňuje uvolnění pro-apoptotických prvky, jako je cytochrom C, Cytochrom C indukuje apoptózu proteázy aktivující faktor 1 (Apaf-1) na podporu aktivace kaspázy-9 sestavit apoptosome. Apoptosom je schopen aktivovat kaspázy exekutora.
vnitřní apoptotických dráhy, v kontrastu, může být aktivován různými stimuly, včetně poškození DNA, růstový faktor hladovění, a oxidační stres . Během expozice buněk těmto podnětům jsou ovlivněny mitochondrie, protože je aktivováno několik členů rodiny Bcl-2 a podporuje permeabilizaci vnější membrány mitochondrií (MOMP). Prostoupená vnější mitochondriální membrána umožňuje uvolňování cytochromu c (cyt c), který je spojen s proteinem Apaf-1. Na cyt c a Apaf-1 unie pak dluhopisů iniciátorem kaspázy-9 tvoří komplex, který představuje apoptosome, který má schopnost aktivovat iniciátorem caspases, že plní své funkce tím, že štěpí specifické buněčné substráty.
druhý proces buněčné smrti autofagie, je geneticky naprogramován a evolučně zachovaných proces, který způsobuje degradaci zastaralé organely a proteiny. Aktivuje se takovými extracelulárními podněty, jako je hladovění živin, hypoxie, vysoká teplota a změněné intracelulární stavy, včetně akumulace poškozených nebo nadbytečných organel (přezkoumáno v ).
v eukaryotických organismech byly popsány tři typy autofagie: mikroautofagie, makroautofagie (běžně nazývaná jednoduše autofagie) a autofagie zprostředkovaná chaperonem (obrázek 5). Microautophagy zahrnuje zaplavovat cytoplazmatických komponent přímo na úrovni lysosome prostřednictvím invaginací proces, zatímco macroautophagy zahrnuje vytvoření dvojité membránové vezikuly, které obsahují buněčné složky, které se spojí s lyzosomem tvořit autophagolysosome. Uvnitř autofagolysozomu jsou intra-vezikulární složky degradovány a pokud možno recyklovány buňkou (přezkoumáno v ). Chaperonem zprostředkovaná autofagie nakonec zahrnuje účast chaperonů na rozpoznávání proteinů určených k eliminaci lysozomy .

Číslo 5.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceSchematické znázornění různých mechanismů autofagie. Macroautophagy – autofagie – znamená tvorbu dvojité membrány váčku, který pohlcuje cytoplazmatický obsah, který bude probíhat na lysosome, které mají být degradovány. Mikroautofagie je charakterizována přímým pohlcením cytoplazmatických složek lysozomem. Tento proces zahrnuje remodelaci membrány organely vytvořením invaginace lysozomální membrány. Během garde-zprostředkovaná autofagie proteiny, které mají být degradovány, jsou cílené pro Hsp70, což dopravy cíl nákladu na lysosome.
Autofagie je v režii Atg(Autofagie) geny, které jsou nutné k aktivaci signalizační komplex, který spouští tvorbu autophagosomes . Atggeny byly objeveny v kvasinkách, ale mnoho z nich má ortology ve vyšších eukaryotách (obrázek 6). Autophagosome tvorba zahrnuje účast na cytoplazmatický protein LC3 (Atg8), která prochází lipidation tím, fosfatidylethanolaminu, a je pak přijati do rodící se autophagosome membrány (Obrázek 7). Akumulace lipidovaného proteinu LC3 (známého jako LC3-II) se používá jako marker autofagie .

Obr. 6.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. Protein LC3 je lipidován fosfatidylethanolaminem.
Autofagická buněčná smrt nebo programovaná buněčná smrt typu II je charakterizována masivním pohlcením cytoplazmy autofagickými vezikuly. Tato intenzivní autofagická aktivita se podstatně liší od autofagie, která se vyskytuje nepřetržitě na bazálních úrovních. Ultrastrukturální studie u Drosophily odhalily akumulaci autofagických vakuol ve většině larválních tkání. Tento typ programované buněčné smrti začíná degradace cytoplazmatických organel prostřednictvím autofagie, když cytoskeletální elementy jsou zachovány až do pozdních fázích procesu (přezkoumána v ).
