Cíle Vzdělávání
- Popsat základní strukturu aminokyseliny
- Popsat chemické struktury proteinů
- Shrnout jedinečné vlastnosti proteinů
Na začátku této kapitoly, slavný experiment byl popsán v nichž vědci syntetizovány aminokyseliny za podmínek simulující přítomné na zemi dlouho předtím, než vývoj života, jak ho známe. Tyto sloučeniny jsou schopné spojování spolu v podstatě jakékoli číslo, poddajný molekul v podstatě jakékoli velikosti, které mají širokou škálu fyzikálních a chemických vlastnostech a provádět řadu funkcí životně důležité pro všechny organismy. Molekuly odvozené od aminokyselin může fungovat jako strukturální složky buněk a subcelulární subjekty, jako zdroje živin, jako je atom a energetické zásobníky, a jako funkční druhů, jako jsou hormony, enzymy, receptory, transportní molekuly.
Aminokyselin a Peptid Dluhopisy

Obrázek 1.
aminokyselina je organická molekula, ve které jsou atom vodíku, karboxylová skupina (–COOH) a aminoskupina (–NH2) vázány na stejný atom uhlíku, tzv. Čtvrtá skupina vázané na α uhlíku se liší mezi různými aminokyselin a je nazýván zbytky nebo vedlejší řetězce, zastupuje v strukturní vzorce písmenem R. zbytek je monomer, která vzniká, když dvě nebo více aminokyselin kombinovat a odstranit molekuly vody. Primární struktura proteinu, peptidového řetězce, je tvořena aminokyselinovými zbytky. Jedinečné vlastnosti funkčních skupin a R skupin, aby tyto komponenty aminokyseliny a tvoří vodíkové, iontové, a disulfidové vazby, spolu s polární/nepolární interakce potřebné k vytvoření sekundární, terciární a kvartérní struktury bílkovin. Tyto skupiny jsou složeny převážně z uhlíku, vodík, kyslík, dusík, a síra, ve formě uhlovodíků, kyseliny, amidy, alkoholy, a aminy. Několik příkladů ilustrujících tyto možnosti je uvedeno na obrázku 1.
aminokyseliny se mohou chemicky spojit reakcí skupiny karboxylových kyselin jedné molekuly s aminovou skupinou druhé. Tato reakce vytváří peptidovou vazbu a molekulu vody a je dalším příkladem syntézy dehydratace (Obrázek 2). Molekuly tvoří chemicky propojení relativně skromný počet aminokyselin (přibližně 50 nebo méně), se nazývají peptidy, a předpony jsou často používány k určení těchto čísel: dipeptidů (dvě aminokyseliny), tripeptidy (tři aminokyseliny), a tak dále. Obecněji je určen přibližný počet aminokyselin: oligopeptidy vznikají spojením až přibližně 20 aminokyselin, zatímco polypeptidy jsou syntetizovány až z přibližně 50 aminokyselin. Když se počet aminokyselin spojených dohromady stává velmi velkým nebo když se jako stavební podjednotky používá více polypeptidů, výsledné makromolekuly se nazývají proteiny. Plynule proměnné délky (počet monomerů) z těchto biopolymerů, spolu s řadou možných R. skupin na jednotlivé aminokyseliny, umožňuje téměř neomezenou rozmanitost v typech proteinů, které mohou být vytvořeny.

Obrázek 2. Tvorba peptidové vazby je dehydratační syntézní reakce. Karboxylová skupina první aminokyseliny (alanin) je spojena s aminoskupinou příchozí druhé aminokyseliny (alanin). V tomto procesu se uvolní molekula vody.
Přemýšlejte o tom
- kolik aminokyselin je v polypeptidech?
Proteinové Struktury
velikost (délka) a specifické aminokyselinové sekvence proteinu jsou hlavní determinanty jeho tvar, a tvar bílkovin je rozhodující pro jejich funkci. Například, v procesu biologické fixace dusíku (viz Biogeochemické Cykly), půdních mikroorganismů kolektivně známý jako rhizobia symbioticky komunikovat s kořeny luštěnin rostlin, jako jsou sojové boby, arašídy, nebo fazole tvořit nové struktury, zvané uzlík na kořeny rostlin. Rostlina pak produkuje nosný protein zvaný leghemoglobin, protein, který nese dusík nebo kyslík. Leghemoglobin váže s velmi vysokou afinitou k substrátu kyslíku v určité oblasti proteinu, kde tvar a sekvence aminokyselin, jsou vhodné (aktivní místo). Pokud se tvar nebo chemické prostředí aktivního místa změní, i když mírně, substrát nemusí být schopen se vázat tak silně, nebo se nemusí vůbec vázat. Aby byl protein plně aktivní, musí mít vhodný tvar pro svou funkci.
proteinová struktura je rozdělena do čtyř úrovní: primární, sekundární, terciární a kvartérní. Primární struktura je jednoduše sekvence aminokyselin, které tvoří polypeptidový řetězec. Obrázek 3 zobrazuje primární strukturu proteinu.
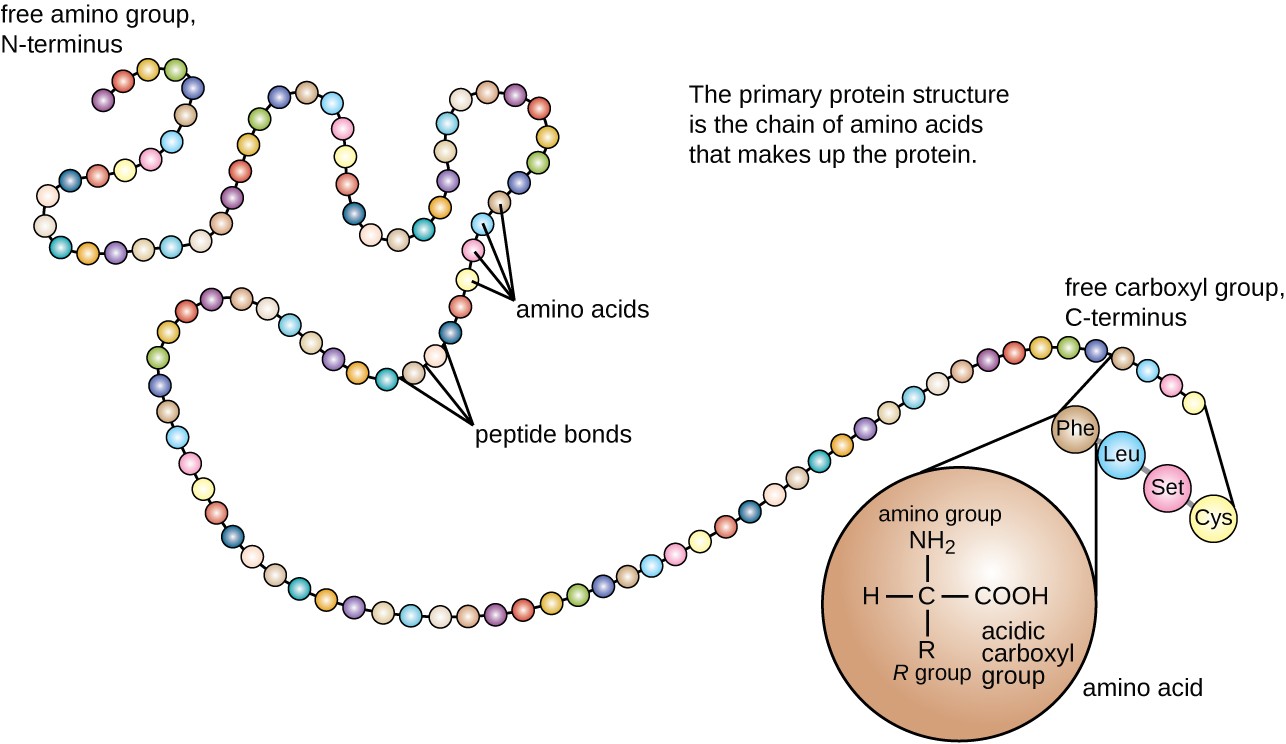
obrázek 3. Kliknutím zobrazíte větší obrázek. Primární strukturou proteinu je sekvence aminokyselin. (credit: změna práce National Human Genome Research Institute)
řetězce aminokyselin, které definuje bílkovin primární struktura není pevná, ale místo toho je flexibilní vzhledem k povaze dluhopisů, které drží aminokyselin dohromady. Když řetěz je dostatečně dlouhý, vodíkové vazby může dojít mezi aminem a karbonylové funkční skupiny v rámci peptidové páteře (s výjimkou R. straně skupiny), což vede k lokalizované skládání polypeptidového řetězce do šroubovice a listy. Tyto tvary tvoří sekundární strukturu proteinu. Nejběžnějšími sekundárními strukturami jsou α-šroubovice a β-skládaný list. Ve struktuře α-šroubovice je spirála držena vodíkovými vazbami mezi atomem kyslíku v karbonylové skupině jedné aminokyseliny a atomem vodíku aminoskupiny, která je jen čtyři aminokyselinové jednotky dále podél řetězce. V β-skládaný list, záhyby jsou tvořeny podobné vodíkových vazeb mezi kontinuální sekvence, karbonylových a aminových skupin, které jsou dále odděleny na páteř polypeptidového řetězce (Obrázek 4).

obrázek 4. Sekundární struktura proteinu může být α-šroubovice nebo β-skládaný list nebo obojí.
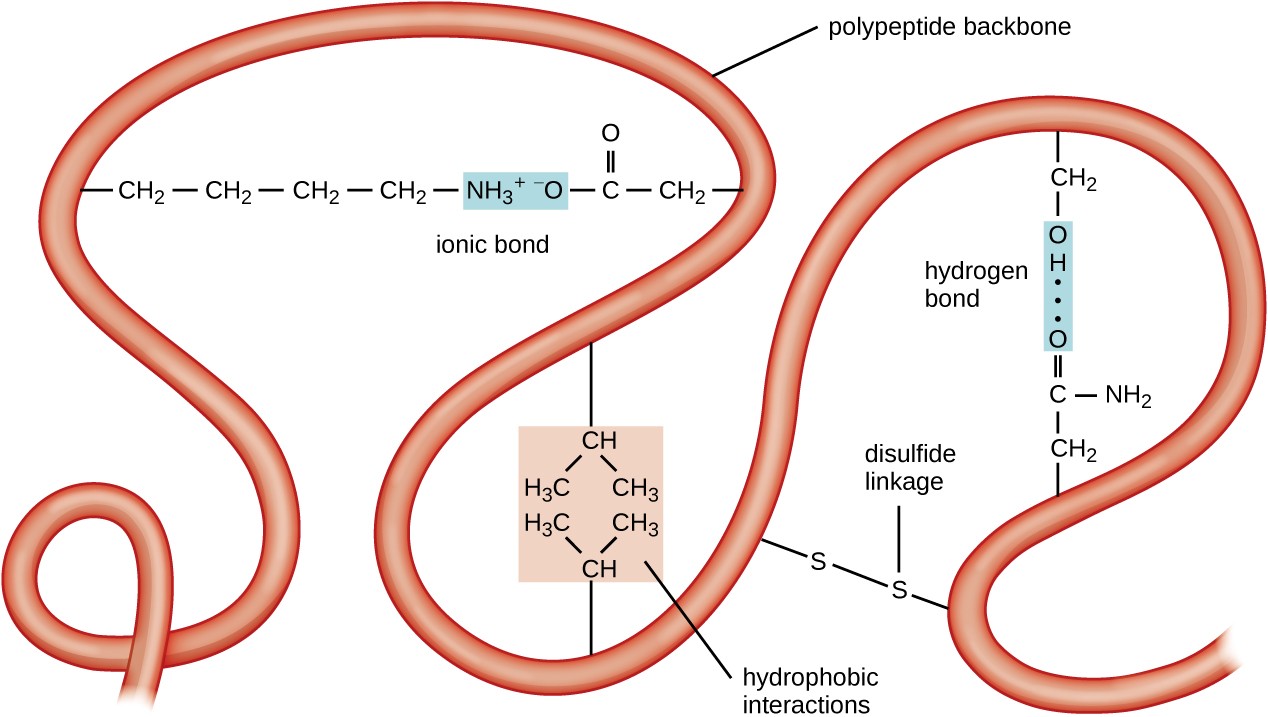
obrázek 5. Kliknutím zobrazíte větší obrázek. Terciární struktura proteinů je dána celou řadou atraktivních sil, včetně hydrofobní interakce, iontové vazby, vodíkové vazby, disulfidové vazby.
Další úrovní organizace proteinů je terciární struktura, což je rozsáhlý trojrozměrný tvar jediného polypeptidového řetězce. Terciární struktura je určena interakcemi mezi aminokyselinovými zbytky, které jsou v řetězci daleko od sebe. Různé interakce dávají vzniknout proteinu terciární strukturu, jako disulfidové můstky, které jsou vazby mezi sulfhydrylové (–SH) funkční skupiny na amino kyseliny straně skupiny; vodíkové vazby, iontové vazby, a hydrofobní interakce mezi nepolární vedlejší řetězce. Všechny tyto interakce, slabé a silné, se kombinují k určení konečného trojrozměrného tvaru proteinu a jeho funkce (Obrázek 5).
proces, kterým polypeptidový řetězec přebírá rozsáhlý trojrozměrný tvar, se nazývá skládání bílkovin. O složených proteinech, které jsou plně funkční ve své normální biologické roli, se říká, že mají nativní strukturu. Když protein ztratí svůj trojrozměrný tvar, nemusí již být funkční. Tyto rozložené proteiny jsou denaturovány. Denaturace znamená ztrátu sekundární struktury a terciární struktury (a pokud je přítomna, kvartérní struktura) bez ztráty primární struktury.
některé proteiny jsou sestavy několika samostatných polypeptidů, také známých jako proteinové podjednotky. Tyto proteiny fungují adekvátně pouze tehdy, jsou-li přítomny všechny podjednotky a vhodně nakonfigurovány. Interakce, které drží tyto podjednotky pohromadě, tvoří kvartérní strukturu proteinu. Celková kvartérní struktura je stabilizována relativně slabými interakcemi. Hemoglobin má například kvartérní strukturu čtyř globulárních proteinových podjednotek: dva α a dva β polypeptidy, z nichž každý obsahuje hem na bázi železa (obrázek 6).

obrázek 6. Molekula hemoglobinu má dva α a dva β polypeptidy spolu se čtyřmi hem skupinami.
Další důležitou třídou proteinů jsou konjugované proteiny, které mají neproteinovou část. Pokud má konjugovaný protein připojený uhlohydrát, nazývá se glykoprotein. Pokud má lipid připojený, nazývá se lipoprotein. Tyto proteiny jsou důležitými složkami membrán. Obrázek 7 shrnuje čtyři úrovně proteinové struktury.

Obrázek 7. Proteinová struktura má čtyři úrovně organizace. (credit: změna práce National Human Genome Research Institute)
- Co se může stát v případě, že protein je primární, sekundární, terciární nebo kvarterní struktura se změnila?
Primární Struktura, Nefunkční Proteiny, a Cystické Fibrózy

Obrázek 8. Kliknutím zobrazíte větší obrázek. Normální protein CFTR je kanálový protein, který pomáhá soli (chloridu sodného) pohybovat se dovnitř a ven z buněk.
proteiny spojené s biologickými membránami jsou klasifikovány jako vnější nebo vnitřní. Vnější proteiny, nazývané také periferní proteiny, jsou volně spojeny s jednou stranou membrány. Vnitřní proteiny nebo integrální proteiny jsou zabudovány do membrány a často fungují jako součást transportních systémů jako transmembránové proteiny. Cystická fibróza (CF) je lidská genetická porucha způsobená změnou transmembránového proteinu. Postihuje většinou plíce, ale může také ovlivnit slinivku břišní, játra, ledviny a střeva. CF je způsobena ztrátou aminokyseliny fenylalaninu v transmembránovém proteinu cystické fibrózy (CFTR). Ztráta jedné aminokyseliny mění primární strukturu proteinu, který normálně pomáhá transportovat sůl a vodu dovnitř a ven z buněk (Obrázek 8).
změna v primární struktuře zabraňuje bílkovin z fungují správně, což způsobuje, že tělo produkovat neobvykle hustý hlen, který ucpává plíce a vede k hromadění lepkavé hlenu. Hlen brání slinivce břišní a zastavuje přirozené enzymy, které pomáhají tělu rozkládat jídlo a absorbovat životně důležité živiny.
v plicích jedinců s cystickou fibrózou poskytuje změněný hlen prostředí, kde mohou bakterie prospívat. Tato kolonizace vede k tvorbě biofilmů v malých dýchacích cestách plic. Nejčastější patogeny nalezeny v plicích pacientů s cystickou fibrózou jsou Pseudomonas aeruginosa (Obrázek 9a) a Burkholderia cepacia. Pseudomonas se rozlišuje v biofilmu v plicích a tvoří velké kolonie, nazývané“ mukoidní “ Pseudomonas. Kolonie mají jedinečnou pigmentaci, která se objevuje v laboratorních testech (obrázek 9b) a poskytuje lékařům první vodítko, že pacient má CF(takové kolonie jsou u zdravých jedinců vzácné).

obrázek 9. a) skenovací elektronový mikrograf ukazuje oportunní bakterie Pseudomonas aeruginosa. b) pigment produkující P. aeruginosa na cetrimidovém agaru ukazuje zelený pigment zvaný pyokyanin. (credit a: modifikace práce Centra pro kontrolu a prevenci nemocí)
klíčové pojmy a shrnutí
- aminokyseliny jsou malé molekuly nezbytné pro veškerý život. Každý z nich má α uhlík, na který je vázán atom vodíku, karboxylová skupina a aminová skupina. Čtvrtý lepené skupina, zastoupená R, se liší v chemickém složení, velikost, polarita a náboj mezi různými aminokyselin, poskytuje variace ve vlastnostech.
- peptidy jsou polymery tvořené vazbou aminokyselin prostřednictvím dehydratační syntézy. Vazby mezi Spojenými aminokyselinami se nazývají peptidové vazby. Počet aminokyselin spojených dohromady se může lišit od několika do mnoha.
- proteiny jsou polymery tvořené vazbou velmi velkého počtu aminokyselin. Vykonávají mnoho důležitých funkcí v buňce, slouží jako živiny a enzymy; akumulační molekuly pro uhlík, dusík a energii; a strukturální složky.
- struktura proteinu je kritickým determinantem jeho funkce a je popsána odstupňovanou klasifikací: primární, sekundární, terciární a kvartérní. Nativní struktura proteinu může být narušena denaturací, což má za následek ztrátu struktury vyššího řádu a jeho biologické funkce.
- Některé proteiny jsou tvořeny několika samostatných bílkovinných podjednotek, interakce těchto podjednotek tvořících kvartérní struktury proteinu komplexu.
- konjugované proteiny mají nepolypeptidovou část, která může být uhlohydrát (tvořící glykoprotein) nebo lipidová frakce (tvořící lipoprotein). Tyto proteiny jsou důležitými složkami membrán.
Multiple Choice
která z následujících skupin se liší mezi různými aminokyselinami?
- atom vodíku
- karboxylovou skupinu
- R. group
- amino skupinou,
aminokyseliny přítomné v proteinech se liší ve které z následujících?
- velikosti
- tvar
- skupiny
- všechny výše uvedené
které z následujících vazeb nejsou zapojeny do terciární struktury?
- peptidové vazby
- iontové vazby
- hydrofobní interakce
- vodíkových vazeb
Vyplňte prázdné místo
sekvence aminokyselin v proteinu se nazývá jeho __________.
Denaturace znamená ztrátu __________ a __________ struktury bez ztráty __________ struktura.
True / False
změna jedné aminokyseliny v proteinové sekvenci má vždy za následek ztrátu funkce.
- Topení protein dostatečně, může způsobit to, aby došlo k denaturaci. Vzhledem k definici denaturace, co toto tvrzení říká o silách peptidových vazeb ve srovnání s vodíkovými vazbami?
- zobrazený obrázek představuje tetrapeptid.

- kolik peptidových vazeb je v této molekule?
- Identifikujte vedlejší skupiny čtyř aminokyselin tvořících tento peptid.
