Úvod
Cytotoxické buňky jsou nedílnou součástí v boji proti virové infikovaných a nádorových buněk. Tyto buňky zabíjejí třemi různými cestami, uvolňováním lytických granulí, cestou FAS receptor-ligand nebo cestou TRAIL–TRAIL receptoru. Pro účely tohoto článku se zaměříme na degranulaci. Když cytotoxická buňka narazí na cílovou buňku, pevně k ní přilne a vytvoří imunitní synapse. Lytické granule jsou pak polarizovány směrem k imunologické synapse a uvolněny z cytotoxické buňky směřující k cíli (1). Tyto granule obsahují různé cytotoxické mediátory, jako je perforin a granzymy. Uvolněný perforin může vytvářet přechodné póry v membráně cílové buňky, což umožňuje granzymům vstoupit do cílové buňky. Vstup je pravděpodobně také zprostředkované perforin oligomery tvoří neúplné póry (oblouky) (2), a to také bylo navrhl, že granzymes a perforinu může být užíván až do cílové buňky prostřednictvím endosomal cesta (3, 4). Údaje za těmito navrhovanými mechanismy byly nedávno podrobně diskutovány (5). Když granzymy vstupují do cílových buněk, aktivuje se kaspázová dráha, která vede k apoptóze (6, 7). Membrána těchto cytotoxických granulí obsahuje lysozomálně asociovaný membránový glykoprotein-1 (LAMP1), známý také jako CD107a (8). Luminální část potkaního CD107a je po degranulaci přechodně vystavena extracelulární straně buněčné membrány, než je znovu internalizována. Proto barvení CD107a naznačuje, že došlo k degranulační události (9). Zatímco role pro CD107a je stále odhodlaný, studium siRNA proti CD107a ukázaly, že je nezbytné pro perforin obchodování s lidmi v rámci váčků, jako dodání perforin lytickou granule je inhibována v nepřítomnosti CD107a (10). Bylo také prokázáno, že CD107a má úlohu při ochraně cytotoxických buněk před smrtí vazbou na perforin a zabráněním vložení do buněčné membrány (11).
Existují dva hlavní typy cytotoxických lymfocytů, nk buněk (NK) a CD8 T buňky. Oba typy buněk zabíjejí uvolňováním lytických granulí, dráhy FAS receptoru / Fas ligandu a dráhy TRAIL/TRAIL receptoru, ale stimul nezbytný k aktivaci těchto dvou buněčných skupin je odlišný. T buňky rozpoznávají antigeny prezentované MHC třídy I molekuly prostřednictvím jejich aktivace T-buněčný receptor (TCR), zatímco NK buňky rozpoznávají cílové buňky antigeny i když různé inhibiční a aktivační receptory. Inhibiční receptory jsou důležité pro prevenci NK buněk v zabíjení zdravých buněk, zatímco aktivace receptorů indukuje cytotoxicitu NK buněk.
před identifikací CD107a jako markeru degranulace v NK buňkách (12) byla výstupem pro měření cytotoxické schopnosti smrt cílových buněk. Detekce CD107a průtokovou cytometrií umožnila vědcům identifikovat specifické efektorové buňky s cytotoxickou schopností. Od svého objevu byla dokončena široká škála publikací údajů ze studií na myších a lidech, které ukazují výhodu použití protilátky proti CD107a. Krysa je cenným imunologickým zvířecím modelem pro studium nemocí, jako je leukémie a štěp vs. hostiteli (13), ale funkční odečty brzdí nedostatek kvalitních specifických anti-rat CD107a protilátky pro průtokovou cytometrii. Tento článek popisuje vytvoření protilátky proti krysím CD107a a charakterizaci degranulační odpovědi u potkaních NK a CD8+ T buněk.
materiály a metody
Zvířata
arménští inbrední křečci (Cytogen Research and Development Inc., MA, USA) byly umístěny na oddělení srovnávací medicíny ve Fakultní nemocnici Rikshospitalet v Oslu v souladu s institucionálními pokyny. Krysa kmeny PVG-RT1U, PVG-RT7b, PVG-RT1N, a PVG-R23 byly použity zaměnitelně a udržován po více než 20 generací a sídlí v souladu s pokyny stanovené Experimentální Zvíře Deska pod Ministerstvo Zemědělství Norska a Evropské Úmluvy na Ochranu Obratlovců používaných pro Pokusné a Jiné Vědecké Účely. Krysy byly používány ve věku 8-12 týdnů. Zařízení pro laboratorní zvířata jsou podrobena rutinnímu programu sledování zdraví a testována na infekční organismy podle modifikace doporučení federace Evropské asociace laboratorních zvířat. Pokusy na zvířatech byly regulovány laboratorními předpisy, které stanoví zákon o dobrých životních podmínkách zvířat, ve kterém Norsko sleduje směr laboratoře EU a Evropskou laboratorní úmluvu.
Abs a činidla
protilátky proti NKp46, NKR-P1A 3.2.3-PB, nebo nekonjugovaný (závazné pouze NKR-P1A, ale ne NKR-P1B, v PVG kmen), CD8 (OX8-biotin), CD2 (OX34, nekonjugovaný), TCR (R73-Alexa647), myš IgD b allotype (TIB96-nekonjugovaný, který se používá jako myš IgG izotypů), a průkazu cd45.2 (His41-FITC, který se používá jako myš IgG izotypů) byly provedeny v naší laboratoři a konjugované podle standardních protokolů. Protilátky proti CD3 (IF4, nekonjugovaný) a jeho izotypů mouse IgM (MM-30, nekonjugovaný) a arménské hamster IgG izotypů ovládání (HTK88-FITC) byly zakoupeny od Biolegend (San Diego, CA, USA). Komerční anti-CD107a protilátky byly zakoupeny od AbCam (Cambridge, UK) (H4A3-FITC), eBioscience (San Diego, CA, USA) (ID48-PerCP-eFluor) a Životnost (Seattle, WA, USA) (LS-C8580-nekonjugovaný). LS-C8580 byl konjugován s Alexa488 NHS ester (Sigma-Aldrich, St. Louis, MO, USA) pro použití ve funkčních testech. Anti-FLAG protilátkou (M2, nekonjugovaný) a anti-myší IgG (kozí polyklonální-FITC) byly zakoupeny od Sigma-Aldrich (St. Louis, MO, USA). IL-2 byl získán z dialyzovaného supernatantu buněčné kultury buněčné linie vaječníku čínského křečka (CHO) stabilně transfektovaného expresním konstruktem potkana IL-2. Peridinin-Chlorofyl-Protein (PerCP) konjugovaný streptavidin, FITC hamster IgG polyklonální izotypů kontrolu FITC myší IgG1 izotypů ovládání (MOPC-FITC), a GolgiStop byly zakoupeny od BD biosciences (Franklin Lakes, NJ, USA). Kozí anti-Arménský křeček (polyklonal-FITC)byl zakoupen od Jackson Immunoresearch(West Grove, PA, USA). Supernatanty z hybridomas OX41, CD172a (SIRPa), R73 (anti-rat TCRaß), OX19 (anti-CD5), OX12 (anti-Igk řetězce), a OX33 (anti-CD45RA) byly vyrobeny in-house. Kontrolní křeččí sérum bylo odvozeno od neimunizovaných arménských křečků.
Klonování potkana CD107a
Krysa CD107a byl pomocí PCR amplifikován z cDNA vytvořené z PVG krysa splenocytes a subcloned do pMX expresní vektor obsahující puromycinu gen rezistence (štědrý dar od Dr. Michael R. Daws) (14). Primery CD107 byly navrženy na základě sekvence cDNA cd107a (LAMP1) potkanů (GenBank: NM_012857). Forward primer: 5′ – GCCCCAGCACTGTTCGAGGT-3′; reverzní primer: 5 ‚- GTTGTTACCGTCCTGTACACACT-3‘. O aniontové trypsin-1 leader peptid (MSALLILALVGAAVA) byl použit expresní vektor, a původní CD107 transmembránový region byl nahrazen CD8 transmembránový fragment usnadnit vysoká povrchová exprese. FLAG-tag (DYKDDDDK) byl ligován na N-terminál proteinu CD107, aby byla povrchová exprese detekovatelná. Všechny vložené sekvence a otevřený čtecí rámec ve finále chimerického plasmidu konstrukci byly zkoumány a potvrzeny Sanger sekvenování DNA.
transfekce BWZ.36 Buňky s pMX-CD107a Plasmidu
293T buňky byly nasazeny do 6-destičky pro kultivaci buněk s 4 ml RPMI 1640 médiu, transfektovaly s 7.5 µl FuGENE6 reagent (Roche, výrobce protocol) a inkubovány při 37°C s 5% CO2. Na FuGENE6 činidla byl pre-zředěný s Opti-MEM (Gibco) a smíchá s 1,5 µg pMX-CD107a plasmidu a 1 µg pCL-ECO hlodavce konkrétní retrovirální balení plasmidu (Addgene #12371). Dvacet čtyři hodin po transfekci byl supernatant odvápněn a nahrazen médiem RPMI1640 s 2% FBS a převeden na 32°C pro retrovirovou produkci. O čtyřicet osm hodin později byl supernatant sklizen a filtrován filtrem Filtropur s o velikosti 0,2 µm (Sarstedt) a uložen při -80°C pro retrovirovou transdukci.
105 BWZ.36 buňky byly nasazeny na dobře do 24jamkové destičky pro kultivaci buněk (Corning) a kultivovány s čerstvým RPMI1640 médiu s 10% FBS, přes noc. Supernatant byl odstraněn a RPMI1640 obsahující 10% FBS, 16 µg polybrene (na výslednou koncentraci 8 µg/ml) a 1,5 ml retrovirální supernatantu bylo přidáno a odstředěny při 32°C při 2400 ot / min po dobu 2 h. Buňky byly poté inkubovány při 32°C po dobu 1 h, po které supernatant byl odstraněn a nahrazen čerstvý RPMI1640 médiu s 10% FBS a kultivovány po dobu 3 dnů, při 37°C s 5% CO2 (v den 2, kompletní médiu s 1 ng/ml puromycinu by mohly být použity). Rozšířené transfektanty BWZ. CD107a-FLAG byly vyšetřeny na povrchovou expresi FLAG-tagu a poté byly použity pro imunizaci protilátek nebo screening protilátek.
generování CD107a exprimujících Transfektantů
chimérický plazmid CD107a potkanů byl transfektován do buněk CHO. Krátce, CHO buňky byly kultivovány v kompletním médiu RPMI1640 (cRPMI; RPMI1640 médiu s 10% FBS, 1 mm Na Pyruvát, 50µM 2-merkaptoethanolu), až dosáhl 30% konfluence. 2,5 µg plazmidu se smísí s 7,5 µl činidla Fugene 6 (Roche) a přidá se do buněk po kapkách. Dva dny následující, CHO buňky byly odděleny s RPMI1640 střední doplněny 2mM EDTA a byly nasazené v 96-no plochým dnem pro buněčné kultury desky (25 buněk/no) s výběrem střední (cRPMI doplněny 20 µg/ml puromycinu) pro klonování stabilní transfectants. Po 10-12 dnech kultivace byly dospělé klony vyšetřeny protilátkou proti vlajce (M2). Jeden z klonů exprimujících nejvyšší povrchovou úroveň FLAG a CD107a byl použit pro imunizaci.
Očkování a buněčná Fúze
3 – až 10-týden staré mužské arménské inbrední křečky byly očkovány po intraperitoneální injekci (i.p.) s 2 × 106 CHO.CD107a-FLAG buňky jednou týdně po dobu 3 týdnů. Boost s 4 × 106 stabilně transfektovaly BWZ.CD107a-FLAG buňky, dostal jsem.p. 32 dní po prvním očkování a séra byly analyzovány pro povrchové barvení obou CHO.CD107a-FLAG a BWZ.CD107a-TRANSFEKTANTY vlajky. Dvě ze tří zvířat byla pozitivní a 3 dny po posílení byly slezinné buňky odebrány a sloučeny ze dvou zvířat, z nichž jedno mělo splenomegalii. Asi 2,0 × 108 buněk sleziny a 1,4 × 108 NS0 myelomové buňky byly třikrát promyty v DMEM s přísadami (1 mm pyruvát sodný, 0,05 mM 2-merkaptoethanolu a antibiotická/antimykotická) a centrifugována při 90 g po dobu 10 min. Udržet vše při teplotě 37°C. z tohoto bodu vpřed, peleta byla rozpuštěna klepnutím na trubku a předehřáté polyethylenglykol 1500 (Roche) byl přidán po kapkách, zatímco jemně za stálého míchání, po dobu 1 min. Tři ml DMEM s přísadami byly postupně přidány další 3 min dokončovací s extra 7 ml před centrifugována při 500 g. Pelet byl promyt pečlivým splachování (ne promíchání) s DMEM s přísadami a 20% FBS (DMEM-20) a kultivovány přes noc. Buňky byly sklizeny následující den a 100 ml DMEM-20 s 2× hypoxanthin–aminopterin–thymidinu (SIGMA) a 10% hybridomu klonování doplněk (HCS) (PAA) byl přidán. Buněčná suspenze byla přenesena na 96 jamkové desky. Po 12 dnech, supernatanty z rostoucí klony byly testovány pomocí průtokové cytometrie po barvení povrchové antigeny přítomné na BWZ.CD107a-FLAG a CHO.CD107a-FLAG, ale ne na BWZ.36 buněk transfektovaných irelevantními antigeny označenými vlajkou jako negativní kontroly. 9 z 12 pozitivních klonů produkujících specifické protilátky bylo dále subklonováno pomocí DMEM-20 doplněného hypoxanthin-thymidinem a HCS. Pouze jeden klon (SIM1) stále produkoval protilátky po subklonování a toto bylo dále subklonováno ještě jednou. Protilátky IgG specifické pro křečka CD107a byly detekovány FITC anti-arménským křečkem IgG (Jackson Immunoresearch). Anti-CD107a ze SIM1 hybridomu byl čištěn HiTrap Protein G HP (GE Healthcare Life Sciences) a FITC-konjugované podle standardních postupů nebo Alexa488-konjugované podle výrobce protokol.
generace efektorových buněk
ze sleziny byly připraveny jednobuněčné suspenze. Lymfocyty byly izolovány pomocí lymfoprep gradientu a poté přejížděny přes sloupec nylonové vlny, aby se odstranily B buňky a makrofágy. Pro generování NK buněk aktivovaných IL-2 (LAK) byly zbývající buňky kultivovány přes noc v IL-2. Následující den, non-adherentní buňky byly odstraněny promytím PBS a přilnavý NK buňky byly udržovány v RPMI doplněny s IL-2, 10% tepelně inaktivovaného FBS, 1% Streptomycin/Penicilin, 1 mm pyruvát sodný a 50 µM 2-merkaptoethanolu. Buňky byly kultivovány po dobu 8-10 dnů. Pro generování obohacených NK buněk nebo tříděných t a NK buněk byly buňky obohaceny negativní selekcí po kroku nylonové vlny. Pro obohacení NK buněk, pan-mouse IgG Dynabeads (Invitrogen Dynal) byly potažené protilátkami proti makrofágy (OX41), T-buňky (R73 a OX19) a B buněk (OX12 a OX33). Pro obohacení T buněk byly Pan-myší IgG Dynabeady obarveny protilátkami proti makrofágům (OX41)a B buňkám (OX12 a OX33). Buňky byly obohaceny dvěma kroky negativního výběru obarvenými kuličkami po dobu 30 minut při 4°C. Obohacené NK buňky měly čistotu přibližně 50-60% a byly použity pro degranulační studie. Obohacené T buňky (čistota 79-85%) byly dále tříděny pro TCR + buňky pomocí FACS Aria (BD Biosciences).
Degranulace Testy
měření venkovní teplota reakce po barvení s anti-rat CD107a (SIM1) během stimulace cílové buňky, NK efektory a YAC cíle byly buňky inkubovány v poměru 1: 1, 3 × 105 buněk/no (pokud není uvedeno jinak) v médiu obsahujícím SIM1 mAb, ostatní komerčně dostupné anti-CD107a protilátky, nebo izotypů kontrolu. K měření degranulace reakce na protilátky stimulace z NK buněk, jsme použili ploché dno 96-desky potažené s různou koncentrací anti-NKp46 (Wen23), anti-NKR-P1A (3.2.3), a myší IgG1 izotypů ovládání (TIB96). Následující den byly destičky promyty PBS a blokovány cRPMI před přidáním 3 × 105 obohacených NK buněk suspendovaných v cRPMI obsahujících SIM1 byly přidány do jamky. Pro měření degranulace z T buněk byly tříděny a kultivovány v cRPMI s IL-2 po dobu 2-3 dnů. 96-ploché dno desky byly potaženy přes noc se protilátky proti CD3 (IF4), CD2 (OX34), nebo IgM izotypů control (MM-30). Přibližně 3 × 105 T buněk bylo přidáno do jamky v cRPMI obsahujícím SIM1. Všechny testy byly inkubovány po dobu 4 h. Golgistop bylo přidáno za poslední 3 h inkubace, aby se zabránilo degradaci internalizovány CD107a. Buňky byly poté promyty a barveny s protilátkami k příslušné povrchové receptory a analyzovány pomocí FACS Canto nebo LSR II (BD Biosciences).
test uvolňování Chromu
cílové buňky YAC-1 (5 × 106 buněk/ml cRPMI) s přidáním 3.7 MBq51Cr bylo inkubováno při 37°C po dobu 1 hodiny za míchání každých 15 minut. Buňky byly poté třikrát promyty PBS s 2% FBS a resuspendovány na 1 × 105 buněk/ml v cRPMI. Efektorové buňky LAK a cílové buňky byly naneseny ve stanovených poměrech v konečném objemu 200 µl. Buňky byly odstředěny a inkubovány po dobu 4 hodin při 37°C. specifické uvolňování 51Cr bylo měřeno pomocí Cobra auto-gamma (Packard).
Výsledky
K vytvoření protilátek proti CD107a, udělali jsme expresní vektor obsahující extracelulární membránové oblasti krysa, CD107a, transmembránový regionu krysa CD8, a 3′-terminální FLAG-tag pro detekci povrchové vyjádření (Obrázek 1A). Vektor byl transfektován do buněk CHO a BWZ.36 T buněčná linie a screening na expresi CD107a pomocí protilátky proti příznaku (M2) (obrázek 1B). CD107a stabilně transfektovaly CHO buňky byly injikovány do arménské inbrední křečky, jednou týdně po dobu 3 týdnů s konečným zvýšení CD107a stabilně transfektovaly BWZ buňky 3 dny před fusion s NS0 myelomové buněčné linii. Supernatanty z různých klonů byly testovány na specificitu vůči BWZ. CD107a-FLAG, ale ne irelevantní FLAG-tagged BWZ.36 transfektantů. Jeden klon, SIM1, bylo zjištěno, že se vážou konkrétně k CD107a vyjádření transfectant, ale ne na VLAJKU transfektovaly ovládání (Obrázek 1C).

Obrázek 1. Vytvoření monoklonální protilátky proti potkanům CD107a (SIM1). (A) schematická vektorová mapa expresního vektoru pMX s peptidem leader, FLAG-tagem, vložkou CD107a a transmembránovou doménou CD8. B) stabilně transfektovaný vaječník čínského křečka a BWZ.36 buněk bylo testováno na buněčnou povrchovou expresi CD107a označeného vlajkou pomocí protilátky proti vlajce (M2) (stínované histogramy). Negativní kontrolou je samotná sekundární protilátka (průhledný histogram). (C) BWZ buňky transfektovaly s CD107a-FLAG nebo irelevantní antigenu (NKR-P1F-FLAG) byly potřísněné křeček kontrolní sérum, SIM1 supernatant, nebo anti-FLAG protilátkou (M2).
klon SIM1 byl dále testován ve funkční testy paralelně s dvěma komerčně dostupné CD107a protilátky, které by mohly potenciálně cross reagovat s rat CD107a v průtokové cytometrie. Protilátky klony byly testovány H4A3 z AbCam (kříž, který reaguje s člověkem, krysa, myš, a primátů v průtoková cytometrie) a protilátka, klon LS-C8580 od LifeSpan BioSciences (kříž, který reaguje s CD107a od myši, člověka a krysy v imunohistochemie a Western blot podle webové stránky výrobce). Náš klon protilátek SIM1 identifikoval degranulační buňky v přítomnosti cílových buněk a vykazoval malé zbarvení pozadí v nepřítomnosti cílů (obrázek 2A horního panelu). Klon H4A3 obarvil nejvyšší procento NK buněk po stimulaci cílových buněk (střední panel). Byla však také vysoká úroveň barvení pozadí v nepřítomnosti cílových buněk, což naznačuje nespecifickou vazbu. Velmi nízké úrovně degranulace, pokud existují, byly měřeny klonem LS-C8580 mAb (dolní panel). Specificita těchto protilátek byla potvrzena pozitivním barvením transfektantu BWZ. CD107a-FLAG, ale ne BWZ.Kontrola vlajky NKR-P1F (obrázek 2B). Protilátka klon H4A3, které bylo prokázáno, že se vážou na lidské CD107a (16), ne skvrna krysa CD107a transfektovaly BWZ buněk, což naznačuje, tam je žádné křížové reakce s rat CD107a. Anti-mouse CD107a klon ID48 také selhal, aby skvrnu krysa CD107a transfectant. Nekonjugovaný LS-C8580 na druhé straně vykazoval specifické barvení buněk Transfekovaných CD107a (údaje nejsou zobrazeny). Klon LS-C8580 je však k dispozici pouze jako nekonjugovaná protilátka, která není vhodná pro degranulační studie. Opakované pokusy v naší laboratoři časovat LS-C8580 na Alexa488 bohužel nejsou poskytovány žádné silné barvení konjugátů, i když malé velikosti vzorku a koncentrace LS-C8580 může být příčinou špatné časování. Konjugované LS-C8580 ukazuje snížen, ale konkrétní barvení CD107a transfektovaly buněk (Obrázek 2B), ale, jak je znázorněno na Obrázku 2A, jsme nebyli schopni detekovat degranulating buněk během funkčních testů s konjugáty. Závěrem lze říci, že SIM1 mAb specificky obarví degranulační NK buňky potkanů po stimulaci cílovými buňkami.

Obrázek 2. SIM1 měří degranulaci z přírodních zabijáckých (NK) a CD8 T buněk. (A) procenta degranulačních buněk byla měřena pomocí anti-CD107a protilátek SIM1, H4A3 a LS-C8580, s cílovými buňkami YAC-1 nebo bez nich jako stimul. Je ukázán jeden reprezentativní experiment ze čtyř (B). Barvení buněčné linie BWZ. CD107a-FLAG pomocí klonů protilátek SIM1, H4A3, LS-C8580 nebo ID48. BWZ.36 buněk transfekovaných irelevantním antigenem označeným vlajkou (BWZ.NKR-P1G-FLAG) byl použit jako negativní kontrola (C) obohacený NK buňky byly stimulovány s deskou vázán anti-NKp46, anti-NKR-P1A, nebo myší IgG1 jako izotypů kontrolu, a SIM1 byl použit k měření procenta degranulating buněk. Nkp46+ (Wen23) nebo NKR-P1Abright (3.2.3) buňky byly uzavřeny. D) TCR + buňky byly tříděny (Čistota 99%) a kultivovány v IL-2 po dobu 2-3 dnů. Buňky byly poté stimulovány destičkou vázanou anti-CD3 a anti-CD2 nebo myší IgM izotypovou kontrolou pro anti-CD3. Spodní panel ukazuje, stimulace s anti-CD3 a anti-CD2 a barvení s SIM1 izotypů ovládání (FITC hamster IgG polyklonální). T buňky byly tříděny pomocí protilátek R73-Alexa647 a 3.2.3-PB, které byly brány na R73+/3.2.3− buňkách. Uvedená Data pocházejí z jednoho reprezentativního experimentu tří samostatných nezávislých experimentů.
přímá stimulace aktivace NK receptorů prostřednictvím protilátek vázaných na destičku je další účinnou metodou k indukci degranulace. Test SIM1 klon v tomto funkčním testu, jsme inkubovány obohacený NK buněk na destičky potažené protilátkami k aktivaci receptorů NKp46 a NKR-P1A (Obrázek 2C). Jako negativní kontrola byly destičky potaženy myší kontrolou izotypu IgG1. Barvení s SIM1 protilátky identifikovány 25.5 nebo 44% degranulating buněk po NK buněk stimulace v deskách potažených 5 µg/ml anti-NKp46 nebo anti-NKR-P1A, resp. Procento degranulačních buněk se ještě zvýšilo, když byly destičky potaženy vyšší koncentrací stimulačních protilátek (10 µg / ml). V jamkách potažených myší kontrolou izotypu IgG1 nebyla indukována žádná degranulace.
jasně jsme viděli degranulaci v NK buňkách stimulovaných buď cílovými buňkami, nebo protilátkami proti aktivačním receptorům pomocí naší protilátky SIM1. Také jsme to chtěli potvrdit v cytotoxických T buňkách. T buňky byly tříděny ze slezinných buněk a kultivovány v IL-2 po dobu 2-3 dnů. T buňky byly poté stimulovány anti-CD3 a anti-CD2 vázanými na destičku (obrázek 2D). Degranulace byla měřena z kultivovaných CD8+ T buněk při stimulaci anti-CD3 a anti-CD2 v obou dnech 2 a 3. Nebyla měřena žádná degranulace z necytotoxických CD4 T buněk ani po stimulaci kontrolní protilátkou isotypu, což dále prokazuje specificitu naší SIM1 protilátky.
Lymphokine-activated killer (LAK) buňky jsou vytvářeny kultivace NK buněk IL-2 po dobu 7-10 dní a jsou běžně používány jako velmi potentní efektorové buňky v chromium release testy ke studiu cytotoxicity, a proto by měl být schopen generovat vysoké hladiny degranulace. K měření degranulace z LAK buněk jsme původně použili 1:1 poměr efektoru k cílům, ale zjistil neočekávaně nízké úrovně degranulace (údaje nejsou zobrazeny). Při titraci k nalezení optimálního poměru efektoru k cíli jsme však viděli, že zvyšující se úrovně degranulace lze dosáhnout, když byl poměr efektoru k cíli nižší než 1 (obrázek 3A). Optimální poměr pro degranulace testech je proto na rozdíl od cytotoxické testy, kde úroveň cytotoxicity se zvyšuje s vyšší efektorové: cílové poměry (Obrázek 3B).
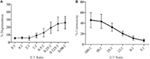
obrázek 3. Nízký efektor:cílové poměry jsou důležité pro zajištění adekvátní citlivosti v degranulačních testech s NK buňkami potkanů. (A) degranulace LAK buněk kultivovaných 8-10 dní v IL-2 proti cílům YAC-1 při různých poměrech efektoru: cíl. (B) cytotoxicita IL-2 kultivovaného LAK proti cílovým buňkám YAC-1 byla potvrzena testem uvolňování Chromu dokončeným ve dnech 8-10. Všechny grafy jsou kumulativní ze tří nebo více samostatných experimentů s pruhy ukazující SD.
Diskuse
V počáteční testování SIM1 a jiné komerční CD107a protilátek v degranulace testech u potkanů, jsme zvolili malý rozsah efektor cíl poměry s zkosení směrem k více efektorové buňky, než cíle na základě aktuální literatury (12, 16, 17). Efektorové na cílové mobilní poměry se mohou lišit z papíru na papír, ale předchozí studie, které titruje efektor cíl poměry ukázaly, že optimální degranulace od myší NK buňky vyvrcholila na 4,5:1 poměr s YAC-1 cílovým buňkám (18) a lidských NK buněk zabil K562 buněk nejlepší v poměru 5:1 nebo 10:1 (12). Při použití většího rozsahu efektorových a cílových poměrů však ukazujeme, že degranulace pomocí buněk rat LAK byla účinněji indukována při použití čtyř nebo více cílů na efektorovou buňku. Tento rozdíl v optimální efektorové:cílové poměr mezi krysy a jiné druhy by mohly být vzhledem k typu cílové buňky použity, jako lidské a myší efektor cíl poměr titrací v uvedených studiích použity cílové buňky, které pochází ze stejného druhu. Efektorové buňky mohou být citlivější na cílové buňky stejného druhu, a proto potřebují méně cílových buněk, aby se aktivovaly. Buněčná linie YAC-1 použitá v naší studii je myší T buněčný lymfom, který je po mnoho let standardem pro stimulaci cytotoxicity z potkaních NK buněk. Nemůžeme vyloučit, že použití cílové buňky potkanů by vedlo k silnější stimulaci NK buněk a následně by mohlo být zapotřebí méně cílových buněk k indukci degranulace.
To je také jasné z této studie, že efektor cíl poměry používá pro testy cytotoxicity nekorelují dobře s poměry potřebný k měření optimální venkovní teplota reakce v efektorové buňky. To není překvapivé, protože čtení těchto dvou testů je odlišné, s cytotoxicitou měřící smrt cílových buněk, a degranulace měřící odpověď NK na cíle.
Na závěr jsme vybrali protilátka proti krysa CD107a (SIM1) a charakterizován jeho schopnost detekovat degranulace v cytotoxických lymfocytů u potkanů. Ukázali jsme, že SIM1 je specifické pro degranulating buněk, a to prostřednictvím optimalizace degranulace protokolu, jsme zjistili, že pomocí efektorové:cílové buňky poměr nižší než 1:4 zajistí optimální stimulaci LAK buněk. Rozvoj anti-rat CD107a (SIM1) umožňuje lepší analýzu a charakterizaci cytotoxické reakce krysa lymfocyty a bude cenným nástrojem v mnoha modelech onemocnění krysy.
etické prohlášení
studie je schválena Národním úřadem pro výzkum zvířat (FDU) v Norsku (číslo povolení: ID-1698).
autorské příspěvky
AS byl zodpovědný za analýzu výrazů, funkční testy a psaní rukopisu. K-ZD provedl klonování cDNA a generování transfektantů. JTV se podílela na plánování a dohledu nad projektem, a při psaní rukopisu. LK byl zodpovědný za imunizace, technologie hybridomu, psaní rukopisu, a dohled nad projektem.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
Poděkování
autoři děkuji Ulla Heggelund a Stine Martinsen pro technickou pomoc v laboratoři, a personál v zařízení pro zvířata na Katedře Srovnávací Medicíny na Oslo, Oslo University Hospital pro pomoc s očkování. Díky Marit Inngjerdingen pro vědecké diskuse.
financování
výzkum byl financován University of Oslo, jihovýchodní Norsko Regional Health (2009104), a Legatet til Henrik Homans Minde.
1. Oranžová JS. Tvorba a funkce lytické NK-buněčné imunologické synapse. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038/nri2381
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
2. Metkar SS, Marchioretto M, Antonini V, Lunelli L, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. Perforinové póry v endosomální membráně spouštějí uvolňování endocytovaného granzymu B do cytosolu cílových buněk. Nat Immunol (2011) 12(8):770-7. doi: 10.1038 / ni.Do roku 2050
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
5. Voskoboinik I, Whiskstock JC, Trapani JA. Perforin a granzymy: funkce, dysfunkce a lidská patologie. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens A, Benestad HB, Vaage JT, et al. Druhá profylaktická transplantace kostní dřeně neshodná s MHC chrání před akutní myeloidní leukémií potkanů (BNML) bez smrtelného onemocnění štěpu proti hostiteli. Transplantace (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
14. Onishi M, Kinoshita S, Morikawa Y, Shibuya A, Phillips J, Lanier LL, et al. Aplikace retrovirem zprostředkovaného klonování výrazů. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Snížená degranulace NK buněk u pacientů s často se opakujícím herpesem. Clin Vakcína Immunol (2011) 18(9):1410-5. doi: 10.1128/CVI.05084-11
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Wood SM, Björkström NK, Long EO, et al. Funkční analýza lidských NK buněk průtokovou cytometrií. Metody Mol Biol (2010) 612: 335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
