Vzdělávací Cíle
- Napište chemický vzorec pro jednoduché iontové sloučeniny.
- rozpoznávají polyatomické ionty v chemických vzorcích.
již jsme se setkali s některými chemickými vzorci pro jednoduché iontové sloučeniny. Chemický vzorec je stručný seznam prvků ve sloučenině a poměry těchto prvků. Abychom lépe porozuměli tomu, co chemický vzorec znamená, musíme zvážit, jak je iontová sloučenina konstruována z jejích iontů.
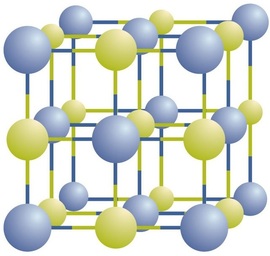
Iontové sloučeniny existovat jako střídající kladné a záporné ionty v pravidelné, trojrozměrné pole krystaly (Obrázek \(\PageIndex{1}\)). Jak vidíte, v poli nejsou žádné jednotlivé \(\ce{NaCl}\) „částice“; místo toho existuje souvislá mřížka střídavých iontů sodíku a chloridu. Jako způsob popisu sloučeniny však můžeme použít poměr sodných iontů K chloridovým iontům, vyjádřený v nejnižších možných celých číslech. V případě chloridu sodného je poměr sodných iontů K chloridovým iontům vyjádřený v nejnižších celých číslech 1:1, takže použijeme \(\ce{NaCl}\) (jeden \(\ce{Na}\) symbol a jeden \(\ce{Cl}\) symbol) reprezentovat sloučeninu. \(\Ce{NaCl}\) je tedy chemický vzorec pro chlorid sodný, což je stručný způsob popisu relativního počtu různých iontů ve sloučenině. Makroskopický vzorek se skládá z myriád párů NaCl; každý jednotlivý pár se nazývá jednotka vzorců. I když je vhodné si myslet, že krystaly \(\ce{NaCl}\) jsou složeny z jednotlivých jednotek \(\ce{NaCl}\), obrázek \(\PageIndex{1}\) ukazuje, že žádný jediný ion není spojen výhradně s žádným jiným jednotlivým iontem. Každý ion je obklopen ionty opačného náboje.
vzorec pro iontovou sloučeninu se řídí několika konvencemi. Nejprve je kation zapsán před aniontem. Protože většina kovů tvoří kationty a většina nekovů tvoří anionty, vzorce obvykle uvádějí nejprve kov a poté nekov. Za druhé, poplatky nejsou zapsány ve vzorci. Pamatujte, že v iontové sloučenině jsou složkami ionty, nikoli neutrální atomy, i když vzorec neobsahuje náboje. Konečně, správný vzorec pro iontovou sloučeninu má vždy čistý nulový náboj, což znamená, že celkový kladný náboj se musí rovnat celkovému zápornému náboji. Chcete-li určit správný vzorec jakékoli kombinace iontů, určete, kolik z každého iontu je zapotřebí k vyvážení celkových kladných a záporných nábojů ve sloučenině.
toto pravidlo je nakonec založeno na skutečnosti, že hmota je celkově elektricky neutrální.
podle konvence předpokládejme, že existuje pouze jeden atom, pokud není přítomen index. Nepoužíváme 1 jako index.
Pokud se podíváme na iontové sloučeniny obsahující ionty lithia a iontů bromidu, vidíme, že lithium-iontová má 1+ charge a bromidový ion má 1− náboj. K vyvážení těchto nábojů je zapotřebí pouze jeden ion z každého. Vzorec pro bromid lithný je \(\ce{LiBr}\).
Když je iontová sloučenina vytvořena z hořčíku a kyslíku, má iont hořčíku náboj 2+ a atom kyslíku má 2 náboje. Ačkoli oba tyto ionty mají vyšší náboje než ionty v bromidu lithném, stále se navzájem vyvažují v poměru jedna ku jedné. Proto je správný vzorec pro tuto iontovou sloučeninu \(\ce{MgO}\).
nyní zvažte iontovou sloučeninu tvořenou hořčíkem a chlorem. Hořečnatý iont má náboj 2+, zatímco chlórový iont má 1 náboj:
\
kombinace jednoho iontu z každého nevyváží úplně kladné a záporné náboje. Nejjednodušší způsob, jak vyvážit tyto náboje, je předpokládat přítomnost dvou chloridových iontů pro každý iont hořčíku:
\
nyní jsou kladné a záporné náboje vyvážené. Mohli bychom napsat chemický vzorec pro tento iontové sloučeniny jako \(\ce{MgClCl}\), ale konvence je použít číselný index, pokud existuje více než jeden iont daného typu\(\ce{MgCl2}\). Tento chemický vzorec říká, že v tomto vzorci je jeden iont hořčíku a dva chloridové ionty. (Nečtěte“ Cl2 “ část vzorce jako molekulu diatomického elementárního chloru. Chlor v této sloučenině neexistuje jako diatomický prvek. Spíše existuje jako dva jednotlivé chloridové ionty.) Podle konvence se ve vzorcích iontových sloučenin používá nejnižší poměr celého čísla. Vzorec \(\ce{Mg2Cl4}\) má vyvážený poplatky s ionty v poměru 1:2, ale to není nejnižší celé číslo poměru.
u sloučenin, u kterých poměr iontů není tak zřejmý, lze dolní indexy ve vzorci získat křížením nábojů: použijte absolutní hodnotu náboje na jednom iontu jako index pro druhý iont. Tato metoda je schematicky znázorněna na obrázku 3.3.2.
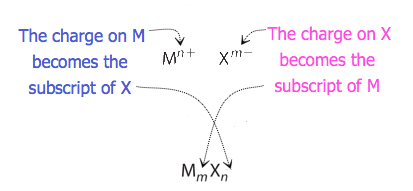
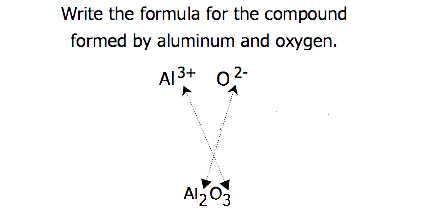
Při přechodu poplatky, je někdy nutné snížit indexy se jejich nejjednodušší poměr napsat empirický vzorec. Zvažte například sloučeninu tvořenou PB4+ a O2 -. Použití absolutních hodnot nábojů na iontech jako indexů dává vzorec Pb2O4. To zjednodušuje jeho správný empirický vzorec PbO2. Empirický vzorec má jeden iont Pb4+ a dva ionty O2.
příklad \(\PageIndex{1}\)
napište chemický vzorec pro iontovou sloučeninu složenou z každé dvojice iontů.
- ionty sodíku a síry ion
- hliníkové ion a fluoridových iontů
- 3+ ion železa a kyslíku ion
Řešení
- získat valenční oktet, sodík tvoří ion s 1+ náboj, zatímco síra ion má 2− poplatek. K vyvážení 2-náboje na sírovém iontu jsou zapotřebí dva ionty sodíku 1+. Spíše než psát vzorec jako \(\ce{NaNaS}\), zkrátíme jej konvencí na \(\ce{na2s}\).
- hliníkový iont má náboj 3+, zatímco fluoridový ion tvořený fluorem má 1 náboj. K vyvážení 3+ náboje na hliníkovém iontu jsou zapotřebí tři fluorové 1− ionty. Tato kombinace je zapsána jako \(\ce{AlF3}\).
- železo může tvořit dva možné ionty, ale zde je specifikován iont s nábojem 3+. Atom kyslíku má 2 náboje jako iont. K vyrovnání kladných a záporných nábojů, se podíváme na nejmenší společný násobek—6: dvě železa 3+ ionty dá 6+, zatímco tři 2− ionty kyslíku bude dát 6−, a tím vyrovnávání celkové kladné a záporné náboje. Vzorec pro tuto iontovou sloučeninu je tedy \(\ce{Fe2O3}\). Alternativně použijte metodu křížení poplatků znázorněnou na obrázku 3.3.2.
Cvičení \(\PageIndex{1}\)
Napište chemický vzorec iontové sloučeniny složené z každé dvojice iontů.
- iontů vápníku a kyslíku ion
- 2+ ion mědi a síry ion
- 1+ ion mědi a síry ion
Odpověď:
CaO
Odpověď b:
CuS
Odpověď c:
Cu2S
Polyatomic Ionty
Některé ionty se skládají ze skupin atomů kovalentně vázané dohromady a celkový elektrický náboj. Protože tyto ionty obsahují více než jeden atom, nazývají se polyatomické ionty. Lewisovy struktury, názvy a vzorce některých polyatomických iontů jsou uvedeny v tabulce 3.3.1.
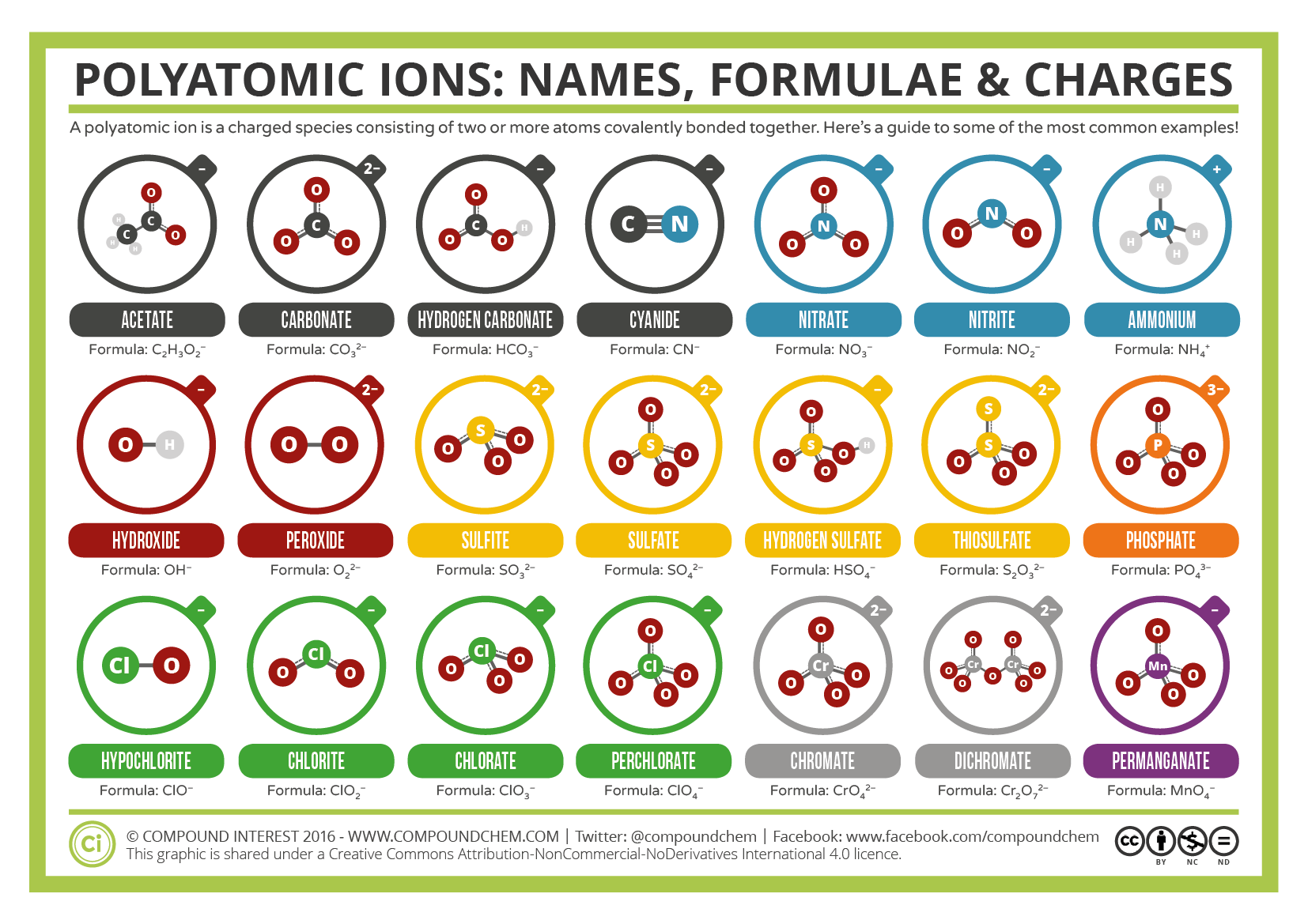
Tabulka \(\PageIndex{1}\): Některé Polyatomic Ionty
Polyatomic ionty mají definované vzorce, názvy a poplatky, které nelze žádným způsobem změněny. Tabulka \(\PageIndex{2}\) uvádí názvy iontů a iontové vzorce nejběžnějších polyatomických iontů. Například \(\ce{NO3^ { – }}\) je dusičnanový iont; má jeden atom dusíku a tři atomy kyslíku a celkový 1-náboj. Obrázek \(\PageIndex{2}\) uvádí nejběžnější polyatomické ionty.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. Zbývající polyatomické ionty jsou všechny záporně nabité, a proto jsou klasifikovány jako anionty. Avšak pouze dva z nich, hydroxidový iont a kyanidový iont, jsou pojmenovány pomocí přípony „- ide“, která obvykle svědčí o záporně nabitých částicích. Zbývající polyatomic ionty, které všechny obsahují kyslík, v kombinaci s další non-metal, existují jako součást řady, v nichž počet kyslíků ve polyatomic jednotky se může lišit. Jak bylo opakovaně zdůrazněno v několika částech tohoto textu, žádné dva chemické vzorce by neměly sdílet společný Chemický název. Jedna přípona, „- ide, “ je nedostatečná pro rozlišení názvů aniontů v příbuzné polyatomické řadě. Proto, „snědla“ a „-ite“ přípony jsou zaměstnáni, aby se označuje, že odpovídající polyatomic ionty jsou součástí řady. Navíc tyto přípony také označují relativní počet kyslíků, které jsou obsaženy v polyatomických iontech. Všimněte si, že všechny polyatomické ionty, jejichž jména končí na „- ate“, obsahují o jeden kyslík více než ty polyatomické anionty, jejichž jména končí na “ – ite.“Bohužel, podobně jako běžný systém pro pojmenování přechodných kovů, tyto přípony označují pouze relativní počet kyslíků obsažených v polyatomických iontech. Například, amonného iontu, který je symbolizován jako NO3−1, má více kyslíku, než dusitan ion, který je symbolizován jako NO2−1. Síranový ion je však symbolizován jako SO4-2. Zatímco dusičnanový iont i síranový ion sdílejí příponu „ate“, první obsahuje tři kyslíky, ale druhý obsahuje čtyři. Kromě toho jak dusičnanový iont, tak siřičitanový iont obsahují tři kyslíky, ale tyto polyatomické ionty nesdílejí společnou příponu. Bohužel relativní povaha těchto přípon nařizuje, že kombinace iontového vzorce/iontového jména polyatomických iontů musí být jednoduše zapamatovány.
pravidlo pro konstrukci vzorce pro iontové sloučeniny obsahující polyatomic iontů je stejná jako u vzorce obsahující monoatomární (single-atom) ionty: kladné a záporné náboje musí být v rovnováze. Je-li více než jeden konkrétní polyatomic iontů je potřeba vyvážit poplatku, celá vzorec pro polyatomic iontů musí být uzavřeny v závorkách, a číselný index je umístěn mimo závorky. To ukazuje, že index se vztahuje na celý polyatomický iont. Dva příklady jsou uvedeny níže:

Například \(\PageIndex{2}\)
Napište chemický vzorec iontové sloučeniny složené z každé dvojice iontů.
- ion draslíku a hořečnatý ion
- vápenatých iontů a dusičnanů ion
Řešení
- ionty Draslíku mají náboj 1+, zatímco síran ionty mají náboj 2−. K vyrovnání náboje na síranovém iontu budeme potřebovat dva ionty draslíku, takže správný chemický vzorec je \(\ce{K_2SO_4}\).
- vápenaté ionty mají náboj 2+, zatímco dusičnanové ionty mají náboj 1−. Budeme potřebovat dva dusičnanové ionty, abychom vyrovnali náboj na každém iontu vápníku. Vzorec pro dusičnany musí být uveden v závorkách. Jako vzorec pro tuto iontovou sloučeninu tedy píšeme \(\ce{Ca(NO3)2}\).
Cvičení \(\PageIndex{2}\)
Napište chemický vzorec iontové sloučeniny složené z každé dvojice iontů.
- iontů hořčíku a uhličitanů ion
- hliníkové ion a acetát ion
Odpověď:
Mg2+ a CO32- = MgCO3
Odpověď b:
Al3+ a C2H3O2- = Al(C2H3O2)3
Rozpoznávání Iontové Sloučeniny
Existují dva způsoby, jak rozpoznat iontové sloučeniny. Za prvé, sloučeniny mezi kovovými a nekovovými prvky jsou obvykle iontové. Například CaBr2 obsahuje kovový prvek (vápník, kov skupiny 2A) a nekovový prvek (brom, skupina 7A nekov). Proto je s největší pravděpodobností iontovou sloučeninou. (Ve skutečnosti je to iontové.) Naproti tomu sloučenina NO2 obsahuje dva prvky, které jsou oba nekovy (dusík ze skupiny 5A a kyslík ze skupiny 6A). Není to iontová sloučenina, patří do kategorie kovalentních sloučenin. Všimněte si také, že tato kombinace dusíku a kyslíku nemá specifikovaný elektrický náboj, takže to není dusitanový iont.
za druhé, pokud rozpoznáte vzorec polyatomického iontu ve sloučenině, je sloučenina iontová. Například pokud vidíte vzorec \(\ce{Ba (NO3)2}\), můžete rozpoznat část “ NO3 “ jako dusičnanový iont, \(\rm{NO_3^ -}\). (Pamatujte, že konvence pro psaní vzorců pro iontové sloučeniny nezahrnuje iontový náboj.) To je vodítko, že druhá část vzorce, \(\ce{Ba}\), \(\ce{Ba^{2+}}\) ion, s 2+ poplatek vyrovnávání celkově 2− poplatek ze dvou nitrátové ionty. Tato sloučenina je tedy také iontová.
příklad \(\PageIndex{3}\)
Identifikujte každou sloučeninu jako iontovou nebo neiontovou.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{Z2}\)
Řešení
- Sodík je kov, a kyslík je nekovový; proto \(\ce{Na2O}\) se očekává, že bude iontové.
- fosfor i chlor jsou nekovy. Proto \(\ce{PCl3}\) není iontový.
- \(\ce{NH4}\) ve vzorci představuje amonný iont, \(\ce{NH4^ {+}}\), což naznačuje, že tato sloučenina je iontová.
- kyslík i fluor jsou nekovy. Proto \(\ce{OF2}\) není iontový.
cvičení \(\PageIndex{3}\)
Identifikujte každou sloučeninu jako iontovou nebo neiontovou.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(NH4)3PO4}\)
- \(\ce{SOCl2}\)
Odpověď:
není iontové
Odpověď b:
iontové
Odpověď c:
iontové
Odpověď d:
není iontové
při Bližším Pohledu: Krev a Mořské vody,
Věda již dlouho známo, že krev a mořské vody mají podobné složení. Koneckonců, obě kapaliny mají v nich rozpuštěné iontové sloučeniny. Podobnost může být více než pouhá náhoda, mnoho vědců si myslí, že první formy života na zemi vznikly v oceánech. Bližší pohled však ukazuje, že krev a mořská voda jsou zcela odlišné. 0,9% roztok chloridu sodného se blíží koncentraci soli nalezené v krvi. Naproti tomu mořská voda je v zásadě 3% roztok chloridu sodného, což je více než trojnásobek koncentrace v krvi. Tady je srovnání množství iontů v krvi a mořské vody:
| Ion | Procenta v Mořské vodě | Procenta v Krvi |
|---|---|---|
| Na+ | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Tento rozdíl je významný, protože iont hydrogenuhličitanu a některé příbuzné ionty mají zásadní roli při kontrole acidobazických vlastností krve. Množství iontů hydrogenfosforečnanu – \(\ce{HPO4^{2 -}}\) a \(\ce{H2PO4^{ – }}\) – v mořské vodě je velmi nízké, ale jsou přítomny ve vyšších množstvích v krvi, kde také ovlivňují acidobazické vlastnosti. Dalším pozoruhodným rozdílem je, že krev nemá významné množství síranového iontu (\(\ce{SO4^{2−}}\)), tento iont je však přítomen v mořské vodě.
Klíčové Takeaways
- Správné chemické vzorce pro iontové sloučeniny rovnováhu celkový kladný náboj se celkový záporný náboj.
- existují také skupiny atomů s celkovým nábojem, nazývané polyatomické ionty.
cvičení
-
jaké informace jsou obsaženy ve vzorci iontové sloučeniny?
-
proč chemické vzorce pro některé iontové sloučeniny obsahují indexy, zatímco jiné ne?
3. Napište chemický vzorec pro iontovou sloučeninu tvořenou každou dvojicí iontů.
- Mg2+ a I−
- na+ a O2−
4. Napište chemický vzorec pro iontovou sloučeninu tvořenou každou dvojicí iontů.
- Na+ a Br−
- Mg2+ a Br−
- Mg2+ a S2−
5. Napište chemický vzorec pro iontovou sloučeninu tvořenou každou dvojicí iontů.
- K+ a Cl−
- Mg2+ a Cl−
- Mg2+ a Se2−
6. Napište chemický vzorec pro iontovou sloučeninu tvořenou každou dvojicí iontů.
- Na+ a N3−
- Mg2+ a N3−
- Al3+ a S2−
7. Napište chemický vzorec pro iontovou sloučeninu tvořenou každou dvojicí iontů.
- Li+ a N3−
- Mg2+ a P3−
- Li+ a P3−
8. Napište chemický vzorec pro iontovou sloučeninu tvořenou každou dvojicí iontů.
- Fe3+ a Br−
- Fe2+ a Br−
- Au3+ a S2−
- Au+ a S2−
9. Napište chemický vzorec pro iontovou sloučeninu tvořenou každou dvojicí iontů.
- Cr3+ a O2−
- Cr2+ a O2−
- Pb2+ a Cl−
- Pb4+ a Cl−
10. Napište chemický vzorec pro iontovou sloučeninu tvořenou každou dvojicí iontů.
- Cr3+ a NO3−
- Fe2+ a PO43−
- Ca2+ a CrO42−
- Al3+ a OH−
11. Napište chemický vzorec pro iontovou sloučeninu tvořenou každou dvojicí iontů.
- NH4+ a NO3−
- H+ a Cr2O72−
- Cu+ a CO32−
- Na+ a HCO3−
12. Pro každou dvojici prvků určete náboj jejich iontů a mezi nimi napište správný vzorec pro výslednou iontovou sloučeninu.
- Ba A S
- Cs a I
13. Pro každou dvojici prvků určete náboj jejich iontů a mezi nimi napište správný vzorec pro výslednou iontovou sloučeninu.
- K A S
- Sc a Br
14. Které sloučeniny byste předpovídali jako iontové?
- Li2O
- (NH4)2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Které sloučeniny byste předpovídali jako iontové?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CrO4
- C8H18
- NH3
Odpovědi
1. poměr každého druhu iontu ve sloučenině
2. Někdy je zapotřebí více než jeden iont k vyvážení náboje na druhém iontu v iontové sloučenině.
- MgI2
- Na2O
- NaBr
- MgBr2
- MGS
- KCL
- MgCl2
- mgse
- na3n
- mg3n2
- al2s3
- li3n
- mg3p2
- li3p
- febr3
- febr2
- au2s3
- au2s
- Cr2O3
- CRO
- PbCl2
- PbCl4
- Cr(No3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- h2cr2o7
- cu2co3
- NaHCO3
- Ba2+, S2−, bas
- cs+, i−, CSI
- K+, S2−, K2s
- SC3+, br−, scbr3
- Iontová
- není Iontové
- Iontová
- není Iontové
- není Iontové
- není Iontové
- není Iontové
- není Iontové
- div>
- iontové
not iontové not iontové - iontové
not iontové not iontové
- iontové
